中枢神经损伤包括脊髓损伤(Spinal cord injury, SCI)导致不可逆的中枢神经组织丧失,其治疗一直是神经科学与再生领域面临的重大科学难题。严重脊髓损伤患者出现下肢瘫痪,给患者、家庭及社会带来沉重的经济负担。研究发现,通过移植不同类型的神经细胞可在不同程度上改善SCI小鼠的运动功能,这表明神经细胞移植治疗脊髓损伤具有重大的应用潜力。诱导多能干细胞(Induced pluripotent stem cells,iPSCs)衍生的2D神经细胞移植可以避免免疫排斥,但存在成瘤风险、定向分化操作复杂以及移植后的随机扩散等问题。脊髓是高度特化的神经组织,神经细胞具有多样性和严格的空间分布,其发挥精细的神经信号传导和处理功能。目前,无论体外还是体内诱导产生具有精细结构的脊髓组织都面临巨大挑战。近年来,直接重编程内源性胶质细胞为神经元成为中枢神经系统(Central Nervous System, CNS)损伤修复的新策略,该策略不需要进行细胞移植即可促进神经元再生,且避免了免疫排斥反应。前期研究表明调控基因表达或使用小分子药物,小鼠和人的星形胶质细胞可以在体外和体内重编程为不同类型的神经元。然而,这些诱导的神经元不具备增殖和神经器官发生的能力。因此,利用中枢神经细胞直接再生出具有精细结构的3D脑与脊髓类器官,将为中枢神经组织损伤修复提供更大的应用潜力。
2022年11月25日,复旦大学脑科学转化研究院邵志成团队在国际著名期刊Nature Biomedical Engineering杂志上在线发表了题为Generation of neural organoids for spinal-cord regeneration via the direct reprogramming of human astrocytes的最新研究成果。该团队发现人星形胶质细胞可被直接重编程为早期神经外胚层细胞,被重编程细胞不仅自组装形成皮层类器官,且在特定脊髓发育信号的激活下,可以定向诱导为具有背-腹侧空间结构的特异性脊髓类器官,将该脊髓类器官移植到完全SCI小鼠模型中,发现其能存活,分化成脊髓神经细胞并与宿主神经元形成突触连接。该研究初次实现了直接利用体细胞再生3D神经组织修复中枢神经系统损伤,为今后开发内源性胶质细胞促进神经组织器官再生的研究奠定坚实的基础,加速中枢神经再生基础与临床转化研究。

1. 人星形胶质细胞再生皮层类器官
邵志成团队在这项课题研究中,系统性开展了不同发育阶段星形胶质细胞重编程神经类器官的研究,即人发育期星形胶质细胞和胶质瘤患者灶旁分离的正常星形胶质细胞(图-1)。在过表达转录因子OCT4和抑制p53基因表达的基础上,首先在人星形胶质细胞上进行小分子化合物的筛选,首次发现小分子化合物组合CHIR99021、SB431542、RepSox和Y27632能够有效地将其直接重编程为神经外胚层细胞(Neuroectodermal cell)(图-1, a)。重编程后的神经外胚层细胞经过悬浮培养,自组装形成皮层类器官(Cortical organoid)(图-1, b),该皮层类器官具有典型的脑室区结构(Ventricular zone), 并可成熟分化为脑室下区神经元(Subventricular zone neuron)(图-2, a)。电生理功能性分析表明皮层类器官神经元具有典型的电生理活性特征。
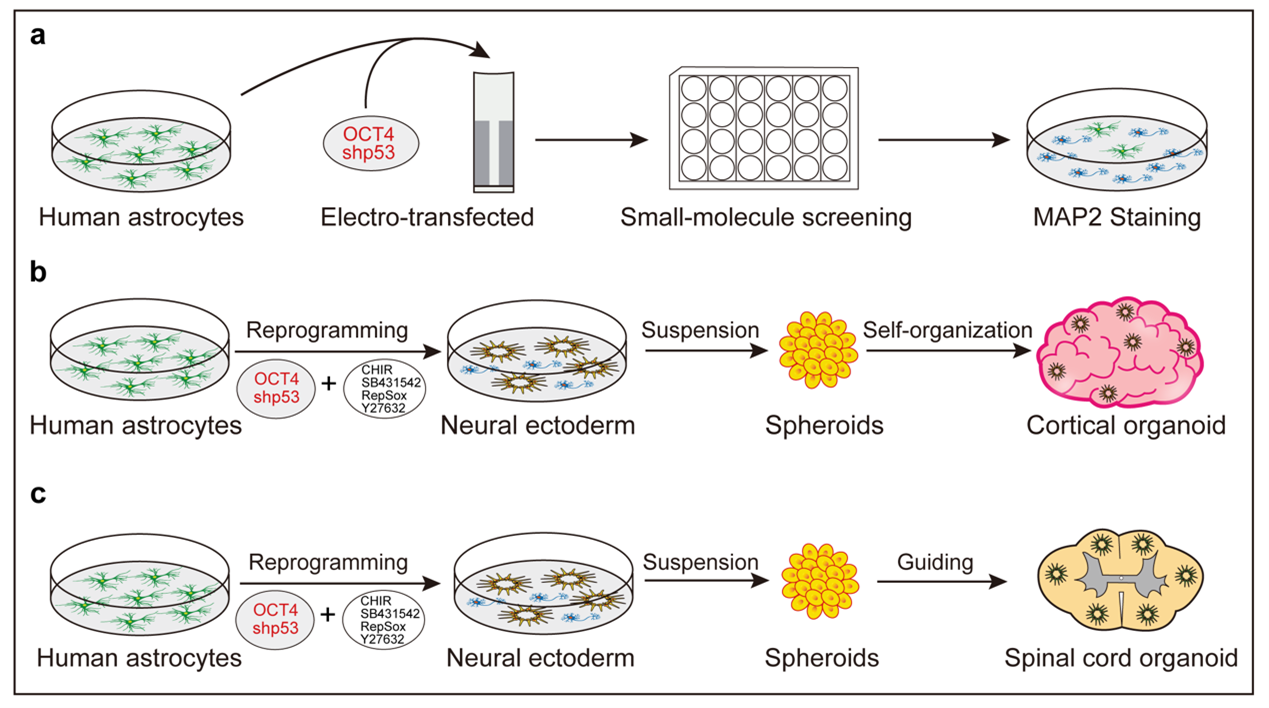
图-1 人星形胶质细胞重编程再生神经类器官
2. 人星形胶质细胞可以定向诱导成脊髓类器官
那么人的星形胶质细胞能否被诱导成脊髓类器官呢?团队进一步研究发现通过精准调控脊髓特异的诱导信号(如SHH, BMP4, bFGF 和RA),重编程后的神经外胚层细胞可定向诱导为具有背侧结构的脊髓类器官(Spinal-cord organoid)(图-1, c);免疫染色和单细胞测序分析发现:脊髓类器官包含运动神经元,GABA能中间神经元和谷氨酸能兴奋性神经元等丰富的神经细胞类群(图-2, b);电生理和微电极阵列分析(Microelectrode array analysis)表明脊髓类器官具有成熟的电生理活性。
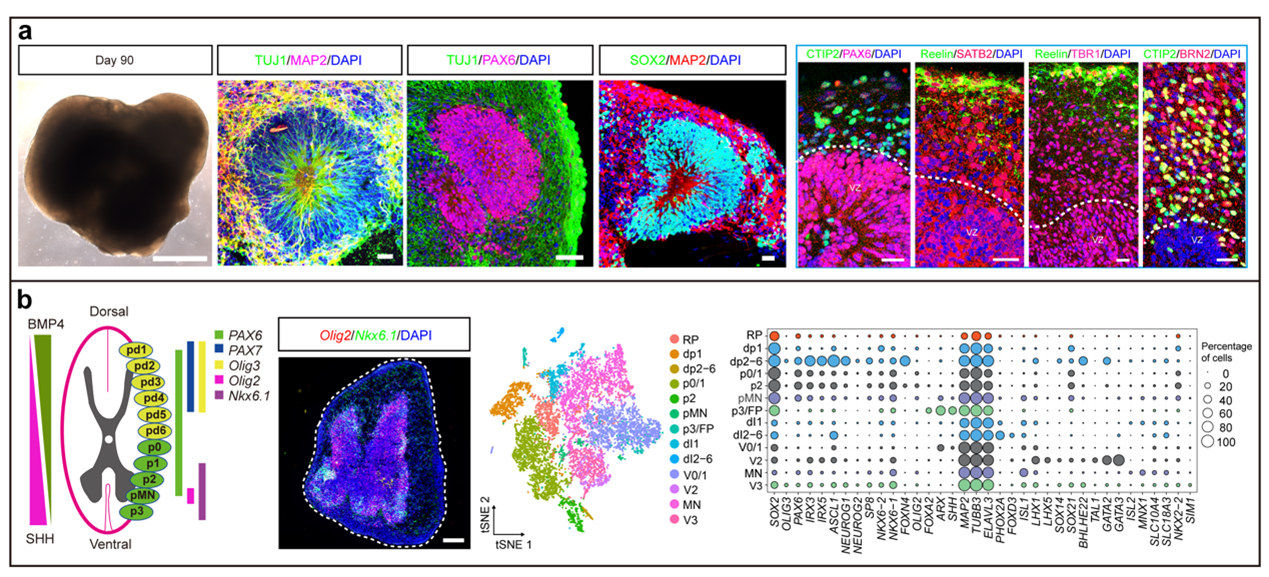
图-2 再生皮层类器官与脊髓类器官
3. 脊髓类器官移植:突触连接发生
最后,团队继续将人星形胶质细胞来源的脊髓类器官移植到脊髓段组织(T9-T10)完全切除的免疫缺陷小鼠模型(NOD/SCID)病灶区,结果发现脊髓类器官不仅能够在病灶区存活,维持脊髓类器官细胞特征,而且能够迁移到到小鼠正常脊髓组织内部,与宿主神经元建立突触连接。这在一定程度上起到连接上下行脊髓神经的作用,很好改善下行脊髓萎缩的症状(图-3)。
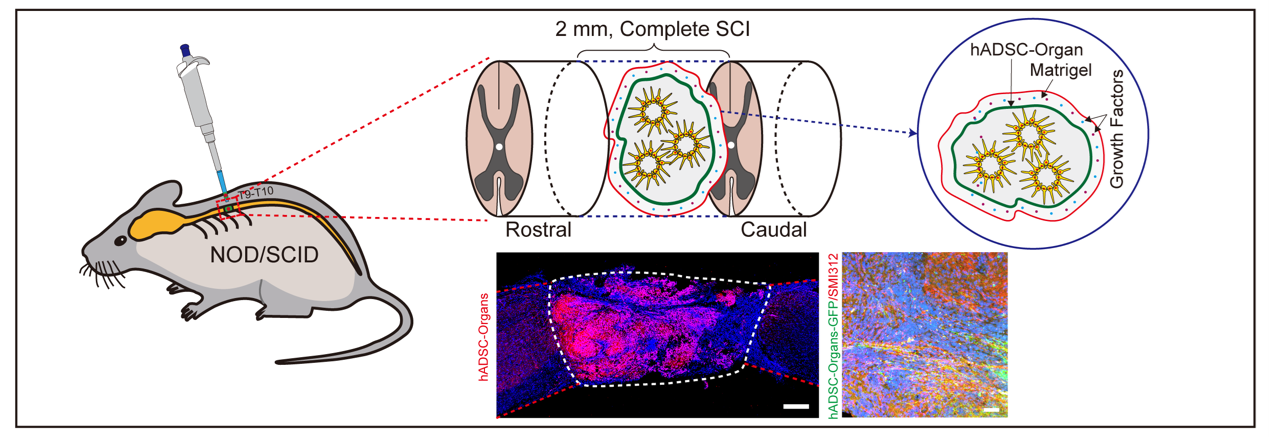
图-3 脊髓类器官移植治疗脊髓损伤
综上所述,这项研究开创了人星形胶质细胞直接重编程为神经类器官的方法,首次启动胶质细胞直接再生神经组织的全新策略,为今后中枢神经系统组织损伤修复提供了可能。未来利用内源性胶质细胞直接再生特定区域的中枢神经组织干预脑疾病,必将具有重要的应用前景。
复旦大学脑科学转化研究院邵志成实验室的许锦洪、方诗是研究论文的共同第一作者。舒友生教授及实验室成员(邓穗馨),纽约医学院Sangmi Chung教授,邵志成教授实验室其他成员(李慧娟和黄永恒)以及厦门大学附属中山医院神经外科医生林晓宁也对该研究做出了重要贡献。邵志成研究员为本研究论文的通讯作者。
该研究得到科技部科技创新2030-“脑科学与类脑研究”重大项目、国家自然科学基金、上海市自然科学基金、复旦大学教育部脑科学前沿中心和厦门大学相关科研资金的大力支持。
原文链接:https://www.nature.com/articles/s41551-022-00963-6