一、小胶质细胞在全身麻醉过程中的身份尚不明确
Science杂志在创刊125周年之际,主编唐纳德团队提出未来25年亟待解决的125个前沿科学问题,其中就包括探索全麻药的作用机制这一重要问题1。由于临床常用麻醉剂的靶点集中表达在神经元上,如丙泊酚作用的GABAA受体、ketamine作用的NMDA受体、右美托咪定作用的α2肾上腺素受体等等,因此目前全麻药的机制研究主要聚焦在神经元和神经环路水平2-4。
小胶质细胞是中枢神经系统常驻的免疫细胞,在CNS发育、稳态维持和神经退行性病变等多个生理和病理进程中起关键作用5-7。既往研究表明,小胶质细胞在癫痫8、高血压9等多种病理模型中,对神经网络稳态的维持至关重要。而在麻醉过程中,小胶质细胞的形态发生明显改变,并伴随钙活动增强10,11。但是,这种中枢神经系统的免疫细胞是否会主动参与麻醉觉醒过程的调控鲜有报道。本团队报道了小胶质细胞对麻醉状态的调控及其机制,以Microglia facilitate and stabilize the response to general anesthesia via modulating the neuronal network in a brain region-specific manner为题发表在生命医学类著名期刊eLife上(图1)12。

图1 本研究的论文封面截图。
二、小胶质细胞依赖P2Y12受体调控麻醉觉醒过程
作者研究团队前期研究成果表明,使用CSF1R抑制剂PLX5622可以清除脑内99%的小胶质细胞,而在停药21天后小胶质细胞的密度和转录表达谱都会恢复到基础水平13。因此,作者利用PLX5622构建小胶质细胞清除模型,探索小胶质细胞对于麻醉觉醒过程的影响。翻正反射行为检测和脑电/肌电记录结果均表明,相较于对照组,PLX5622处理后小鼠进入麻醉状态的时间延长(不易麻醉),恢复觉醒状态的时间缩短(容易觉醒)。这一现象在GABA受体激动剂(戊巴比妥钠、丙泊酚)和NMDA受体激动剂(ketamine)诱导的麻醉过程中均有体现,并且不受外周髓系细胞清除的影响。神经元中c-Fos的表达常常与神经元的兴奋性放电活动有关,被认为是神经元激活的标志。由于Fos mRNA 响应速度远快于c-Fos蛋白表达14,作者用Fos mRNA标记麻醉状态下激活的神经元,用c-Fos蛋白标记麻醉前清醒状态下激活的神经元。免疫荧光结果表明,清除小胶质细胞后,无论麻醉状态还是清醒状态,促进麻醉的核团(AABR,Aesthesia Active Brain Region)中神经元活动都会出现不同程度降低,而促进觉醒的核团(EABR,Emergence Active Brain Region)中神经元活动则会出现不同程度增强。电生理记录的结果进一步证实了小胶质细胞对于神经元兴奋抑制平衡的重要调控作用。在清除小胶质细胞后,促进麻醉的下丘脑视上核(SON,supraoptic nucleus)E/I平衡偏向抑制,促进觉醒的蓝斑(LC,locus coeruleus)E/I平衡偏向兴奋。在分子机制方面,作者利用转基因小鼠和药理学调控等多种手段,证明小胶质细胞对于麻醉觉醒过程的调控依赖于它特有的P2Y12受体及下游胞内钙离子水平,而不依赖于C1q介导的突触吞噬作用。该研究证明小胶质细胞是麻醉过程的重要参与者,小胶质细胞的稳态是维持麻醉状态的必要条件,从免疫系统调控神经系统的独特角度揭示了全身麻醉的神经胶质机制(图2)。
除此之外,该论文在Discussion部分详细阐述通过光遗传学和化学遗传学对神经元细胞和非神经元细胞(如胶质细胞)的操控,指出了领域内存在的对非神经元细胞进行光遗传学和化学遗传学操控的概念性误区。光遗传学和化学遗传学对非神经元细胞的操控并非简单对应于其对神经元细胞的“激活”或“抑制”。相反,光遗传学和化学遗传学在非神经元细胞中的应用是通过调控这类细胞的胞内信号(如离子或G蛋白等)来改变非神经元细胞的状态和功能。这对帮助领域厘清光遗传学和化学遗传学对胶质细胞的操控意义有重要价值。
复旦大学彭勃和舒友生教授是本论文的通讯作者,何旸(博士生)、刘陶慧(博士后)和何全胜(博士后)为共同第一作者,团队成员柯蔚、李小钰、杜金金、邓穗馨、舒镇峰、吴佳霖、杨宝智、王雨晴共同参与了这项研究。本研究得到了华山医院毛颖教授和复旦大学饶艳霞教授的帮助,以及上海市第四人民医院熊利泽教授、仁济医院俞卫锋教授、陆军军医大学胡志安教授、中国科学院脑科学与智能技术卓越创新中心张哲教授、南昌大学彭吉云教授等学者的指导和支持。该研究在脑科学与类脑研究(中国脑计划)重大研究计划、国家自然科学基金、教育部科技领军人才团队、上海市基础研究学术特区、上海市曙光计划、上海市优秀学术带头人等项目的资助下完成。论文全文链接https://doi.org/10.7554/eLife.92252。
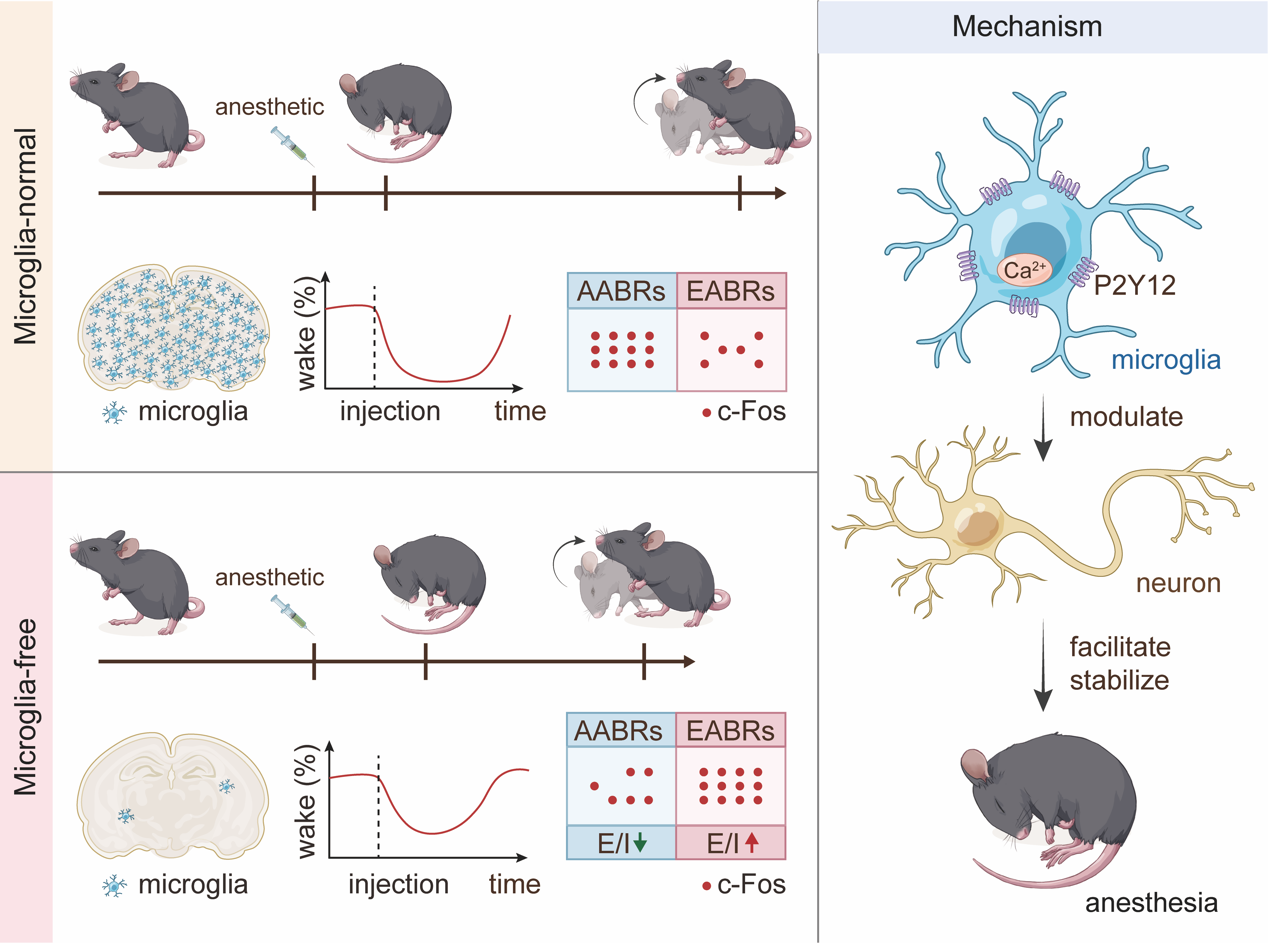
图2小胶质细胞调控麻醉觉醒过程的模式图。
参考文献
1.Kennedy, D. 125. Science 309, 19 (2005).
2.Walsh, C.T. Propofol: Milk of Amnesia. Cell 175, 10-13 (2018).
3.Rogers, J. Ketamine-NMDA receptor binding structure. Nat Rev Neurosci 22, 591 (2021).
4.Fink, E.A. et al. Structure-based discovery of nonopioid analgesics acting through the α(2A)-adrenergic receptor. Science 377, eabn7065 (2022).
5.Pluvinage, J.V. et al. CD22 blockade restores homeostatic microglial phagocytosis in ageing brains. Nature 568, 187-192 (2019).
6.Merlini, M. et al. Fibrinogen Induces Microglia-Mediated Spine Elimination and Cognitive Impairment in an Alzheimer's Disease Model. Neuron 101, 1099-1108.e6 (2019).
7.Filipello, F. et al. The Microglial Innate Immune Receptor TREM2 Is Required for Synapse Elimination and Normal Brain Connectivity. Immunity 48, 979-991.e8 (2018).
8.Matsuda, T. et al. TLR9 signalling in microglia attenuates seizure-induced aberrant neurogenesis in the adult hippocampus. Nat Commun 6, 6514 (2015).
9.Bi, Q. et al. Microglia-derived PDGFB promotes neuronal potassium currents to suppress basal sympathetic tonicity and limit hypertension. Immunity 55, 1466-1482.e9 (2022).
10.Liu, Y.U. et al. Neuronal network activity controls microglial process surveillance in awake mice via norepinephrine signaling. Nat Neurosci 22, 1771-1781 (2019).
11.Umpierre, A.D. et al. Microglial calcium signaling is attuned to neuronal activity in awake mice. Elife 9(2020).
12.He, Y. et al. Microglia facilitate and stabilize the response to general anesthesia via modulating the neuronal network in a brain region-specific manner. eLife 12, RP92252 (2023).
13.Huang, Y. et al. Repopulated microglia are solely derived from the proliferation of residual microglia after acute depletion. Nat Neurosci 21, 530-540 (2018).
14.Zhang, Q., He, Q., Wang, J., Fu, C. & Hu, H. Use of TAI-FISH to visualize neural ensembles activated by multiple stimuli. Nat Protoc 13, 118-133 (2018).