CSF1R inhibitors induce a sex-specifific resilient microglial phenotype and functional
rescue in a tauopathy mouse model
我院青年研究员 袁鹏与美国 加州大学旧金山分校Carlo Condello团队合作 , 于2023年1月9日在Nature Communications发表了一篇 题为 “CSF1R inhibitors induce a sex-specifific resilient microglial phenotype and functional rescue in a tauopathy mouse model ”的研究工作 (1) 。他们发现CSF1R抑制剂 在雌雄小鼠中均起到消融小胶质细胞的作用,并造成致病性tau蛋白的减少,但 只 使 雌性小鼠的生理功能被恢复和生存时间延长。此外,仅在雄性小鼠的大脑中 发现CSF1R抑制剂剂量依赖性 的 即刻早期基因上调和神经递质异常,提供了一种性别特异性 的 兴奋性毒性机制 。这项工作揭示了 靶向小胶质细胞 的 治疗 应该 考虑性别依赖性的影响。
Tau蛋白病(tauopathy)是一类神经退行性疾病,包括阿尔茨海默病、肌萎缩侧索硬化症、额颞叶痴呆等,特征为神经元或胶质细胞内病理性tau蛋白过度磷酸化、异常聚集、沉积。 目前尚未发现降低脑中Tau蛋白沉积的有效手段。 落刺激因子-1受体(CSF1R)的小分子药物用于 癌症治疗 , 近年来发现它对神经系统中的 小胶质细胞、外周组织巨噬细胞和血液髓系细胞的生存和增殖至关重要。 作者 通过对Tg2541小鼠(表达人tau蛋白的0N4R亚型的转基因鼠)服用两种可穿透血脑屏障CSF1R抑制剂:PLX3397 和PLX5622,去评估CSF1R抑制剂在三种不同阶段的疗效:急性 ( 2-4个月大 ) ,慢性(2-7个月大)和晚期(2个月至死亡)(图1 a )。团队观察到在使用PLX3397或PLX5622进行急性、慢性或晚期处理后,与对照组小鼠相比,Tg2541小鼠前脑中的Tau蛋白沉积 显著降低。致病性Tau蛋白的其他标志物(pS396、pS202/T205)也显示,急性、慢性或晚期PLX3397治疗显著降低了Tg2541小鼠前脑和后脑区域的pS396 Tau 蛋白( 图1h-j ) ,也降低了前脑区域的pS202/T205 Tau蛋白( 图1k-m ) 。主成分分析结果显示,两种CSF1R抑制剂都降低了致病性T a u 蛋白 。

图1抑制CSF1R在三种治疗模式下可降低Tg2541小鼠大脑中的致病性tau蛋白水平
Tg2541小鼠在5-6个月大时就会出现消瘦,进食困难,体重下降等,与野生型小鼠相比寿命会大大缩短。晚期进行PLX治疗显著延长了雌性Tg2541小鼠的生存时间(图2b),体重损失显著减少(图2c),且前脑Tau蛋白水平与该组的生存时长成负相关(图2d)。先前的研究已经在Tau蛋白病动物模型的早期阶段发现了一种常见的过度活跃表型,这种表型与Tau聚集的量有因果关系。PLX治疗导致Tg2541小鼠多动降低,使其与野生型小鼠的相似。意外的是,对于寿命和活动的治疗效果在雄性小鼠中没有观察到。
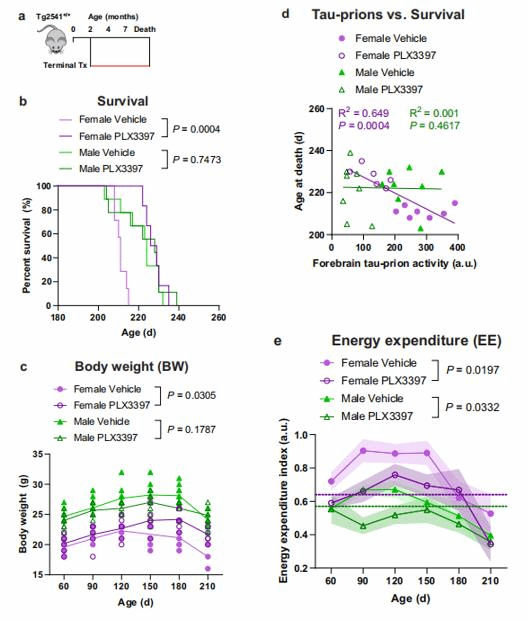
图2抑制CSF1R可延长雌性Tg2541小鼠的存活时间,并降低Tg2541小鼠的过度活动
为了更好地解释CSF1R抑制导致的中枢神经系统的整体分子水平的变化,作者分析了在慢性治疗Tg2541小鼠后,脑组织中与神经炎症和神经病理相关的基因转录本。Pearson相关矩阵显示,在测量的基因表达模式不受治疗本身影响的情况下,PLX处理的Tg2541小鼠的基因表达模式与溶剂组相比发生了明显的变化,且基因表达模式与野生型小鼠的相关性高于溶剂组的(图3a和图3b)。通过在相对低维空间中表示转基因特异的基因表达模式,再计算该空间中的总体向量距离和角度来量化与治疗相关的变化,发现PLX处理使Tg2541小鼠的基因表达模式朝着野生型小鼠的基因表达模式显著正常化(图3d, e)。这些结果表明,PLX治疗特异性地抑制了与转基因过表达相关的异常转录组。
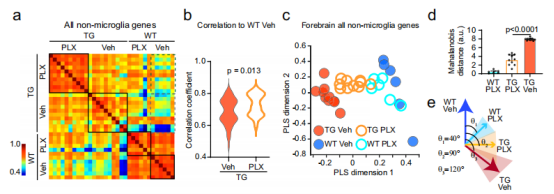
图3 PLX治疗使基因表达谱正常化
由于观测到雄性小鼠在血浆和中枢神经系统中始终具有较高的药物浓度,作者假设这种过量的PLX剂量可能是导致只有雌性小鼠延长生存时间、功能的恢复和降低NfL水平这种性别特异性效应的基础。接着,在转录组分析中,作者确定了表达与大脑PLX5622浓度或性别相关的单个基因,惊奇的发现,许多即刻早期基因(IEG)可能是一个受中枢神经系统药物(PLX5622)作用而改变的模块。为了进一步验证这种可能性,检查了所有IEG后,发现它们的表达模式与大脑PLX浓度密切吻合(图4b)。此外,相对于野生型溶剂组小鼠,只有PLX5622处理的雄性Tg2541小鼠的IEG表达显著上调(图4d),Fos mRNA的原位标记也证实(图4e, f)。这些数据证实了CSF1R的抑制影响这种性别特异性效应,是通过过度给药PLX可能导致兴奋性毒性,由于IEG表达的增加可能暗示神经元活动过度,从而掩盖了其在雄性小鼠中的治疗效果。
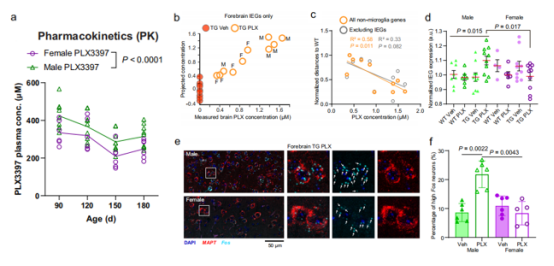
图4剂量依赖的兴奋性毒性随着较高剂量的药物作用发生
为了直接探究这一机制,作者进行了液相色谱串联质谱(HILIC-MS/MS)来测量小鼠前脑裂解液中相关神经递质的水平。雄性PLX3397处理的Tg2541小鼠中大脑兴奋性神经递质谷氨酸盐水平增加(图5a)。意外地发现PLX处理的雄性Tg2541小鼠的抑制性神经递质γ-氨基丁酸(GABA)水平也有所增加(图5b)。这些数据提供了PLX在雄性Tg2541小鼠大脑中诱导谷氨酸驱动的兴奋性毒性的证据,这可能在一定程度上解释了CSF1R抑制对小鼠生存的性别特异性。
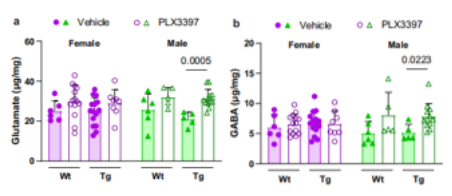
图5PLX异常调节雄性Tg2541小鼠大脑中的神经递质水平。
这些数据强调了小胶质细胞在CSF1R处理中的性别异质性,这对理解小胶质细胞生物学具有意义。同时该工作表明用药物调节小胶质细胞,是一种潜在的治疗Tau病理的方法,但应该考虑到性别特异性的效果。
袁鹏研究组在该研究中的工作受到上海市面上项目(22ZR1415000)及上海市市级科技重大专项的支持。
参考文献:
1. Johnson, N.R.#,Yuan, P.#, Castillo, E. et al. CSF1R inhibitors induce a sex-specific resilient microglial phenotype and functional rescue in a tauopathy mouse model. Nat Commun 14, 118 (2023)