近年来CRISPR基因编辑技术飞速发展,在此基础上诞生的新型单碱基编辑工具ABE(Adenine Base Editor)更可精准诱导A·T--G·C点突变,为G·C--A·T致病点突变相关疾病的治疗提供了有力武器。但初始的ABE工具活性窗口非常有限且在RNA水平有严重的脱靶风险,这极大的限制了其应用。近年来,研究者尝试多种策略分别改善ABE工具的活性窗口和RNA水平的脱靶风险,但很难实现活性窗口和RNA脱靶风险进行协同优化,这导致安全性高的ABE工具常受限于活性窗口而难以广泛应用。程田林团队与中科院中科院脑科学与智能技术卓越创新中心仇子龙实验室及复旦大学附属中山医院王小林实验室合作设计出新的融合策略,在Cas9蛋白内部筛选获得多个新的融合位点用于ABE工具的构建和优化。研究显示,内部融合策略不仅能增加ABE工具活性窗口的多样性,还能有效降低其在RNA水平的脱靶风险。而将内部融合与腺嘌呤脱氨基酶点突变相结合,研究者甚至可以完全消除ABE突变体在RNA水平的脱靶风险并同时保持其活性窗口的多样性,最终实现了ABE工具活性窗口和RNA脱靶风险的协同优化。
传统上,ABE工具的构建是将腺嘌呤脱氨酶融合于Cas9蛋白的N末端。研究者则改变策略,尝试在Cas9蛋白的内部筛选合适的融合位点以优化ABE工具。结果发现24处内部融合位点中,有11处位点可获得功能性的ABE突变体(ABE-nSpCas9-DSs)(图1)。研究进一步指出,根据活性窗口的差异,新的ABE突变体可分为两大类,一类与传统的ABE工具相似,其活性窗口主要位于A4-A7(PAM位点为21-23);另一大类的活性窗口则明显后移,在A9-A16处有更高的活性,这突破了已有研究中ABE活性窗口的局限性,极大的丰富了ABE工具活性窗口的多样性。这一研究为单碱基编辑工具ABE在活性窗口和RNA脱靶风险两方面的协同优化提供了全新的思路,这对提升ABE工具的安全性,拓宽其适用范围,推动其在基因治疗中的应用均有重要意义(Nature Communications,2020,doi:10.1038/s41467-020-19730-9)。
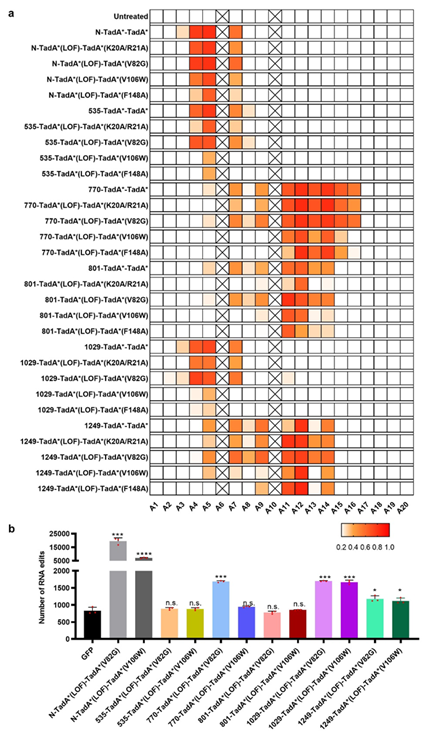
图1