2022年11月30日,我院青年研究员袁鹏与美国耶鲁大学Grutzendler团队合作,于Nature在线发表文章“PLD3 affects axonal spheroids and network defects in Alzheimer’s disease”(1),发现阿尔茨海默症中β-淀粉样蛋白沉积周围存在大量的轴突球状体的膨大病变结构,它们阻碍神经信号传导,影响神经网络功能,而溶酶体蛋白PLD3可以作为调控此病变的分子靶点。
阿尔茨海默病(AD)患者记忆力和认知功能持续恶化,存在广泛的神经回路阻断和网络连接异常。β-淀粉样蛋白(Aβ)沉积形成细胞外斑块被认为会引发一系列病理过程,最终导致认知障碍。然而Aβ沉积与神经网络障碍之间确切的细胞机制依然不清楚。在病人或转基因小鼠的脑组织中,均可观察到Aß沉积周围存在明显增大的神经元突起(图一),而这一AD的标志性病理还没有得到足够研究。针对这一病理,本研究通过高质量的结构成像、活体钙成像、电压成像、计算建模及基因编辑等方法对其进行了结构和功能解析。
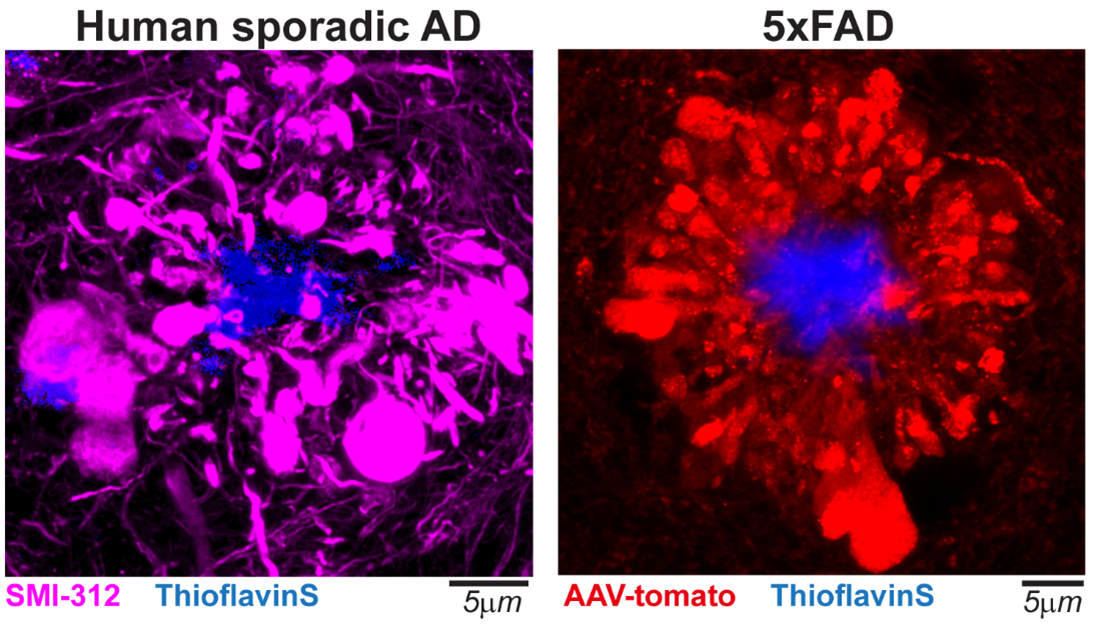
图 1 阿尔茨海默病人及小鼠模型脑中的轴突球状体
左图:免疫荧光标记的阿尔茨海默病人脑中的神经纤维蛋白SMI-312;
右图:在5xFAD小鼠中通过腺病毒介导的在淀粉样沉积周围的神经束标记。
这一病变结构传统上称为营养不良性神经突(dystrophic neurites),被认为是轴突损伤后的退行性结构。然而,利用长时程活体双光子成像追踪,作者发现该结构在数月中保持稳定,而且它所在的母轴并不萎缩消失,但是其大小呈现动态变化,大部分突起在观察的数月时间中体积增大,不过也存在缩小或消失,提示该病变可能与轴突长期共存,从而可能对于轴突的功能造成持久的影响。为了区分这类病变与萎缩中的退行性结构的区别,在文中作者将它们称为斑块相关轴突球状体(Plaque associated axonal spheroids, PAAS)。对5xFAD小鼠(AD模型小鼠)和AD患者脑片染色可以看到淀粉样斑块周围有大量的PAAS,平均一个斑块就影响数百个轴突。考虑到AD脑中有数量众多的淀粉样斑块,每个受影响轴突又牵涉它上下游的环路,PAAS对轴突功能的影响可牵涉大片神经网络。
为探究PAAS对于轴突传导功能的影响,作者利用活体钙成像技术,观察轴突中的钙信号以评估传导功能。作者发现,当轴突临近Aß沉积时,其传导功能并未受到影响,而若轴突形成了球状体病变,其两侧中的钙信号存在明显延迟,并且相关性显著降低,说明球状体病变阻碍了正常的轴突信号传导。作者又进一步采用了AAV-ASAP3病毒进行了活体电压成像,发现在同等刺激强度下,5xFAD小鼠相比对照组小鼠存在更高的概率传导失败。通过对轴突上动作电位的传导过程的生物物理学建模,作者认为轴突球状体较大的表面积起到了电容的效应,对于动作电位来说就像电流阱(current sink),从而导致了传导阻滞或延迟(图二)。与模型的预测相一致,作者观察到轴突球状体的大小是轴突传导障碍效应的决定性因素,该病变的大小越大,对于传导的影响也越严重。

图 2 轴突球状体阻断动作电位的传导
左上图:单轴突中活体钙成像的相关性热图。形成轴突球状体后,轴突两端GCaMP荧光信号相关性显著降低。
右上图:活体电压成像可见5xFAD鼠中更易出现信号传导的阻断。下图:依据生物物理学模拟轴突球状体对于传导的影响。通过输出端收到的信号数目和延迟来评判轴突传导的功能。
通过对病人大脑的定量分析,作者发现与轻度认知障碍患者相比,中度至重度AD患者中的轴突球状体的数量更多,尺寸也更大。这些发现提示了轴突球状体的数量和大小可能是决定AD患者神经回路受损程度和认知缺陷的重要因素。
作者进一步解析了控制轴突球状体增大的细胞水平机制。高分辨率共聚焦成像和膨胀显微成像发现,老龄5xFAD小鼠和AD病人脑中,轴突球状体内大型LAMP1阳性囊泡(Enlarged Lamp1 positive vesicle, ELPV)增加,球状体大小与异常ELPV数量高度相关,ELPV积聚可能是球状体膨大的重要特征。ELPV可能包括多囊体(MVB),内溶酶体和自溶酶体。染色结果还发现,PLD3蛋白存在于ELPV中,并且在轴突球状体中高度富集。PLD3是AD风险基因(2),编码一种溶酶体驻留蛋白,在MVB的生成中发挥作用,可能进而影响MVB相互作用的各种细胞器。作者推测可能是PLD3积聚引起ELPV积聚,驱动球状体膨胀,造成传导障碍。于是,作者在5xFAD小鼠皮层注射AAV-PLD3,使神经元过表达PLD3,这引起了ELPV数量和大小增加,以及轴突球状体的体积增大,说明PLD3的积累与球状体增大的机制相关。
作者接着又探究降低PLD3水平是否会改善轴突球状体病理。根据CRISPR-Cas9基因编辑技术设计针对PLD3的打靶sgRNA,作者给3月龄或者7月龄5xFAD小鼠注射AAV-sgRNA,删除神经元中的PLD3。这种在淀粉样蛋白沉积的早期或后期治疗,均显著降低了大型ELPVs的丰富度,缩小了轴突球状体的尺寸,而淀粉样斑块的数量与大小没有显著变化。作者又结合PLD3敲除与钙成像,观察到PLD3敲除后,动作电位的神经传导也有显著改善。因此,PLD3的减少可以遏制斑块附近轴突球体的发展和恢复轴突传导特性(图三)。
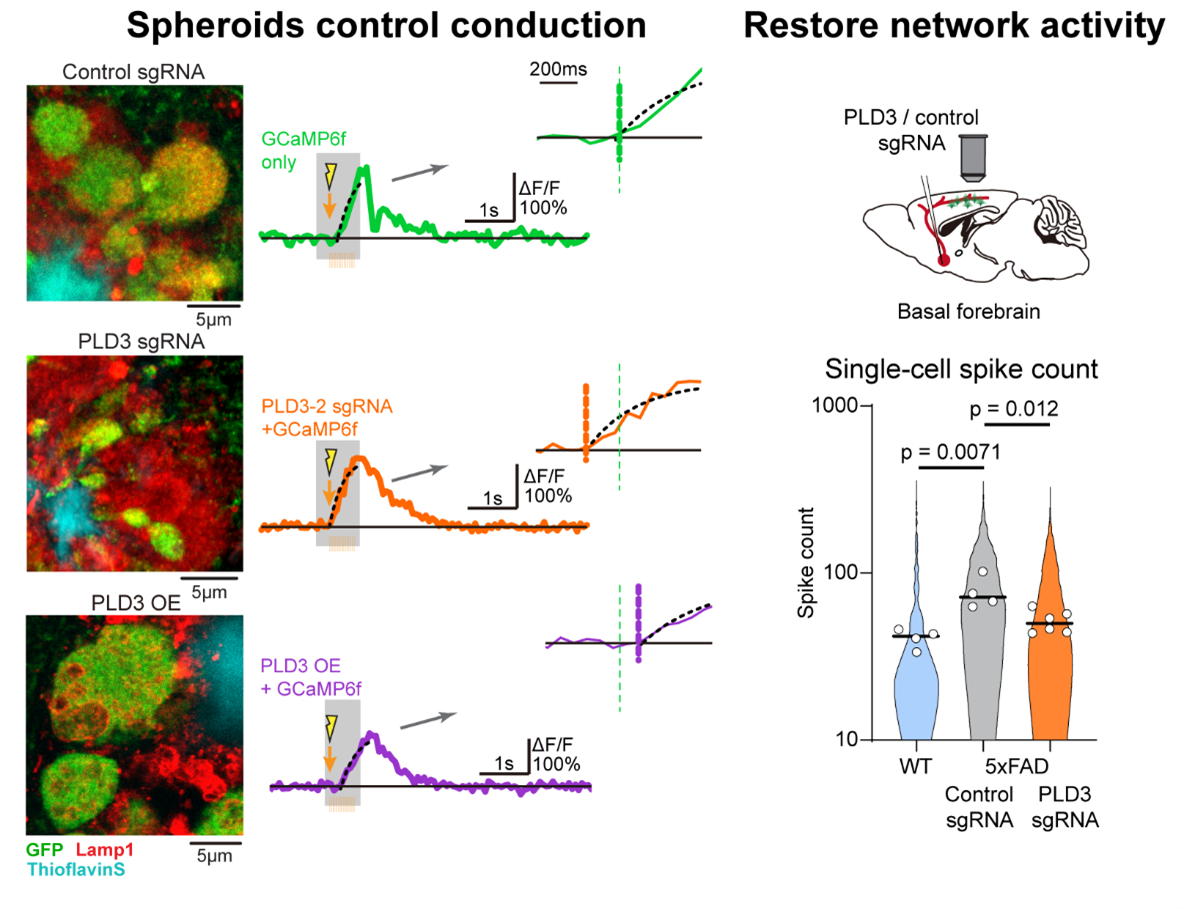
图 3 治疗轴突球状体可恢复AD小鼠中的传导和神经网络活动异常
左图:利用AAV病毒敲低或过表达PLD3可以减轻或加剧轴突球状体的病变,并与轴突上的传导障碍相对应。
右图:通过敲低PLD3基因减轻基底前脑神经元上的轴突球状体,在5xFAD小鼠中可改善下游皮层中神经元的异常发放。
最后,作者探究了减少轴突球状体是否能改善神经回路功能。基底前脑区在AD早期就受影响,它是胆碱能递质的主要来源,泛投射到皮层中间神经元,对突触后的皮层神经元起到复杂的调控作用,对认知功能十分重要。作者将AAV-sgRNA注射到5xFAD小鼠基底前脑区敲除PLD3,在其下游皮层注射AAV-GCaMP6f并进行钙成像。未受治疗的5xFAD小鼠呈现出过度活跃及高度同步化等一系列的异常皮层神经活动模式,与前期研究报道一致(3)。而接受治疗的小鼠逆转了神经回路的异常,神经网络功能与野生型小鼠相近。
这项研究描述了一种阿尔兹海默症中发生认知障碍的新机制。作者发现淀粉斑块周围的存在大量轴突球状体结构,它们就像电流阱一般阻碍神经信号传导,严重影响神经网络功能,球状体越大传导受损越严重。随后作者找到神经元溶酶体蛋白PLD3作为调控此病变的分子靶点,能逆转球体状病变和神经传导异常,指出了AD治疗中一类不依赖淀粉样蛋白清除的潜在新策略。
袁鹏研究组在该研究中的工作受到临港实验室“求索杰出青年计划”开放课题(LG-QS-202203-09)、上海市面上项目(22ZR1415000)及上海市市级科技重大专项的支持。
参考文献:
1. Yuan, P. et al. PLD3 affects axonal spheroids and network defects in Alzheimer’s disease. Nature (2022). https://doi.org/10.1038/s41586-022-05491-6
2. Cruchaga, C. et al. Rare coding variants in the phospholipase D3 gene confer risk for Alzheimer’s disease. Nature 505, 550–554 (2014).
3. Busche, M. A. et al. Clusters of hyperactive neurons near amyloid plaques in a mouse model of Alzheimer’s disease. Science 321, 1686–1689 (2008).