当我们站在柿子树下,轻轻踢一脚,可获得少量可口的柿子;若我们处于强烈兴奋状态中,连续且猛烈地踹这颗柿子树,即可获得大量柿子。但要担心,即使我们已经停止了行动,仍不停掉落的柿子就像柿子树的“报复”一样迎面袭来,稍不留神就可能摔跟头,再不能继续踹柿子树了。取舍有度、万物循环,这是阴阳相生在大自然中的宏观体现,在微观世界中也无所不在。
在我们的大脑皮层中,数目众多的兴奋性神经元与抑制性中间神经元通过突触相互连接或自我连接【1-5】,构建成复杂的神经网络来执行感觉、运动、学习、决策等功能。这些神经元产生动作电位【6-8】并释放兴奋性递质谷氨酸或抑制性递质γ-氨基丁酸(GABA),两类递质分别介导的兴奋和抑制往往相互制衡【9】,共同维持神经网络活动中的阴阳平衡。一旦平衡被打破,皮层网络的电活动及其功能将发生紊乱,极易引发各种神经系统疾病,如焦虑、癫痫和精神分裂症等。平衡的维持和皮层信号处理严重依赖抑制性信号的发生时刻及其强度。因此,对抑制性信号调控机制的研究十分重要。
2020年2月5日,复旦大学脑科学转化研究院舒友生课题组在Neuron杂志上发表论文Regulation of Recurrent Inhibition by Asynchronous Glutamate Release in Neocortex,发现大脑皮层中谷氨酸的突触释放存在着非同步化释放(Asynchronous release,AR)模式。这种模式帮助神经网络在面对高强度兴奋输入时,通过长时间激活抑制性中间神经元来实现“柿子树的报复”。
舒友生课题组已有研究发现,皮层快速放电(Fast-spiking,FS)中间神经元的输出突触可产生非同步化的GABA释放,且该现象在癫痫人脑中效应更强【3】。非同步化释放是什么呢?经典的突触传递过程是突触后反应与突触前动作电位在时间上耦合紧密,突触延迟约1-2 ms,由同步化递质释放所介导;在高频发放时,突触后反应往往与突触前动作电位耦合得不紧密,出现滞后现象,由递质的非同步化释放所致。由于非同步化GABA释放所提供的抑制可调节突触后细胞动作电位发放的强度和准确度,因此它的增强可能有助于癫痫条件下神经网络自稳态的维持。既然AR有如此重要的调节作用,那么在神经网络兴奋较强时,兴奋性神经元的输出突触中是否存在谷氨酸的AR模式呢?且该种滞后的突触囊泡释放能否像延迟掉落的柿子一样,通过调节其突触后中间神经元动作电位的发放模式,从而达到对皮层兴奋性的“圈禁”(Constrain)呢?
为了解皮层抑制性的发生特征,博士研究生邓穗馨等使用双通道膜片钳电生理技术,对急性分离的皮层脑片上两个邻近的锥体神经元(Pyramid cell,PC)进行同时记录。实验发现,当突触前PC发放一串动作电位时,突触后PC上可记录到抑制性突触后电位IPSP(即被圈禁)。这种抑制性突触后电位有两类【1】:一类发生较快且时间精确,往往紧接首个动作电位之后,随后马上结束,称为快相交互抑制,主要由GABA能的FS细胞介导;另一类需要由突触前PC高频发放来诱发产生,且与PC簇状发放(Burst spiking)的动作电位耦合不好,故而相对不精确,但往往能持续较长时间,甚至远超突触前PC电活动的时间窗,称为慢相交互抑制,主要由GABA能Martinotti细胞(MC)介导。快相和慢相交互抑制环路参与了皮层网络中低频和高频输入信息的分流,但它们的调控机制仍不清楚。舒友生团队猜测,慢相交互抑制之所以响应突触前PC的高频发放,且维持时间较长又不精确,可能是其中介的MC更易在突触前PC高频发放时爆发时间较长且不精确的动作电位,且这些动作电位的持续性和不精确性可能由PC靶向MC突触中的谷氨酸AR所引发。
进一步于PC和MC的双通道膜片钳实验发现,在PC靶向MC的突触中的确存在谷氨酸AR模式。在给予PC串刺激时,突触后MC接受的大量谷氨酸AR去极化MC膜电位,从而促进更多且更长时程的动作电位发放,并且降低这些动作电位的发放精确性。这些结果提示,在皮层PC的输出突触中,谷氨酸AR选择性地存在于靶向MC的突触,导致MC持续并滞后发放动作电位,在其他邻近的PC上引起持续的且不精确的抑制性反应。后续对PC和其它神经元的双通道膜片钳实验发现,谷氨酸AR的强度的确依赖靶向神经元的细胞种类,即具有靶向细胞特异性。在PC靶向MC的突触中,谷氨酸AR最为强烈;而在PC靶向FS神经元或其他邻近PC的突触中,谷氨酸AR相对较弱。
鉴于PC也存在不同种类,该工作继续探讨了投射至不同脑区的PC输出突触中谷氨酸AR的强度差异。结果发现,相较于往脑桥投射或往对侧皮层投射的PC,往对侧纹状体投射的PC具有更强的谷氨酸AR,提示AR更强地调控由这类PC所参与的交互抑制环路的功能。皮层网络中MC也存在不同形态特征的亚类,包括轴突分支呈扇形和T形的两类MC。结果显示这两类MC接受强度相似的谷氨酸AR,但是在PC靶向T型MC的突触中,AR的强度与MC的输入阻抗呈负相关。进一步实验发现谷氨酸AR具有钙依赖性,慢钙螯合剂EGTA可以阻断AR。另外,慢钙感受器突触结合蛋白7(Syt7)被认为介导AR的发生,Syt7缺失的确降低了AR强度,导致MC介导的慢相交互抑制起始时间的推迟和强度的减弱。
综上,该研究分析了皮层锥体神经元的输出突触中谷氨酸的AR现象,并首次揭示了这种释放模式在环路功能中的重要作用,即调控皮层网络中慢相交互抑制的发生时刻及强度。这些发现对深入了解皮层网络中兴奋—抑制平衡的维持机制和皮层信息加工机制具有重要意义。
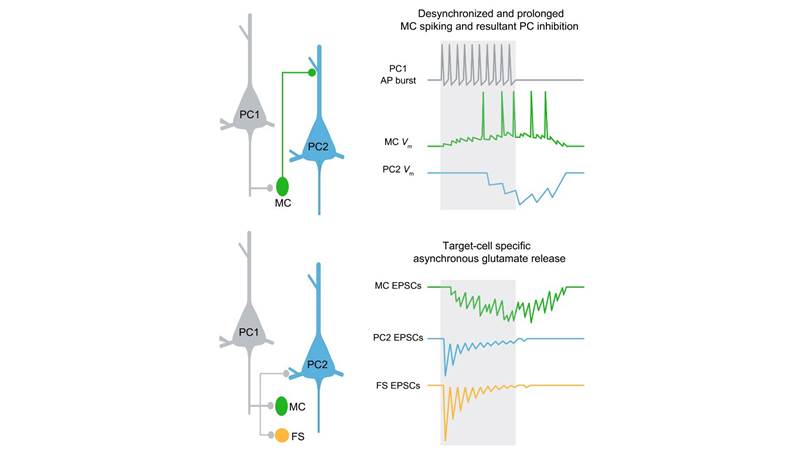
图注 上图:皮层谷氨酸AR在MC介导的慢相交互抑制中的调控作用:MC的动作电位(绿色)发放持久且不精确(即与PC动作电位的发生时刻在时间上耦合不紧密),导致邻近PC中慢相跨突触抑制(蓝色)维持时间长且不精确。下图:谷氨酸AR强度存在靶向细胞特异性:与其他细胞相比,PC靶向MC的突触上AR最强。PC:锥体神经元;MC:Martinotti细胞;FS:快速放电神经元;Vm:细胞膜电位;EPSC:兴奋性突触后电流。
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(19)30933-X
参考文献:
1. Zhu, J., Jiang, M., Yang, M., Hou, H., and Shu, Y. (2011). Membrane potential-dependent modulation of recurrent inhibition in rat neocortex. PloS Biol. 9, e1001032.
2. Yin, L., Zheng, R., Ke, W., He, Q., Zhang Y., Li J., Wang B., Mi Z., Long Y., Rasch, M., Li T., Luan G., and Shu Y. (2018). Autapses enhance bursting and coincidence detection in neocortical pyramidal cells. Nat. Commun. 9(1):4890.
3. Jiang, M., Zhu, J., Liu, Y., Yang, M., Tian, C., Jiang, S., Wang, Y., Guo, H., Wang, K., and Shu, Y. (2012). Enhancement of asynchronous release from fast-spiking interneuron in human and rat epileptic neocortex. PLoS Biol. 10, e1001324.
4. Jiang, M., Yang, M., Yin, L., Zhang, X., and Shu, Y. (2015). Developmental reduction of asynchronous GABA release from neocortical fast-spiking neurons. Cereb. Cortex 25, 258-270.
5. Shu, Y., Hasenstaub, A., Duque, A., Yu, Y., and McCormick, DA. Modulation of intracortical synaptic potentials by presynaptic somatic membrane potential. (2006). Nature 441(7094):761-765.
6. Wang, B., Yin, L., Zou, X., Ye, M., Liu, Y., He, T., Deng, S., Jiang, Y., Zheng, R., Wang, Y., Yang, M., Lv, H., Wu, S., and Shu, Y. (2015). A subtype of inhibitory interneuron with intrinsic persistent activity in human and monkey neocortex. Cell Rep. 10(1-9).
7. Hu, W., Tian, C., Li, T., Yang, M., Hou, H., and Shu, Y. (2009). Distinct contributions of Nav1.6 and Nav1.2 in action potential initiation and backpropagation. Nat. Neurosci. 12(8):996-1002.
8. Li, T., Tian, C., Scalmani, P., Frassoni, C., Mantegazza, M., Wang, Y., Yang, M., Wu, S,. and Shu, Y. (2014). Action potential initiation in neocortical inhibitory interneurons. PLoS Biol. 12(9):e1001944.
9. Shu, Y., Hasenstaub, A., and McCormick, DA. Turning on and off recurrent balanced cortical activity. (2003). Nature 423(6937):288-293.