2022年11月29日,我院李伟广研究员与上海交通大学医学院附属新华医院李斐主任团队、复旦大学类脑智能科学与技术研究院张孝勇团队、华东师范大学梅兵团队合作,在Cell Press细胞出版社期刊Cell Reports上在线发表题为“Social deficits via dysregulated Rac1-dependent excitability control of prefrontal cortical neurons and increased GABA/glutamate ratios”的研究论文。该研究综合运用自闭症小鼠模型、行为学、小动物核磁共振波谱成像、光遗传学、化学遗传学、电生理、分子遗传学、细胞生物学等多种技术手段,面向自闭症社交障碍在病因学、行为表现方面的异质性和复杂性这一临床难题,通过解析大脑内侧前额叶皮层(mPFC)不同类型细胞上突触骨架调节蛋白(Rac1)活性双向改变引起的神经元兴奋性和特定神经递质含量变化及其与异常社交行为的精确对应关系,提出了基于突触细胞生物学特征的自闭症社交障碍分型标准,为理解自闭症社交障碍的共性病理机制、发展病因学指导下的疾病诊断和治疗新策略提供了重要的理论依据。

自闭症是一种早期起病的、严重的常见神经发育障碍性疾病,发病率呈上升趋势,以社交障碍为核心症状。现有科学证据表明,诸多环境和遗传因素使部分儿童更有可能患上自闭症。自闭症致病原因复杂,临床症状异质性强,其干预和治疗仍是国际难题,目前临床上尚缺乏有效的治疗药物。因此,寻找自闭症社交障碍的共性神经机制,建立生物学机制指导下的临床症状分型标准,可能是发展自闭症精准诊疗新策略的重要突破口。
突触作为大脑通讯的基本单元,存在兴奋性和抑制性等不同类型。突触的兴奋性/抑制性失衡被认为是自闭症等精神神经疾病的根本发病机制。然而,自闭症多样化的社交障碍与特定类型突触失衡之间的对应规律还不清楚。在本研究中,研究团队聚焦小G蛋白Rac1这一突触骨架调节因子,致力于阐明Rac1活性失调引起社交障碍的突触细胞生物学机制。Rac1是一类核苷酸依赖型的分子开关,在与GTP结合的活化状态和与GDP结合的非活化状态之间进行相互转换,参与肌动蛋白动力学调控和突触重塑。临床证据表明,人群中RAC1功能获得型或缺失型基因突变均与自闭症密切相关。动物模型研究表明,脆性X综合征(Fmr1基因敲除小鼠,Fmr1KO)、Shank3基因C末端缺失(Shank3+/ΔC)等自闭症小鼠模型分别表现出Rac1活性上调或下调。然而,Rac1活性失调(上调或下调还是两者均可)是否以及如何导致社交障碍,而且是否依赖于细胞特异性的调控作用都还不清楚。
为明确Rac1活性改变与社交障碍之间的因果关系,研究团队利用病毒立体定位注射技术结合动物行为学实验发现,在社交行为关键脑区——mPFC双向操纵Rac1活性均导致小鼠社交能力下降。进一步利用小动物核磁共振波谱(MRS)技术测量神经递质发现,Rac1活性上调导致谷氨酸递质含量降低,不影响GABA递质;Rac1活性下调不影响谷氨酸递质,增加GABA含量。二者最终均导致mPFC抑制性/兴奋性比值失衡性增高。
mPFC脑区由不同神经元类型组成,包括兴奋性谷氨酸能神经元和抑制性GABA能中间神经元等。为研究不同细胞类型中Rac1活性改变如何参与社交障碍,研究团队进行了细胞类型特异的Rac1活性操纵,发现mPFC兴奋性神经元Rac1活性上调,导致谷氨酸能神经元兴奋性和谷氨酸递质含量降低;在小清蛋白(PV)阳性的抑制性中间神经元下调Rac1活性,导致PV神经元兴奋性和GABA递质含量增加,二者均导致小鼠社交新颖性测试(反映社交记忆)功能受损。对应地,利用化学遗传学或光遗传学激活谷氨酸能神经元可解救细胞类型特异的Rac1活性上调导致的社交障碍;化学遗传学失活PV神经元可解救细胞类型特异的Rac1活性下调导致的社交障碍。相比而言,在这两类神经元上进行相反方向的Rac1活性操纵,不影响社交行为。
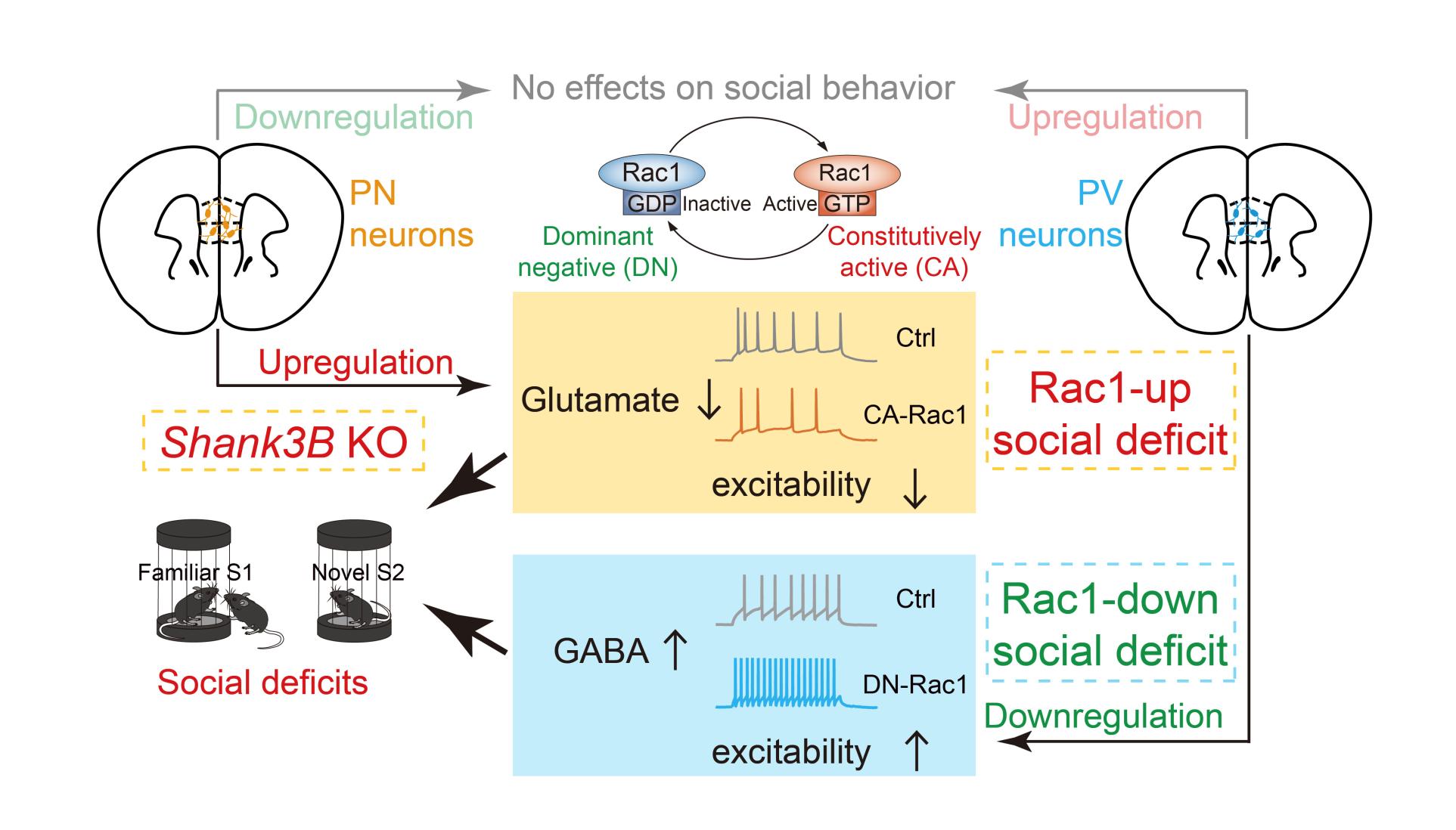
插图. mPFC不同类型神经元Rac1活性的双向改变导致社交障碍的示意图。
根据上述发现,研究团队提出基于突触细胞生物学特征的社交障碍分型标准,即分为“Rac1上调型”(Rac1-up,主要累及谷氨酸能神经元,表现为谷氨酸递质含量降低)和“Rac1下调型”(Rac1-down,主要累及抑制性中间神经元,表现为GABA递质含量升高),二者均导致mPFC抑制性/兴奋性比值失衡性增高(见插图)。有趣的是,“Rac1下调型”社交障碍往往伴随新颖性识别的一般缺陷,而“Rac1上调型”社交障碍则主要表现为社交新颖性识别的选择性缺陷。
最后,研究团队选择一种区别于Shank3+/ΔC(缺失Shank3基因C末端)的自闭症模型小鼠Shank3BKO(缺失Shank3基因PDZ结构域)进行测试,发现Shank3BKO小鼠在行为上表现出社交记忆功能受损,同时其mPFC区Rac1活性升高,谷氨酸能神经元兴奋性和谷氨酸递质含量均降低。该表现类似于“Rac1上调型”社交障碍,跟表现为“Rac1下调型”的Shank3+/ΔC自闭症模型小鼠截然相反。为此,研究团队在Shank3BKO小鼠mPFC谷氨酸能神经元选择性地进行Rac1活性抑制或神经元兴奋性上调干预,发现均能明显改善该自闭症模型小鼠的社交障碍。
总之,该研究从突触细胞生物学的角度,建立了mPFC神经元Rac1活性异常以细胞类型特异的方式调节神经元兴奋性和突触抑制性/兴奋性比值失衡进而导致社交障碍的工作模型,揭示了Rac1活性双向改变引致不同类型社交障碍的融合生物学机制,使得自闭症社交障碍的分型成为可能,为发展生物学机制指导下的社交障碍干预新策略奠定了理论基础。
华东师范大学博士研究生马冰珂为该论文的第一作者。上海交通大学医学院附属新华医院李斐主任、复旦大学类脑智能科学与技术研究院张孝勇研究员、华东师范大学梅兵研究员和我院李伟广研究员为该论文的共同通讯作者。
该研究得到了国家自然科学基金、上海市科学技术委员会、上海市卫生健康委员会、上海市教育委员会等各级项目的支持。该研究还得到了华东师范大学袁小兵教授、殷东敏教授,昆明医科大学第一附属医院俞珏华研究员和中国科学院深圳先进技术研究院脑认知与脑疾病研究所路中华研究员等的合作支持。
论文链接:https://doi.org/10.1016/j.celrep.2022.111722
另外,李伟广课题组目前有青年副研究员(副教授)、博士后等岗位空缺,欢迎对科研充满热情且胸怀学术理想的科研人员加入。申请人请将一份详细的个人完整简历(中英文皆可)通过电子邮件发送至liwg@fudan.edu.cn,邮件标题请注明姓名+应聘职位。
具体可参考课题组网站:https://itbr.fudan.edu.cn/info/1443/2552.htm