得益于免疫检查点抑制疗法(如anti-PD-L1治疗)和过继细胞疗法(如CAR T细胞治疗)在众多实体瘤治疗领域的成功,近年来免疫治疗已被逐渐纳入临床实践的考量范围,而在肿瘤微环境中,为了维持巨大的合成代谢需求,肿瘤细胞往往进行着正常细胞不同的特殊代谢,由此形成酸性、缺氧且缺乏免疫细胞所需的关键营养成分的肿瘤微环境。因此,探索和挖掘免疫细胞在微环境中的特殊代谢或许将助力各类免疫疗法在未来比肩传统治疗在临床实践中的地位。

肿瘤免疫微环境中的免疫与代谢互作
胶质瘤(Glioma)——人群中最常见且致命的原发性颅内肿瘤,这其中有约50%是恶性程度极高,中位生存期极短的胶质母细胞瘤(Glioblastoma, GBM),70岁以下的GBM患者中位生存期仅为12至18个月。目前GBM的治疗方案仍首推手术最大范围安全切除联合放疗并同步替莫唑胺或PCV方案化疗,以免疫检查点抑制疗法为代表的免疫治疗虽使黑色素瘤等其他肿瘤患者获益,但并未显著改善GBM患者生存期。
肿瘤相关巨噬细胞( T u mor-associated macrophages, TAMs )是肿瘤免疫微环境中的重要组成部分,对于G BM 而言,组织驻留的 小胶质细胞 和骨髓来源的 巨噬细胞 在微环境免疫细胞群中占比最高,约为30%-50%, 小胶质细胞作为高度适应性细胞, 尽管其在不同环境下的表型差异使其表型划分在领域内仍存在争议,但 在GBM肿瘤微环境中, 许多学者观察到,部分 肿瘤相关小胶质细胞倾向于 转化为免疫抑制表型 ,通过释放各种细胞因子促进肿瘤细胞增殖、迁移、血管新生 或异常化,进而促使耐药性的产生 , 因此,探索如何靶向免疫抑制表型的小胶质细胞并与临床现有的疗法相结合成为了新的亟待解决的命题。
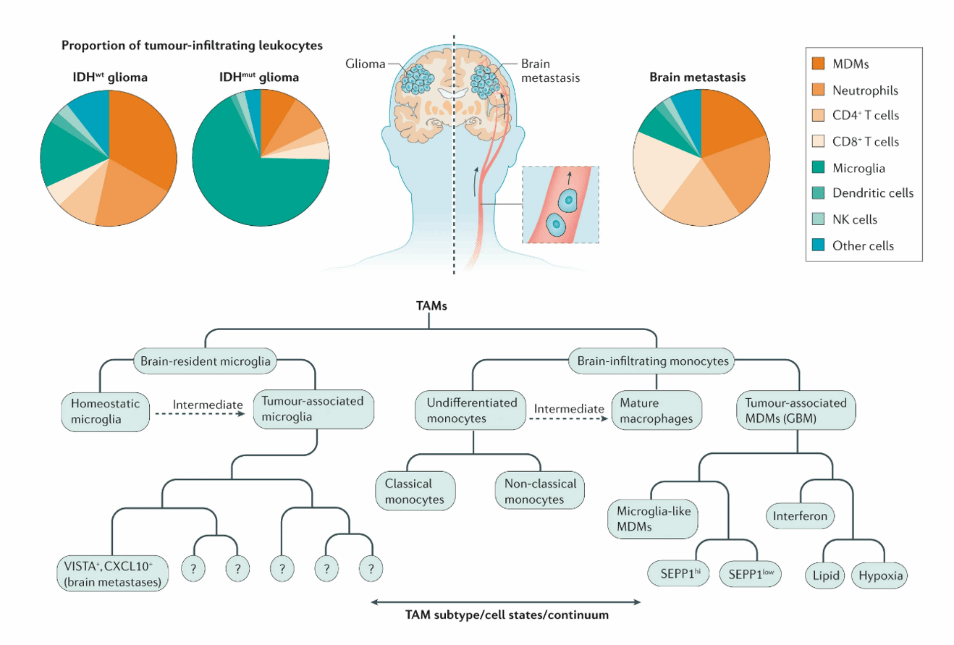
胶质瘤微环境中免疫细胞的组成与划分
2023年1月17日,四川大学华西第二医院周圣涛教授,美国UMPC医学中心Jeremy N. Rich教授和赵林桔博士合作在Cancer Discovery在线发表题为”Targeting Microglial Metabolic Rewiring Synergizes with Immune Checkpoint Blockade Therapy for Glioblastoma ”的研究论文。该研究发现,在GBM肿瘤微环境中,小胶质细胞呈现高度氧化应激状态,在此状态下其脂类代谢稳态被破坏,抗原呈递能力显著下降,从而导致胶质母细胞瘤微环境内的CD8+ T细胞浸润数量和杀伤功能均明显降低,最终诱导形成免疫抑制性肿瘤微环境,促进GBM的浸润和进展。
1.小胶质细胞在GBM微环境中呈现高度氧化应激状态并通过改变肿瘤微环境促进肿瘤生长
为了阐明 GBM微环境对于小胶质细胞的影响, 作者首先 分离 荷瘤 小鼠 的 肿瘤和正常脑组织的CD45 + 细胞进行单细胞转录组测序, 发现小胶质细胞在肿瘤微环境免疫细胞群中的占比最高 (图1 A-C ) ;作者进一步 结合GBM 患者 公共单细胞转录组测序数据进行整合分析,发现氧化应激相关的基因在肿瘤相关的小胶质细胞中显著富集 (图1 D-F ) ,即 小胶质细胞在肿瘤中为高氧化应激状态 。

图1 GBM微环境中存在一群处于高氧化应激状态的小胶质细胞
研究人员进而进一步设计了体内、外实验,通过对原代或人/鼠小胶质细胞进行过氧化物刺激(H 2 O 2 )后与肿瘤细胞共培养,确定处 于氧化应激状态的小胶质细胞 显著促进了肿瘤生长 ,且此种效应可以被抗氧化剂(N AC )所拮抗 (图2 G-J ) ,而在体内实验中,与氧化应激状态共培养后的肿瘤细胞在小鼠体内的成瘤能力显著高于阴性对照组,其微环境内的C D8 + 细胞数量明显降低、功能减退并同时伴有 免疫 检查点分子P D1 表达上调,以上所有效应亦均可被抗氧化剂(N AC )所拮抗 (图3 A-D , H -N ) , 表明处于 氧化应激状态下的小胶质细胞通过重塑肿瘤免疫微环境促进胶质瘤生长 。
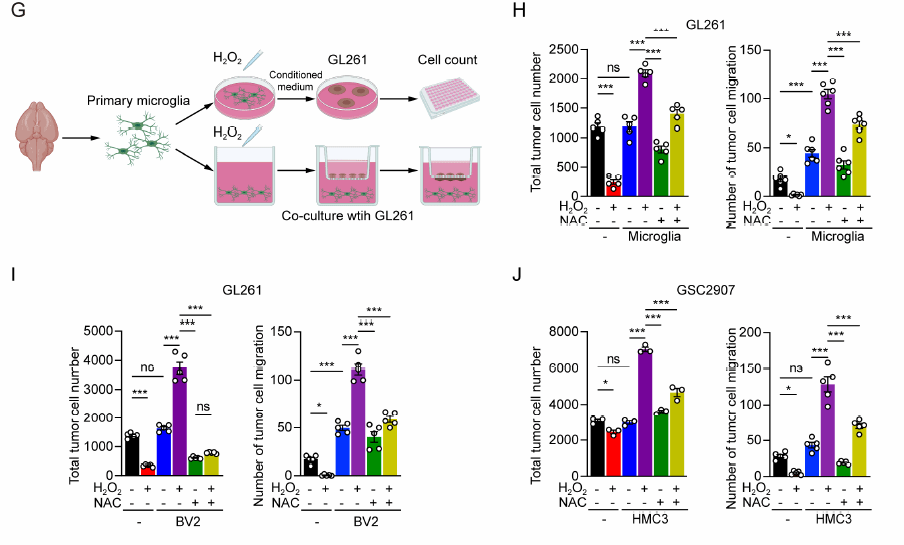
图2 体外共培养实验确认氧化应激状态下的小胶质细胞显著促进了肿瘤细胞增殖
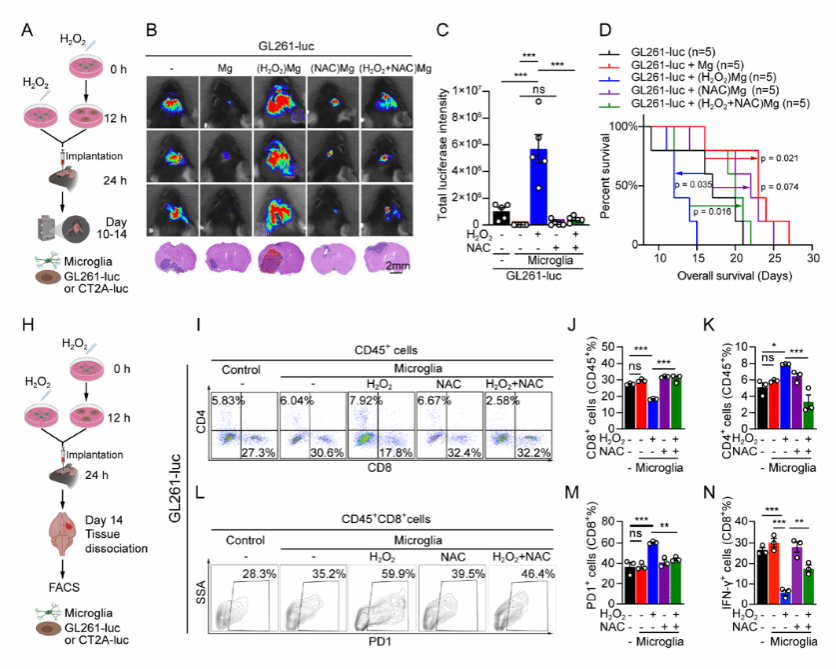
图3 体内实验确认氧化应激状态下的小胶质细胞通过重塑肿瘤免疫微环境促进胶质瘤生长
2.NR4A2介导了氧化应激后小胶质细胞免疫表型的变化
接下来,研究人员通过染色质免疫沉淀富集分析及相关实验发现核受体 4A2 (N uclear receptor 4A2, NR4A2 )在氧化应激状态下的小胶质细胞中表达显著上升 ,患者病例样本、小鼠动物模型样本及公共单细胞数据库转录组分析进一步印证了肿瘤微环境中的一群小胶质细胞显著上调了N R4A2 的表达,且G BM (胶质瘤分级4级)内的小胶质细胞N R4A2 的表达水平明显高于低级别(1-3级)胶质瘤。此外,体外特异性敲除小胶质细胞中的N R4A2 或应用其抑制剂可以逆转氧化应激后其抗原提呈能力的下降和C D 8 + T 细胞的耗竭 (图4 A-N )。

图4 NR4A2在氧化应激状态下的小胶质细胞中表达显著上升
3.NR4A2作为转录因子调节SQLE的表达水平,进而介导小胶质细胞内脂类代谢环境失衡
研究人员进一步通过染色质免疫沉淀富集及ChIP - seq等分析筛选出N R4A2 的下游靶点角鲨烯单加氧酶( squalene monooxygenase, SQLE ), 体内、外实验均分别验证了 N R4A2 与S QLE 在肿瘤微环境中受氧化应激的影响呈现同步变化 ,应用S QLE 的特异性抑制剂可以逆转N R4A2 介导的免疫抑制表型转变,而此种效应可以被S QLE 过表达回补;免疫荧光染色显示肿瘤组织内N R4A2 + SQLE + IBA1 + 细胞群显著多于正常组织 (图5 H-N ) 。 S QLE 作为类固醇合成代谢中的关键限速酶, SQLE的异常表达导致小胶质细胞中脂代谢的异常 ,显然, 小胶质细胞内部脂代谢环境的失衡与其免疫抑制性的产生显著相关。
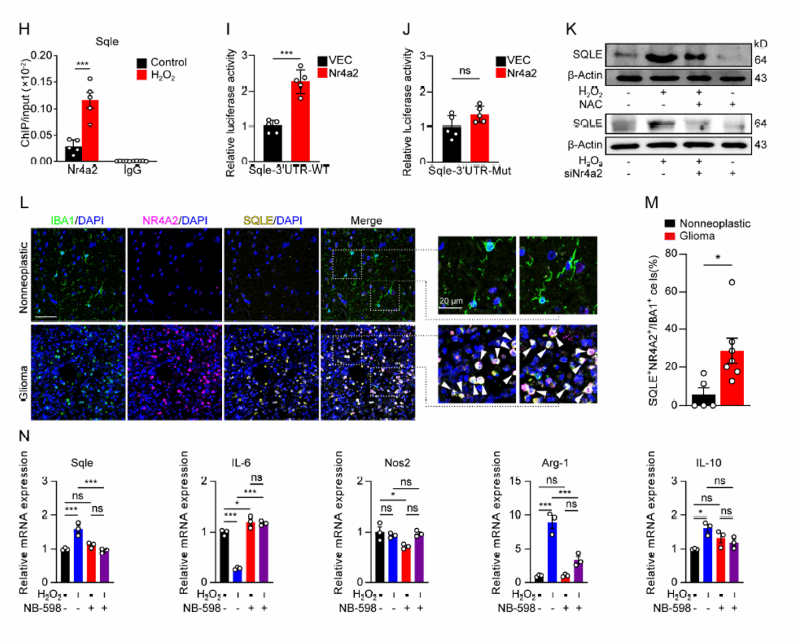
图5 NR4A2与下游靶点SQLE在肿瘤微环境中受氧化应激的影响呈现同步变化
4.特异性敲除小鼠体内小胶质细胞内NR4A2重塑了免疫抑制表型的肿瘤微环境,并体现出明显生存获益
研究人员通过Cre-loxP系统(Nr4a2fl/fl Cx3cr1Cre )特异性敲除了小鼠体内小胶质细胞内的NR4A2,发现Nr4a2fl/fl Cx3cr1Cre 荷瘤小鼠肿瘤微环境内免疫抑制表型小胶质细胞显著减少,具备抗原提呈能力的小胶质细胞及CD8+T细胞均显著增多,PD1等免疫检查点分子的表达水平亦降低,最终表现为肿瘤体积缩减和明显的生存获益(图6A-I)。
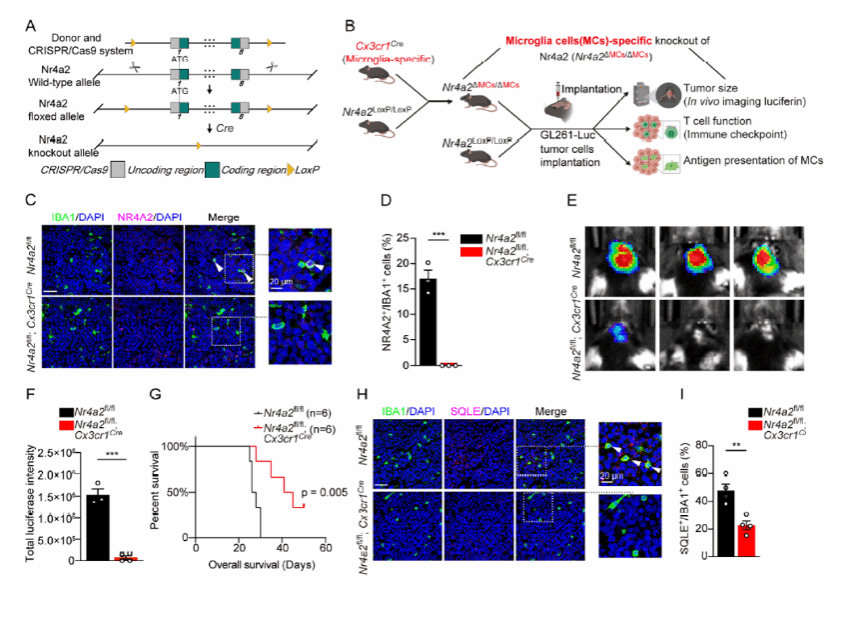
图6 小鼠体内特异性敲除 NR4A2 重塑免疫微环境并改善生存
5.1+1>2:NR4A2/SQLE抑制剂与PD1抗体联用时,展现出比PD1抗体更强的CD8+ T细胞激活作用
尽管免疫检查点抑制剂已经改变了对包括脑转移瘤在内的几种实体瘤的治疗,但它们在 GBM中的临床疗效一直不佳。研究人员进一步对胶质瘤原位荷瘤小鼠给予 了 NR4A2/SQLE抑制剂治疗,发现抑制NR4A2/SQLE通路能够降低CD8 + T细胞耗竭,从而延长荷瘤小鼠的生存时间。更重要的是,当 NR4A2/SQLE抑制剂与PD1抗体联用时,展现出比PD1抗体更强的CD8 + T细胞激活作用 ,并能进一步延长荷瘤小鼠的生存期。尽管仍需后续的临床研究加以证实,这种联合用药方案代表一种全新的双靶点策略,有望更好地促进CD8 + T细胞 在 GBM中的抗肿瘤作用 (图7 A-C ) 。
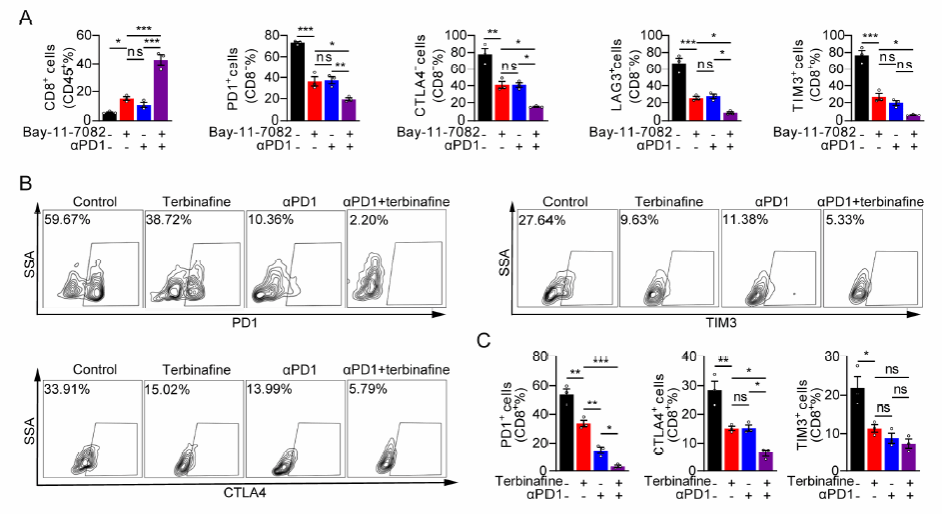
图5 NR4A2/SQLE抑制剂与PD1抗体联用促进CD8+T细胞在GBM中的抗肿瘤作用
结语
综上,该项研究揭示了氧化应激是GBM中小胶质细胞的一个特殊状态,它通过NR4A2/SQLE脂类代谢通路使小胶质细胞趋于免疫抑制表型且使其抗原呈递能力下降,进而使功能完备的CD8+T数量耗竭增加,最终促进GBM的浸润和进展——从免疫到代谢,最后再次回到免疫,GBM微环境内各项组分的互作纠缠永远让人费解,又令人着迷,或许这便是为何世界范围内的科学家们为之神往的原因吧。
参考文献
1. Leone, R. D. & Powell, J. D. Metabolism of immune cells in cancer. Nat Rev Cancer 20, 516–531 (2020).
2. Andersen, B. M. et al. Glial and myeloid heterogeneity in the brain tumour microenvironment. Nat Rev Cancer 21, 786–802 (2021).
3. McKinnon, C., Nandhabalan, M., Murray, S. A. & Plaha, P. Glioblastoma: clinical presentation, diagnosis, and management. BMJ n1560 (2021) doi:10.1136/bmj.n1560.
4. Lim, M., Xia, Y., Bettegowda, C. & Weller, M. Current state of immunotherapy for glioblastoma. Nat Rev Clin Oncol. 15, 422–442 (2018).
5. Khan, F. et al. Macrophages and microglia in glioblastoma: heterogeneity, plasticity, and therapy. J Clin Invest. 133, e163446 (2023).
6. Ye, Z. et al. Targeting Microglial Metabolic Rewiring Synergizes with Immune Checkpoint Blockade Therapy for Glioblastoma. Cancer Discov. CD-22-0455 (2023) doi:10.1158/2159-8290.CD-22-0455.(本文原文)
本文作者:杨辉组林子阳