在神经系统的浩瀚宇宙中,神经信息物质如繁星点缀。无论是否被我们察觉,这些微小而强大的信使都在不断演奏着复杂多样的生命交响曲。它们悄然传递信息,调节功能,维持着神经网络的精妙平衡 [1] 。尤其是对于阿片肽,作为在疼痛、奖励和厌恶调节中扮演关键角色的神秘使者 [2] ,其临床意义吸引着我们想要进一步“看见”它们。然而,由于缺乏精确的观测工具,我们此前难以深入研究其机制。
为了揭开阿片肽在大脑中的时空奥秘,美国加州大学戴维斯分校的Lin Tian团队联合美国加州大学圣地亚哥分校的 Matthew R. Banghart团队,在2024年7月15日于Nature Neuroscience在线发表题为 "Unlocking opioid neuropeptide dynamics with genetically encoded biosensors" 的研究论文 [4] 。该研究基于κ、δ和μ阿片受体[5],开发出了一系列基因编码荧光探针:κLight 、δLight 和 µLight。

这些探针宛如聚光灯,只对准并照亮特异的阿片肽或者阿片受体药物。基于此,研究人员在哺乳动物细胞和分离的神经元中描绘出这些探针的药理特性图谱。接着,借助 κLight 这盏灯,研究人员成功测定出能唤醒内源性阿片肽释放的电刺激参数,并利用脑切片绘制出强啡肽 (Dynorphin, Dyn) 的空间传送轨迹。通过在小鼠体内进行光纤光度测定,研究人员见证了这些探针在探测光遗传驱动的阿片肽释放中的卓越表现。通过设置条件训练小鼠,研究人员利用这些探针观察到在恐惧与奖励条件下内源性阿片肽呈现出不同的释放反应。
这些“看见”从多个层面,深入探索了阿片肽系统的功能和调控机制,帮助理解了阿片系统在情感行为和动机行为中的作用,还可能为理解和治疗疼痛管理、成瘾治疗和情绪调节等相关精神疾病提供新见解。
一、设计-筛选-表达阿片肽生物探针
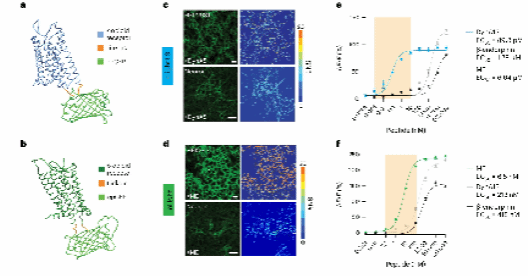
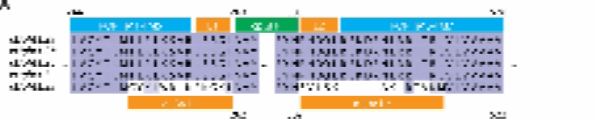
研究人员将人类κ、δ和μ阿片受体的特定氨基酸序列替换为环化绿色荧光蛋白 (cpGFP) 。为优化探针性能,研究人员筛选了数百个变体,并通过添加标签来改善膜定位。最终优化的探针被命名为 κLight 、 δLight 和 μLight 。
研究人员在 HEK293 细胞和离体神经元培养中瞬转表达 κLight1.3 、 δLight和 μLight 探针,观察到它们在细胞膜上有良好的表达。这三种探针分别可被其内源性受体激动剂 Dyn 、 Methionine enkephalin (ME) 和 β-endorphin 激活,而这种被激活的响应又都能被阿片受体拮抗剂纳洛酮 (Naloxone, Nalo) 所阻断。这些结果表明,新开发的探针能够特异地检测内源性阿片类神经肽的活性。
接着,为了消除因瞬转探针表达水平不一致而导致的系统差异,研究人员开发了稳定表达 κLight1.3 、 δLight 和 µLight 的 HEK293T 细胞系。通过细致的原位滴定实验,研究人员测试了这些探针对不同阿片类肽的选择性和敏感性: κLight1.3 对 DynA13 展现出极高的敏感性, δLight 对 ME 反应最为强烈,而 μLight 则需要进一步优化。
研究人员也测试了拮抗剂对三种探针的作用效果: Nalo 对两种探针都有抑制作用,但对 δLight 的抑制更强; Nor-BNI 对 κLight 的亲和力略高; ICI 174864 有效抑制 δLight ;而 CTAP 对两种探针均无显著影响。
二、阿片肽探针的高度选择性和药理研究
目前虽然已经发现了多种内源性及合成的阿片肽受体配体 [6] ,但对于不同阿片肽受体亚型对众多配体的选择性作用机制,尚缺乏全面的研究。

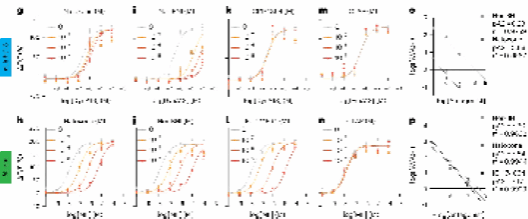
因此,研究人员通过低浓度 (10 nM) 配体实验,评估了三种探针对各种内源性和合成配体(包括小分子抑制剂)的荧光响应,从而探究了基于阿片肽亚型而开发的探针对配体的选择性。结果发现, κLight1.3 和 δLight 这两种探针在区分不同类型阿片受体激动剂方面的高度特异性和敏感性。接着,他们利用雷达图比较了各类受体特异性配体对三种阿片受体探针的激活效果。这一系列结果展现了不同配体对各类阿片受体探针的选择性和激活效果的差异。
考虑到插入 cpGFP 可能会对配体结合特性产生影响,研究人员进行了放射性配体结合实验,并测定了下游通路的激活情况。结果发现,插入 cpGFP 后的κLight1.3和 δLight保留了足够的配体结合能力,但又不会引发下游信号中β-arrestin1 的募集和 G 蛋白介导的cAMP信号抑制。这意味着这些探针可以作为一种相对独立的工具用于配体结合检测。
三、用 κLight 成像脑内强啡肽 (Dynorphin) 扩散
为了验证这些探针在更复杂的生物体系的功能,研究人员选择了在立体脑片上对强啡肽 (DynA8,也称 CYD8) 的扩散进行可视化研究。
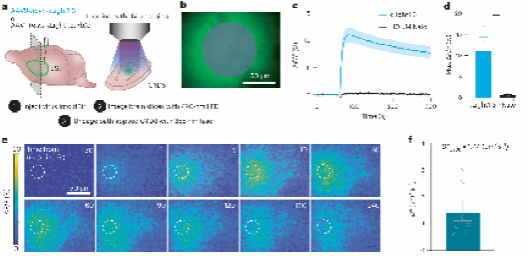
研究人员在小鼠背侧纹状体注射了不同变体的AAV9-hSyn-κLight1.x病毒,并使用 355 nm 激光闪光解笼 DynA8 ,同时用 473 nm LED 成像 κLight 的荧光反应。结果显示, κLight1.3 变体产生较大响应,而 Nalo 可阻断这一反应。这证实了荧光变化源于配体依赖的探针激活。
研究人员进一步利用 κLight1.2a 探针,测量了 DynA8 在小鼠背侧纹状体内的扩散动力学。通过快速光释放小体积的 DynA8 ,并监测距离光解笼位置 125 μm 范围内的探针激活情况,研究人员计算得出 DynA8 在该区域的有效扩散系数为 1.4 ± 0.4 μm⟡/s。这表明 DynA8 能在释放后几秒钟内扩散到距离释放位置 100 μm 以外的受体区域。
四、结合双光子成像观测电刺激的强啡肽释放
过去难以确定能有效触发内源性阿片肽释放的电刺激参数,这限制了对阿片肽系统的研究。本研究中的阿片类探针具有易检测的荧光信号,因此研究人员试图通过这些新工具来深入探究刺激阿片肽释放的电刺激规律。
研究人员通过整合来自催产素探针 MTRIAOT 的连接序列 [7] ,开发了改进的κLight 探针变体 κLight1.3a 。与原有的 κLight1.3 相比,新的 κLight1.3a 保持了相似的动态范围,但基础亮度信号提高了2倍以上,并且在体外实验中表现出对DynA13的高选择性。
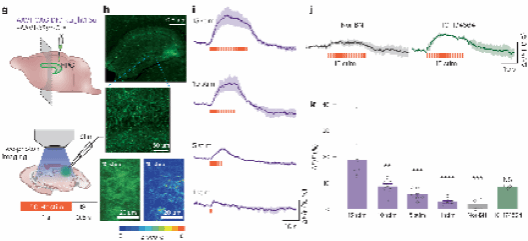
接着利用这一变体,研究人员在海马 CA3 区通过 AAV1 病毒载体系统稀疏表达了 κLight1.3a ,并在表达 3 周后进行双光子成像实验。成像结果可见,在 CA3 区和齿状回观察到神经元的明亮标记,基础状态下可清晰观察到神经突起。使用一系列电刺激后,观察到持续的荧光增强,刺激停止后荧光信号迅速衰减。刺激次数越多,最大荧光响应越大,表明 κLight1.3a 能够有效检测电刺激诱发的内源性阿片肽释放,并反映其动态过程。
五、探讨受体选择性阿片配体在体内的作用
为了弥补脑片实验在生理环境、神经调节方面的局限,研究人员将探针应用于小鼠的脑内,利用编码 κLight1.3 和 δLight 的病毒载体及光纤记录技术,观察了受体选择性激动剂对这两种探针的激活效果。
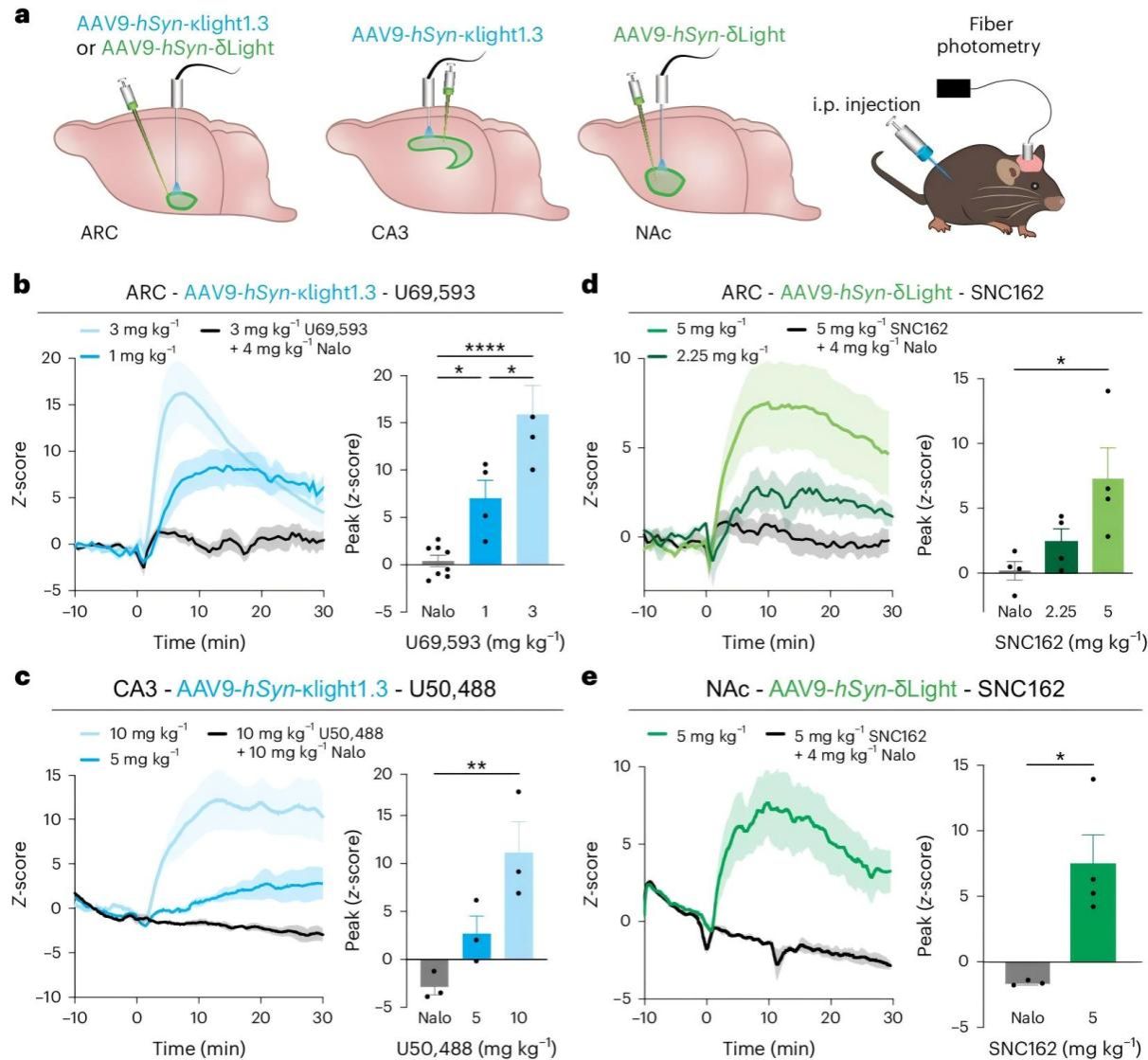
研究人员在小鼠弓状核(ARC)、海马 CA3 区和伏隔核(NAc)注射 AAV9-hSyn编码的 κLight1.3 或 δLight ,在注射位置上方植入光纤,使用光纤光度法记录荧光信号,通过腹腔注射 (i.p.) 给予阿片受体选择性配体。
结果发现, ARC 和 CA3 区的 κLight1.3 对κ受体激动剂 U69593 和 U50488呈现剂量依赖性反应,且能被非选择性阿片受体拮抗剂纳洛酮抑制; ARC 和 NAc 区的 δLight 对δ受体激动剂 SNC162 也有剂量依赖性反应,该反应同样可被纳洛酮抑制。这些发现证明了两种探针在体内能被相应受体激动剂可靠激活,并具有良好的动态范围和光纤-表达相关性,为后续开展光遗学和行为学研究奠定了基础,显示了这些探针在活体内研究阿片受体活动的可行性和有效性。
六、通过环路特异性光刺激测量强啡肽释放
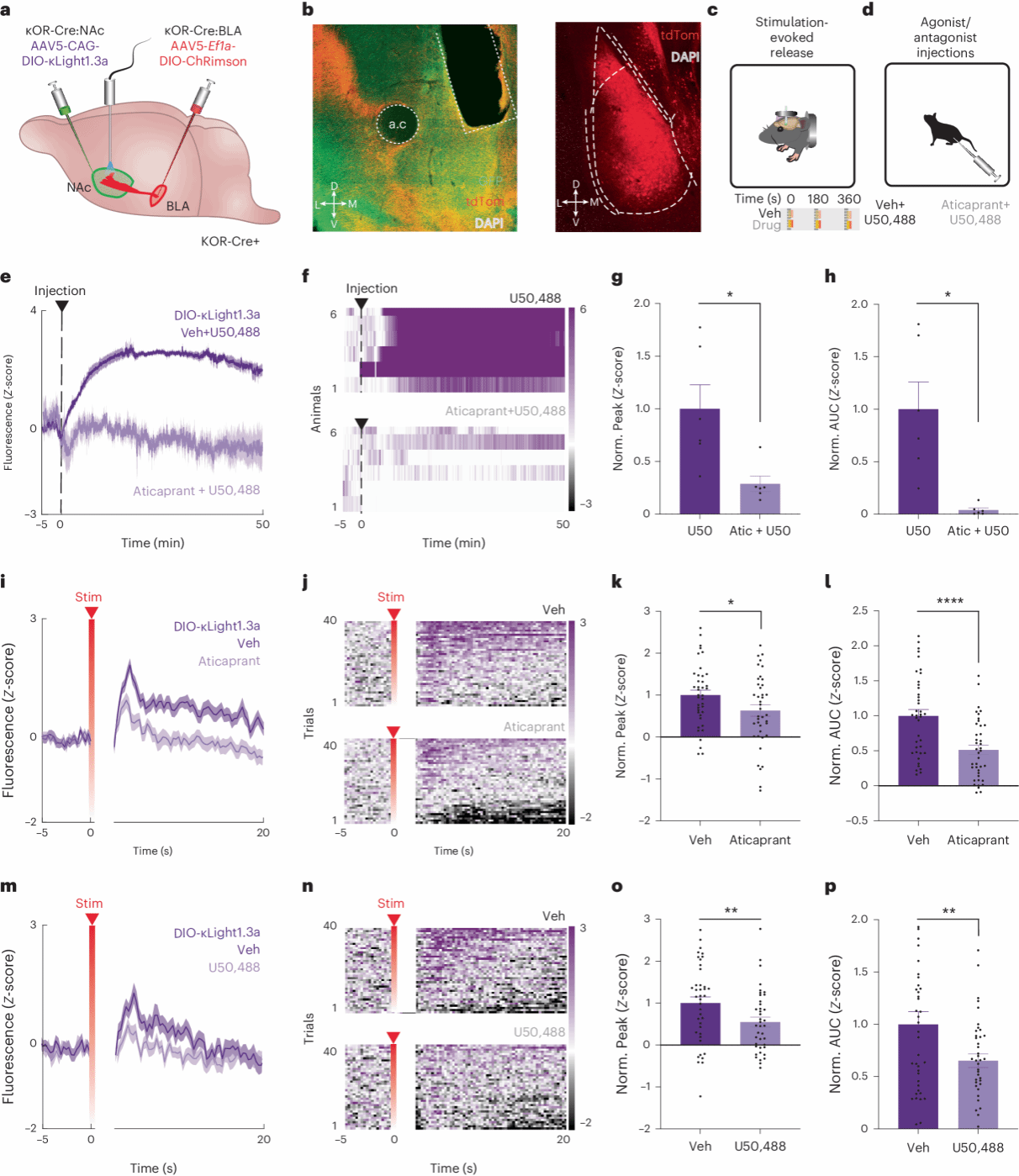
光遗传学广泛用于触发神经调质释放和神经活动,但直接监测体内光遗传刺激触发的肽释放尚未实现。研究选择了含有丰富 Dyn 的伏隔核,以及从基底外侧杏仁核向伏隔核壳部发送密集兴奋性投射的神经回路。他们在 κOR-Cre 小鼠的伏隔核壳部注射了表达 κLight1.3a 的病毒载体,并在基底外侧杏仁核注射了红移光敏蛋白 ChRimson 。结果显示, κLight1.3a 能够检测到光刺激诱发的 Dyn 释放,具有电路特异性和高时间分辨率。这种检测方法还表现出良好的药理学选择性和对 Dyn 的特异性。
这项研究首次实现了在体内光学测量特定神经环路中光遗传刺激诱发的神经肽释放,为研究神经肽在特定神经环路中的作用提供了新工具,有助于深入理解 Dynorphin-κOR 系统在奖赏和厌恶行为中的作用。
七、监测行为所触发的体内内源性阿片释放
无论是通过腹腔注射还是电刺激产生,这些阿片肽都是人为引入体内的。为了进一步研究这些探针对于动物体自身产生的阿片肽的响应效果,研究人员利用听觉恐惧条件反射实验和奖赏条件反射实验此类会产生阿片肽变化的经典范式,探究所开发探针对于真正内源性阿片肽的响应能力。
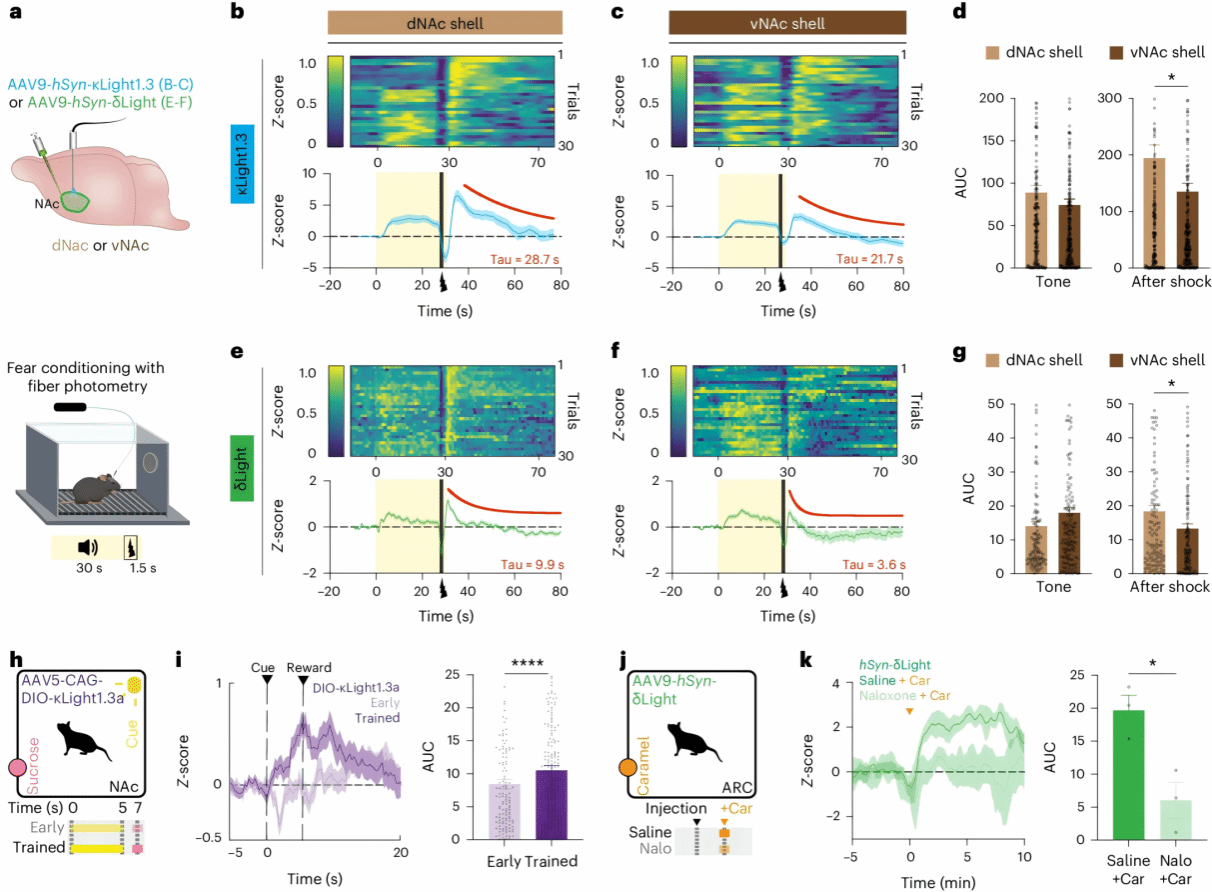
研究人员利用 κLight 和 δLight 两种新型阿片肽探针,监测了小鼠在恐惧诱导和奖赏条件下内源性阿片肽信号的动态变化。结果显示,这些探针能够可靠地反映 NAc 不同亚区间阿片肽释放的差异特征:在恐惧条件下, κLight1.3 信号模式表明 Dyn 可能在 NAcSh 中积极参与了恐惧状态的追踪;在奖赏条件下,两种探针都检测到了与奖赏相关的内源性阿片肽释放。这些发现为探索阿片肽系统在情绪和奖赏加工中的作用提供了新工具,有助于深入理解 NAc 亚区在复杂行为中的差异性功能,同时也展示了这些新型探针在活体行为研究中监测内源性阿片肽动态的潜力。
总结与展望
研究团队开发的 κLight 、 δLight 和 μLight 探针为观察阿片肽在神经系统中的动态活动提供了前所未有的精确工具。该研究成功设计和优化了针对不同阿片受体的荧光探针,验证了探针的药理学特性和选择性,首次实现了对脑内强啡肽扩散的直接观察,结合光遗传学技术实现了对特定神经环路中阿片肽释放的精确监测,在行为实验中成功捕捉到与恐惧和奖赏相关的内源性阿片肽释放模式。这些成果为深入理解阿片系统在情感、动机和行为调节中的作用奠定了基础。
未来,这些工具可能在揭示阿片肽系统在神经精神疾病中的作用机制,为疼痛管理、成瘾治疗和情绪调节提供新的治疗靶点和策略,帮助开发更精确、副作用更小的阿片类药物,以及促进对神经肽在神经网络中作用的整体理解等方面发挥重要作用。此研究为阿片肽系统的研究开辟了新途径,有望在神经科学、药理学和临床医学等多个领域产生深远影响。
参考文献
[1]Hökfelt T, Barde S, Xu ZD, et al. Neuropeptide and Small Transmitter Coexistence: Fundamental Studies and Relevance to Mental Illness. Front Neural Circuits. 2018;12:106. Published 2018 Dec 21.
[2]van Steenbergen H, Eikemo M, Leknes S. The role of the opioid system in decision making and cognitive control: A review. Cogn Affect Behav Neurosci. 2019;19(3):435-458.
[3]Fricker LD, Margolis EB, Gomes I, Devi LA. Five Decades of Research on Opioid Peptides: Current Knowledge and Unanswered Questions. Mol Pharmacol. 2020;98(2):96-108.
[4]Dong C, Gowrishankar R, Jin Y, et al. Unlocking opioid neuropeptide Dynamics with genetically encoded biosensors. Nat Neurosci. 2024;27(9):1844-1857. (本文原文)
[5]Gomes I, Sierra S, Lueptow L, et al. Biased signaling by endogenous opioid peptides. Proc Natl Acad Sci U S A. 2020;117(21):11820-11828.
[6]Che T, Roth BL. Molecular basis of opioid receptor signaling. Cell. 2023;186(24):5203-5219.
[7]Ino D, Tanaka Y, Hibino H, Nishiyama M. A fluorescent sensor for real-time measurement of extracellular oxytocin Dynamics in the brain. Nat Methods. 2022;19(10):1286-1294.
本文作者:苏一驰组何云帆