研究已发现大量与神经、精神障碍风险显著相关的基因,这其中有一个关键的未解问题:同一基因需要根据不同的突变类型定制治疗策略。对于NRXN1,它编码一种突触前细胞粘附蛋白,是大脑中重要的突触组织者,NRXN1复杂可变的剪接模式对于构建多样化的神经环路至关重要,其中NRXN1的α-异构体就在不同脑区和细胞类型中存在差异,大量研究表明,NRXN1基因的缺失是在大小和位置上各不相同,这使得阐明这些缺失导致的多种临床症状背后的分子机制变得困难 [1]。
在这一背景下,来自耶鲁大学医学院的Kristen Brennand 团队和纽约西奈山伊坎医学院的 Paul Slesinger 团队和Gang Fang团队合作探讨了罕见神经精神障碍相关拷贝数变异(2p16.3)导致的neurexin1杂合缺失的表型复杂性 [2] 。

该团队在2019年的一项研究中,通过分析患者来源的NRXN1+/−hiPS细胞诱导的神经元,发现这些神经元具有独特的5′或3′缺失,导致野生型NRXN1α水平显著下降,并且仅从3′缺失等位基因中产生了数十种新的异构体。单独过表达野生型(WT)能够以基因型依赖的方式改善患者来源的NRXN1+/− hiPS细胞神经元中的神经活动减少,而突变体(MT)异构体的表达则降低了对照组hiPS细胞神经元中的神经活动水平。因此,他们推测5′启动子区域的缺失代表了经典的LOF,而3′特异性MT异构体的强表达则产生了GOF效应,这种效应无法通过过表达野生型异构体来恢复 [3] 。
1.不同患者的NRXN1+/−突变在神经元中产生了不同的NRXN1剪接模式
为了研究NRXN1+/−缺失对两种不同神经元细胞类型的影响,他们利用2例5′-Del、2例3′-Del和4例健康对照生成了兴奋性谷氨酸能神经元和抑制性GABA能神经元。

结果发现,α-外显子在5′-Del和3′-Del两种类型的神经元中分别减少和增加。为了研究可变剪接的变化,他们使用了LeafCutter进行无注释分析,发现iGLUT和iGABA神经元之间的差异剪接分析产生了一个显著集中在SS3的聚类,这表明不同异构体在这两种细胞类型之间是保守的。


2.患者特异性的自发神经活动变化无法由被动和兴奋性膜特性差异解释
为了评估NRXN1+/−缺失在iGLUT和iGABA神经元中的影响,他们使用MEA记录了群体水平的自发神经活动,并通过全细胞膜片钳技术测量了被动膜特性。
结果显示,在5′-Del和3′-Del NRXN1+/−iGLUT神经元中,在诱导后4周和6周,自发网络活动减少了超过40%。此外,5′-Del和3′-Del神经元与对照iGLUT神经元相比,细胞电容、膜电阻和静息膜电位没有显著差异。这些结果共同表明,被动或内在兴奋性膜性质的变化不足以完全解释5′-Del和3′-Del在iGLUT神经元中观察到的MEA上放电减少的现象。
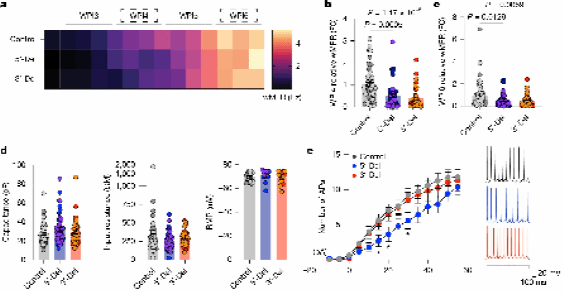
与此同时,他们观察到未成熟的NRXN1+/−iGABA神经元在5′-Del和3′-Del两种情况下,自发网络活动均显著提升了约两倍。然而,在成熟的iGABA神经元中,5′-Del和3′-Del神经元的平均wMFR显著下降。与iGLUT神经元类似,成熟的iGABA神经元在NRXN1+/−5′-Del或3′-Del与对照组之间,其被动和内在兴奋性膜特性没有显著差异。总体而言,患者特异性的自发神经活动变化不能完全由被动和兴奋性膜特性的差异来解释。
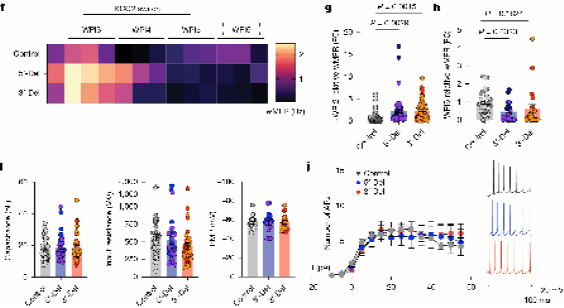
3.NRXN1+/−5′和3′缺失导致突触传递缺陷
为了进一步分析改变自发放电表型的调节因素,他们研究了突触传递的效能。膜片钳电生理学结果显示,在iGLUT神经元中,自发兴奋性突触后电流的频率在5′-Del和3′-Del iGLUT神经元中均有所下降。与对照组相比,3′-Del和5′-Del iGLUTs的事件间隔累积概率显著增加。5′-Del神经元的sEPSC幅度也有所增加。

相比之下,iGABA神经元中的突触传递似乎得到了增强,自发抑制性突触后电流的频率增加,表现为3′-Del iGABA神经元中IEIs显著减少。sIPSC的幅度没有变化。

结合转录组测序和针对突触的免疫染色结果,共同表明这些突触效应主要由NRXN1表达的变化驱动。
4.双向兴奋抑制性突触缺陷的等基因验证
为了证明NRXN1异常剪接与突触功能障碍之间的直接联系,他们专门针对特定的剪接模式设计了一个实验,使用shRNAs在对照组中敲低野生型剪接异构体,模拟LOF表型。在功能上,他们观察到iGLUT神经元的突触传递减少,而iGABA神经元的突触传递增加,这些变化与5′-Del神经元的变化相似。总体而言,WT剪接的敲低重现了NRXN1+/− 5′-Del神经元中细胞类型特异性的差异,表明WT NRXN1α表达减少是导致细胞类型特异性表型的关键因素。

对于GOF NRXN1 3′-Del神经元,他们使用shRNAs敲低MT剪接异构体,以逆转GOF表型。在两个iGLUT(90%)和iGABA(37%)神经元中敲低效果最显著的细胞系中,电生理记录显示突触传递表型的逆转,实现了与对照iGLUT和iGABA神经元相似的IEI水平。在iGLUT神经元中,shRNA MT减少了sEPSC IEI与非靶向shRNA相比,iGABA神经元中sIPSC的IEIs增加。


5.针对分层LOF或GOF表型的精准医学框架
为了验证他们提出的治疗干预概念,研究测试了直接和间接操纵NRXN1表达的方法,分别针对LOF和GOF机制,重点是逆转iGLUT神经元中减少的兴奋表型。
对于LOF患者,β-雌二醇在非洲爪蟾和人类神经前体细胞模型中逆转了NRXN1 LOF导致的神经发生缺陷,尽管机制尚不清楚,但通过小鼠脑组织中的ChIP-Seq发现了ERα结合位点位于NRXN1α位点。他们急性使用β-雌二醇显著增加了iGLUT神经元中NRXN1α位点的表达,这些神经元来源于5′-Del患者,但在对照组中未见此效果。研究评估了30 nMβ-雌二醇对5′-Del神经元进行慢性处理后在自发神经活动(MEA)、突触传递(膜片钳技术)和基因表达(RNA-seq)方面的功能影响,发现有明显改善。
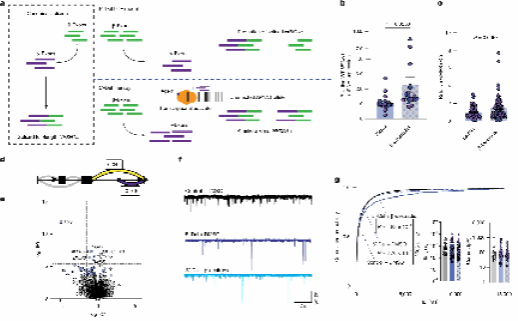
为了开发治疗GOF患者的疗法,他们研究了反义寡核苷酸(ASOs)的效用,在特殊设计的ASO处理72小时后,在iGLUT神经元中,总MT异构体减少了约55%,与非靶向对照ASO相比。差异剪接分析证实了GOF剪接的减少和SS4+比率的增加。他们还观察到β→α剪接显著减少,这可能是由于MT异构体表达减少所致,与3′-Del中NRXN1α异构体的基线升高形成对比。
总结
总的来说,本研究发现,NRXN1的异常剪接通过双向调节突触传递,改变了兴奋性与抑制性的平衡,这是神经精神障碍中的一个常见现象。对于NRXN1的缺失,精准医疗需要根据患者的基因突变是通过LOF还是GOF机制起作用来分层患者,以实现通过增加野生型和/或消除突变型的NRXN1异构体的个体化恢复。
鉴于预测在脑部疾病中会产生LOF和GOF机制的突变数量不断增加,本研究发现为未来精准医疗增添了新的视角:LOF突变需要上调野生型等位基因的表达,或恢复NRXN1的正确剪接,鉴于雌二醇能增加NRXN1表达并改善突触功能,基于类固醇的药物已被用于治疗神经炎症相关疾病,证明了这种方法的安全性和可行性;对于GOF突变,设计针对剪接位点的反义寡核苷酸,以促进微管异构体的降解,可能是一种有效的治疗策略。
尽管体外研究初步表明了一种新的治疗途径,但要确认这一框架在体内乃至临床中的有效性,仍需进行转化研究。
[1]Südhof TC. Synaptic Neurexin Complexes: A Molecular Code for the Logic of Neural Circuits. Cell. 2017 Nov 2;171(4):745-769.
[2]Fernando MB, Fan Y, Zhang Y, et al. Phenotypic complexities of rare heterozygous neurexin-1 deletions. Nature. 2025 Apr 9.
[3]Flaherty E, Zhu S, Barretto N, et al. Neuronal impact of patient-specific aberrant NRXN1α splicing. Nat Genet. 2019 Dec;51(12):1679-1690.
本文作者:邵志成组孔语菲