在生活中你是否遇到过这种情况:当遇到困难时,我们首先会鼓足干劲,奋力一搏。但如果事情依旧毫无进展,我们会逐渐丧失斗志,放弃挣扎。也就是说,当行为变得无效,大脑会发出指令让行为发生转变。那么这背后的神经机制是怎么样的呢?
2025年5月15日美国霍华德休斯医学院Misha B. Ahrens研究组在《Science》上发表了名为“Norepinephrine changes behavioral state through astroglial purinergic signaling”的文章,首次揭示了星形胶质细胞嘌呤能信号在去甲肾上腺素(NE)介导的行为状态转变中的核心作用。研究团队以幼年斑马鱼为模型,发现在无效游泳的过程中,NE能够快速兴奋神经元网络导致行为增强;同时又通过星形胶质细胞嘌呤能信号介导的延迟抑制通路使行为在增强之后受到抑制。这一发现揭示了星形胶质细胞在神经网络功能中发挥的主动调控作用,进一步加深了对神经-胶质交互网络的理解。
去甲肾上腺素能神经元驱动双相性“无效反应”
前期研究发现如果游动无法使鱼体向前移动,那么这种无效行为会激活后脑的NE神经元。NE信号通过星形胶质细胞传递,进而抑制无效游泳。在这项研究中,研究者利用幼年斑马鱼能够根据视觉反馈来调整自身位置的天性,设计了一套行为范式来研究无效感诱导的抑制行为。将幼鱼包埋在琼脂糖中,仅尾部能自由运动。底部使用投影仪投射视觉刺激(移动光栅),同时顶部设有相机,能够实时监测尾部位置。若检测到的游泳动作实时触发视觉反馈,光栅向后移动,则形成闭环控制,对于幼鱼而言模拟前进成功;若光栅无移动,则形成开环控制,模拟游泳无效。在闭环和开环周期切换的过程中,研究人员发现进入开环阶段时,幼鱼首先展现出了短暂的剧烈游泳行为,随后进入一段“被动期”,表现为游泳行为停止。先前研究表明,"无效感"由延髓中一群去甲肾上腺素能神经元(NE-MO)编码,这群神经元的激活会引发星形胶质细胞内钙离子浓度升高,进而驱动外侧延髓中抑制运动的GABA能神经元。因此研究人员利用光遗传学手段激活了这一类NE神经元,发现与运动相关的神经元经历了先兴奋后抑制的双相过程。NE受体有两类:α-ARs和β-ARs,而星形胶质细胞上α1-ARs的激活已被证实是导致抑制相产生的原因。随后他们分别阻断了α1-ARs和β-ARs,发现阻断α1-ARs后抑制相降低,但对兴奋相无显著影响;相反,阻断β-ARs抑制兴奋相的产生,而不影响抑制相。这些结果表明NE神经元通过β-ARs和星形胶质细胞上的α1-ARs分别介导无效感诱导的兴奋相和抑制相。
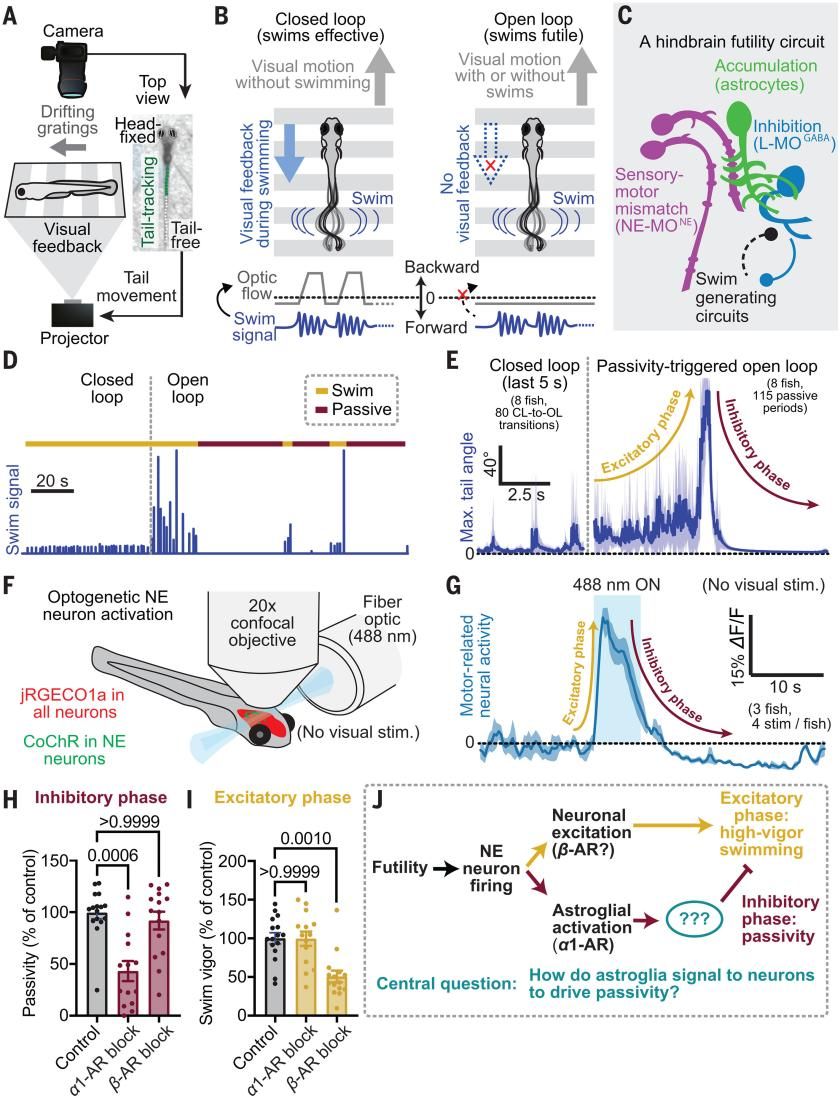
Fig. 1. Futility triggers a biphasic behavioral and neural response through NE neuron activation.
无效游泳诱导去甲肾上腺素依赖的星形胶质细胞ATP释放
那么星形胶质细胞的激活为什么会抑制游泳行为呢?研究人员推测它释放了某种神经活性物质,将信息传递给下游神经元。鉴于胶质来源的ATP对神经功能具有调控作用,因此他们首先锁定ATP。通过成像技术,研究人员发现无效游泳确实引发后脑ATP含量大幅上升,并且进一步证明这种变化是由星形胶质细胞中α1-ARs激活导致的。因此,无效行为能触发星形胶质细胞释放ATP,这一过程需要NE参与。
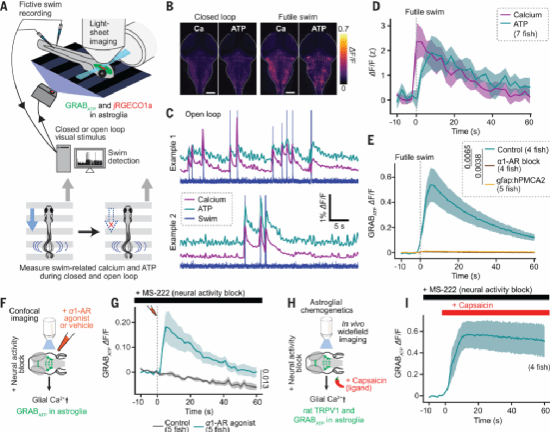
Fig. 2. Futility drives astroglial release of ATP.
胞外ATP代谢为腺苷促进抑制行为
接下来研究人员进一步证实ATP含量升高能促进被动期的产生。那么其中的机制是什么呢?首先他们无差别阻断了所有类型的ATP受体,发现被动期时长没有降低。说明ATP不是直接效应物质。由于ATP在胞外能够被代谢成腺苷,研究人员又测试了腺苷是否能够产生这种效应。阻断胞外ATP代谢成腺苷的途径后,被动期明显减弱。随后又探究了腺苷的作用受体。通过药理学手段确认了腺苷受体A2BR的激活介导抑制行为而非兴奋行为的发生。这些结果表明星形胶质细胞嘌呤能信号实现无效反应中的抑制相 ,而非兴奋相。
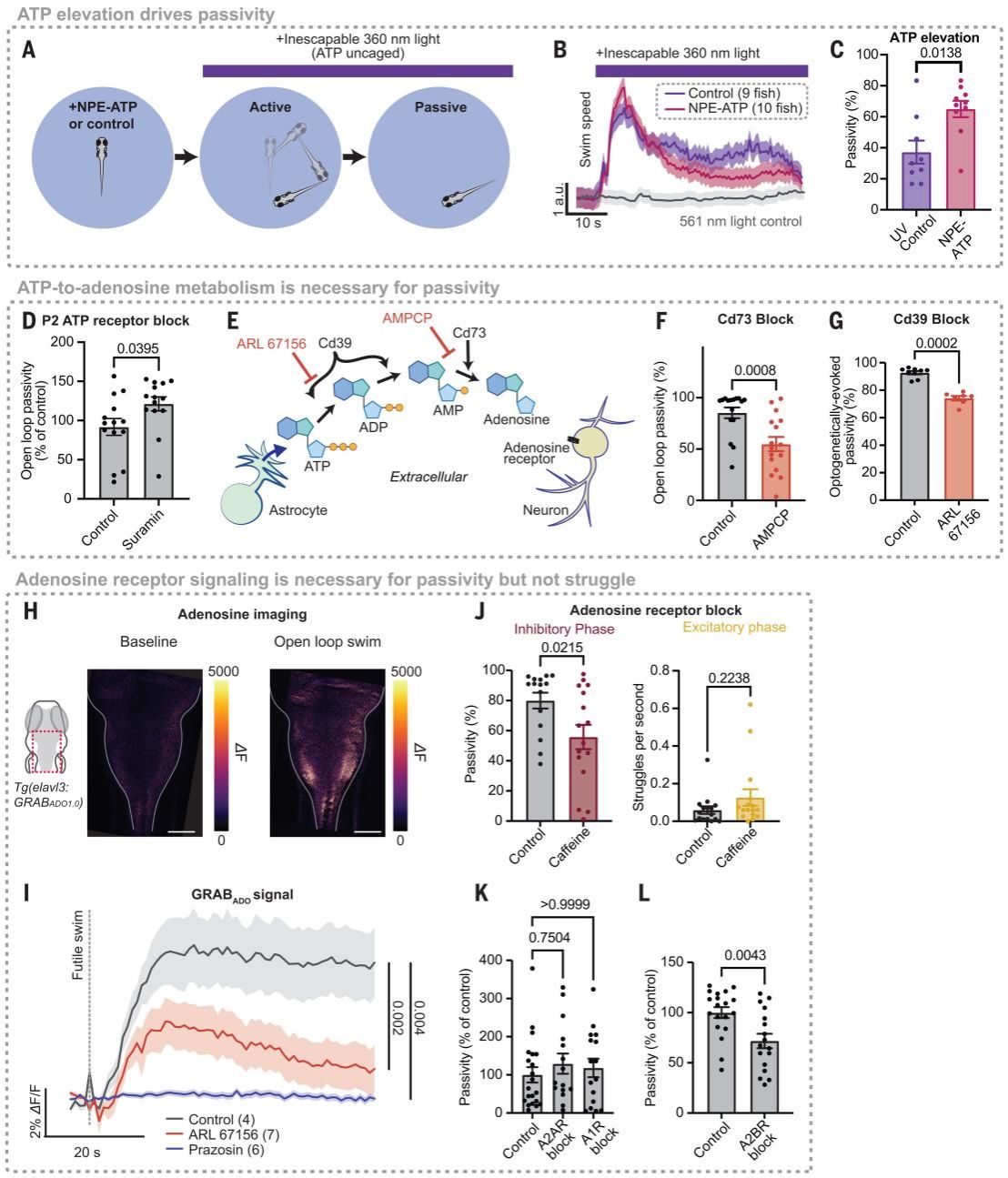
Fig. 3. ATP promotes passivity through extracellular metabolism into adenosine.
腺苷驱动外侧延髓中抑制游泳的神经元
神经元是最终输出运动指令的细胞。因此研究人员进一步探究星形胶质细胞嘌呤能信号的下游靶向细胞。利用原位杂交技术锁定了一群位于外侧延髓的表达A2BR的神经元( L-MO)。这群神经元能够被无效游泳激活,此过程依赖于腺苷受体。综上所述,这些数据证明星形胶质细胞释放的嘌呤能信号通过激活外侧延髓中抑制性神经元的A2B腺苷受体,对运动环路施加抑制。
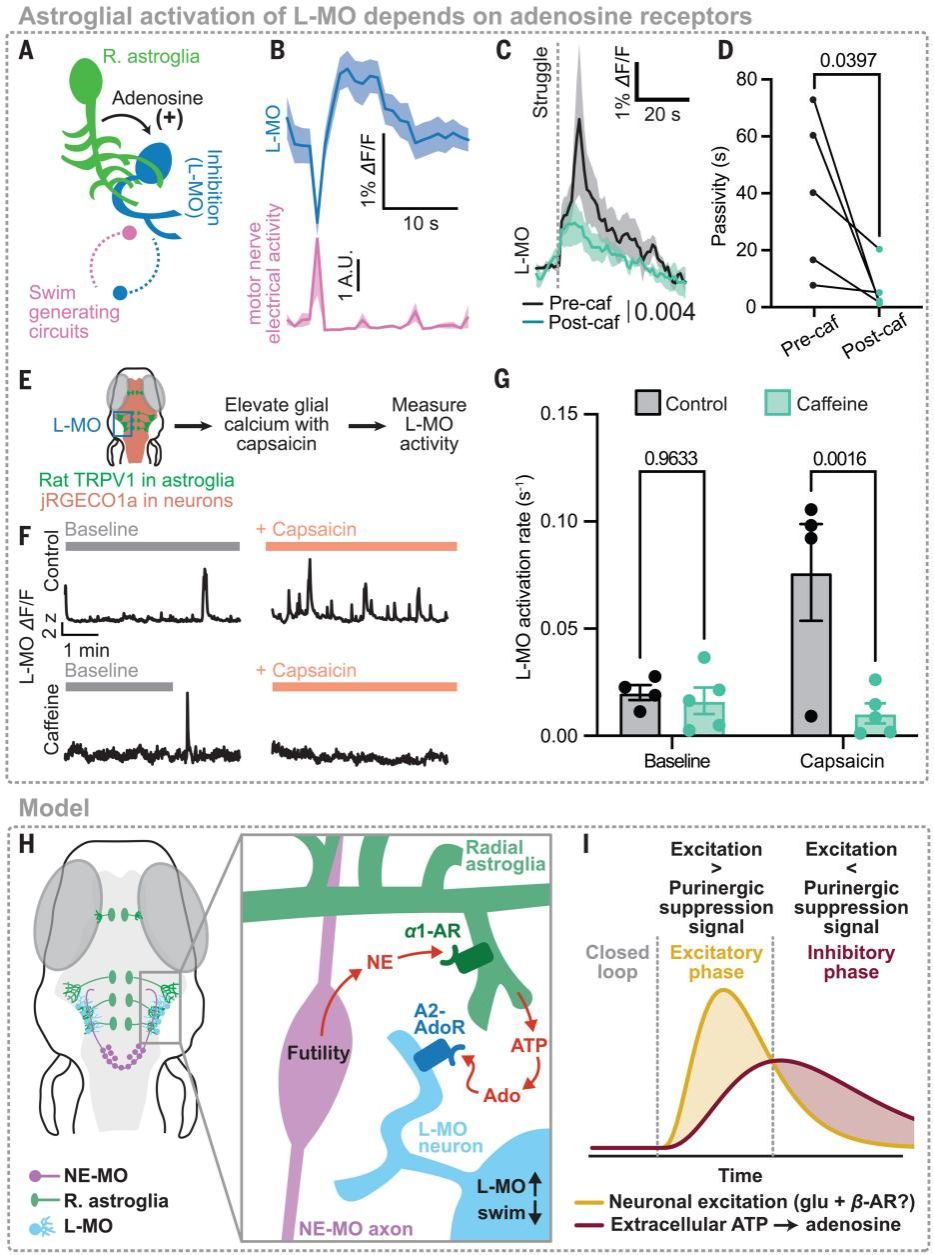
Fig. 4. Adenosine persistently activates the swim-suppressing region L-MO.
总结
本研究系统揭示了星形胶质细胞在去甲肾上腺素介导的行为状态转换中的核心作用,不仅刻画了一条从行为感知到胶质信号再到神经活动的信号通路,更挑战了“NE直接作用于神经元”的传统观念,确立了星形胶质细胞作为神经调质网络中关键整合单元的地位。这一进化上保守的NE-astroglia-purinergic signaling motif为理解大脑如何通过胶质细胞实现对神经网络兴奋性的调控提供了崭新视角,也为后续探究相关精神疾病的机制开辟了新的思路。
参考文献:
1.Mu Y, Bennett DV, Rubinov M, et al. Glia Accumulate Evidence that Actions Are Futile and Suppress Unsuccessful Behavior[J]. Cell. 2019;178(1):27-43.e19.
2. Rinaman L. Hindbrain noradrenergic A2 neurons: diverse roles in autonomic, endocrine, cognitive, and behavioral functions[J]. Am J Physiol Regul Integr Comp Physiol. 2011;300(2):R222-R235.
3. Gordon GR, Baimoukhametova DV, Hewitt SA, Rajapaksha WR, Fisher TE, Bains JS. Norepinephrine triggers release of glial ATP to increase postsynaptic efficacy[J]. Nat Neurosci. 2005;8(8):1078-1086.
本文作者:谭超组张燕