引言:
疼痛是身体的“警示信号”,它能帮助我们规避危险;但是如果组织已经愈合,疼痛仍然存在,就会发展为持续性疼痛,这种“无效警示”严重影响了生活质量。此前研究发现,脊髓环路的异常重构是持续疼痛的重要原因,但大脑在其中发挥的作用还不清楚。与此同时,临床观察发现:人在面临饥饿、口渴或危险时,对疼痛的敏感度会显著降低:比如饥饿的人受伤后可能感觉不到剧痛,遭遇天敌的动物即便受伤也能全力逃跑。这种“生存优先于疼痛”的现象,背后是否存在特定的神经机制呢?

2025年10月,美国宾夕法尼亚大学、斯克里普斯研究所等机构联合在《Nature》发表题为“A parabrachial hub for need-state control of enduring pain”的研究。研究团队发现大脑外侧臂旁核(lPBN)中表达神经肽Y1受体(Y1R)的神经元集群可以编码持续性疼痛状态,并且响应于饥饿、口渴、天敌威胁等生存需求,通过抑制NPY信号可以实现内源性镇痛。这一发现为持续性疼痛的精准干预打开了全新大门,也让我们对“疼痛与生存需求的优先级调控”有了颠覆性认知。
一、外侧臂旁核Y1R阳性神经元调控持续性疼痛
首先,为了找到关键的神经元亚型,研究团队通过空间转录组测序与生信分析,发现PBN中的一群表达Y1R的神经元在福尔马林诱导的持续性疼痛模型中被显著激活。进一步地,团队利用化学遗传学操纵方式抑制这些神经元,发现可以显著减轻炎症性疼痛和神经病理性疼痛(如坐骨神经损伤模型)的持续反应,而对急性疼痛无影响。反之,化学遗传激活Y1R神经元则能诱导小鼠产生类似持续性疼痛的机械痛敏和冷痛敏,并伴随着焦虑样行为和条件性位置厌恶表现。这些结果表明,PBN中Y1R神经元对于调控持续性疼痛信号具有充分及必要性,其活性与疼痛状态密切相关。
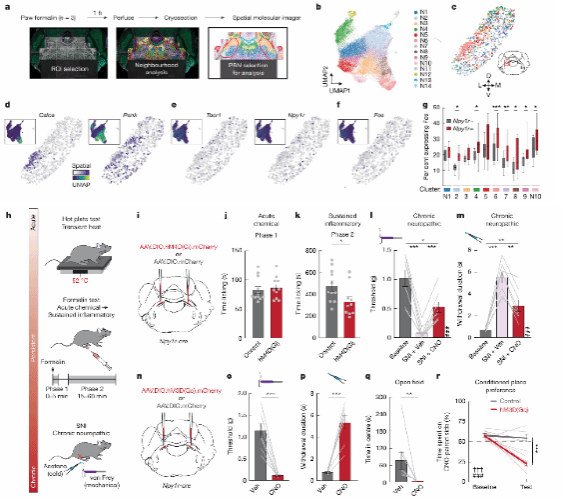
图1:lPBN的Y1R神经元影响持续性疼痛
二、Y1R神经元在持续痛时被激活
接下来研究团队聚焦于Y1R神经元,利用光纤光度法和微型显微镜(miniscope)技术,记录了其在持续性疼痛过程中的钙信号活动。团队发现,Y1R神经元的活性在福尔马林诱导的急性疼痛阶段和炎症阶段阶段均显著升高,且存在两种模式:与舔舐行为相关的快速波动,以及独立于行为的持续缓慢激活;与Y1R神经元不同,PBN中的非Y1R神经元在炎症阶段未表现出显著的缓慢激活。这些数据结合第一部分内容,进一步证明:Y1R神经元在疼痛过程中呈现特殊活动模式,这可能反映了其介导持续性疼痛的特殊功能,而非仅对急性疼痛的短暂响应。
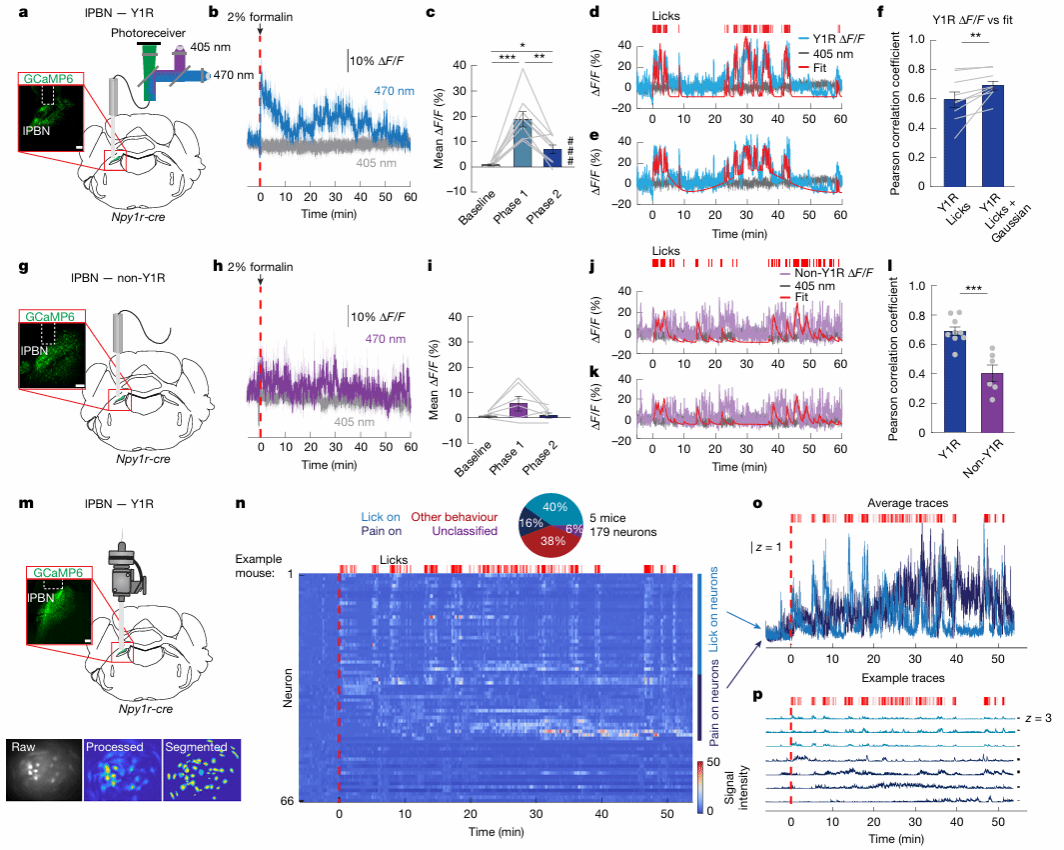
图2:Y1R神经元在福尔马林诱导的持续性疼痛过程中的钙活动信号
三、lPBN中Y1R阳性神经元介导生存威胁下的疼痛缓解
在确认了Y1R神经元介导持续性疼痛后,研究团队思考其是否在生存威胁下(如饥饿、口渴和恐惧等)发挥疼痛缓解作用。行为学实验发现,食物剥夺、水剥夺和捕食者气味均能显著减轻福尔马林诱导的炎症性疼痛和神经病理性疼痛的持续性反应,而对急性疼痛无影响。与此同时,通过lPBN局部注射Y1R受体拮抗剂,可阻断这些生存威胁状态对疼痛的抑制作用,说明PBN通过作用于Y1R受体发挥生存威胁状态下的镇痛作用。
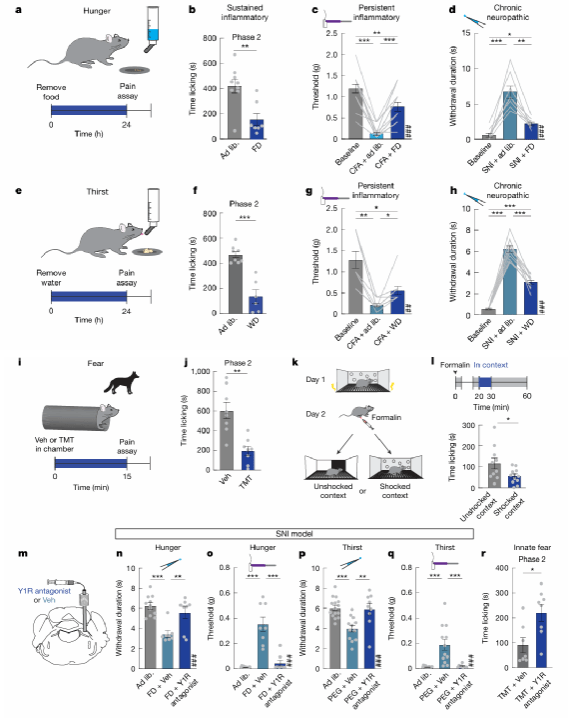
图3:生存威胁下, Y1R信号介导持续性疼痛的抑制
四、生存威胁对疼痛传递的门控效应
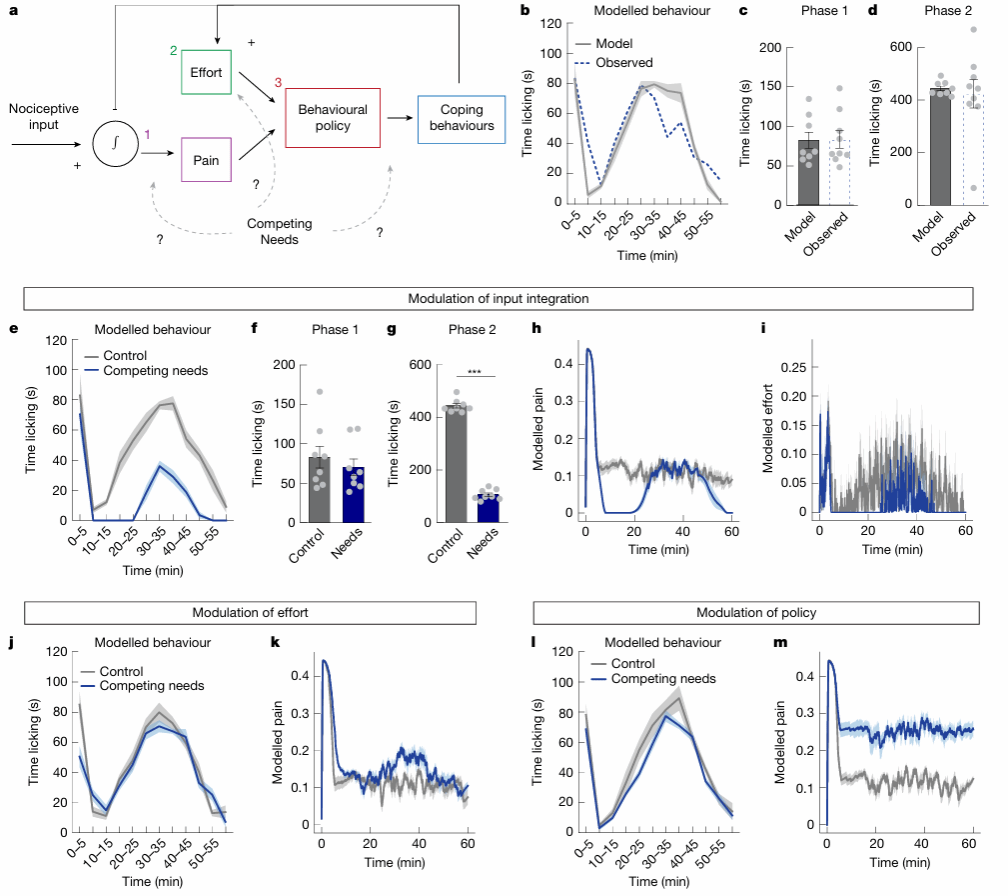
至此,研究团队已经确定,lPBN中的Y1R神经元在持续性疼痛中被激活,而饥饿、口渴和恐惧通过NPY–Y1R信号抑制这些与疼痛相关的行为反应。为了推测生存威胁如何通过NPY信号调节疼痛感知和行为反应,团队随后根据小鼠行为状态建立了强化学习数学模型。模型假设疼痛状态由“Pain(疼痛)”和“Effort(付出,即做出舔舐行为)”两个变量构成,舔舐行为可减轻“Pain”但消耗“Effort”。模拟结果表明,生存威胁主要通过门控效应抑制痛觉的上行传导,从而减少舔舐行为,而其他模型则无法再现实验结果,这一结果进一步支持了lPBN中NPY通过降低疼痛输入来抑制持续性疼痛的假说
 。
。
图4:生存威胁对疼痛传递的门控模型
五、持续性疼痛状态下生存威胁抑制lPBN Y1R神经元
最后研究团队验证了生存威胁状态(饥饿、口渴、恐惧)如何通过抑制Y1R神经元性来减轻持续性疼痛。研究发现,食物剥夺、PEG诱导的口渴和TMT诱导的恐惧均能显著降低Y1R神经元在福尔马林炎症阶段的钙信号活动,与其对疼痛行为的抑制效应一致。通过化学遗传学激活弓状核NPY神经元向PBN的投射,也能有效抑制Y1R神经元活动。此外,饥饿状态下Y1R神经元对持续性炎症引起的机械刺激反应的增强也被逆转,进一步支持了NPY信号在调节持续性疼痛状态中的关键作用。
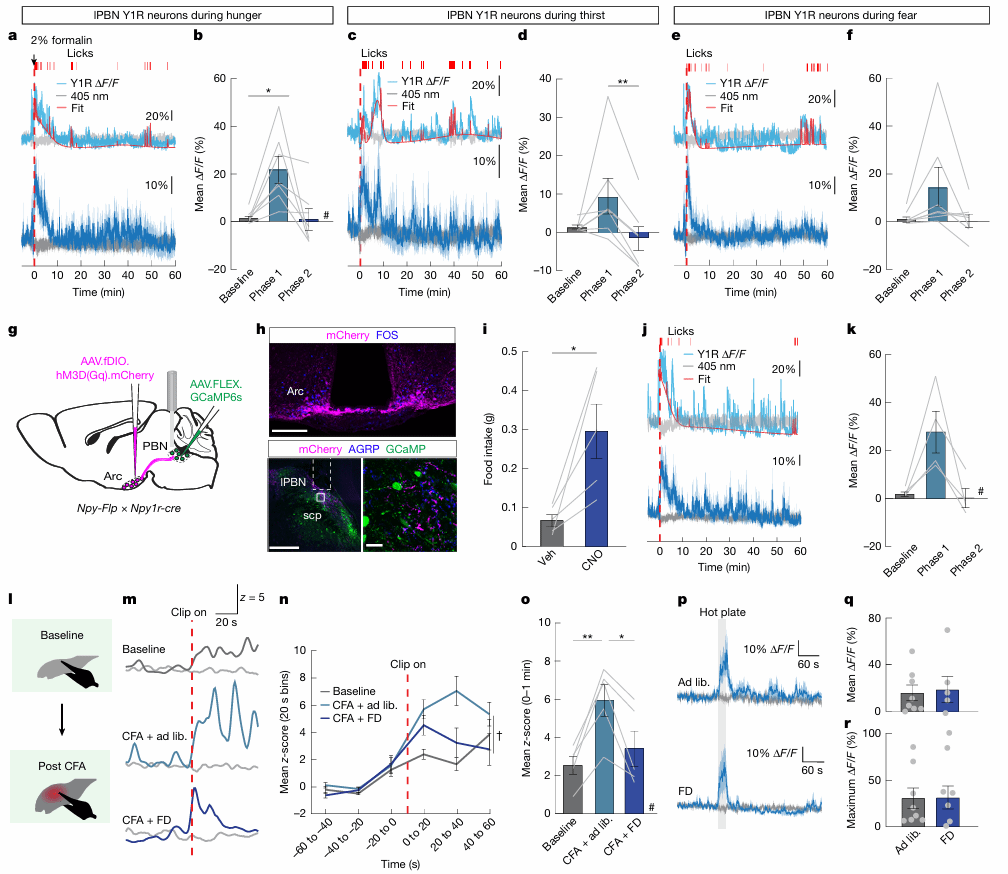
图5:生存威胁通过抑制Y1R神经元减轻持续性疼痛
结语:
本研究揭示了一群位于外侧臂旁核(lPBN)、表达神经肽Y1受体(Y1R)的神经元,它在调控持续性疼痛中扮演着核心的“枢纽”角色。这些神经元在空间和分子层面上具有多样性,其持续性的活动模式特异性地编码了由损伤引发的持续性疼痛状态,而非短暂的急性伤害感受。更关键的是,研究发现饥饿、口渴和恐惧等生存威胁状态,能够通过lPBN的Y1R阳性神经选择性地抑制这种持续性疼痛,而不影响急性痛觉。这种机制的核心是:NPY-Y1R信号通路门控效应调节了从脊髓上行的伤害性输入在lPBN的整合,从而动态调整疼痛状态,以适应更紧迫的生存需求。
本研究的发现具有重要的理论意义和转化潜力。在理论层面,它首次明确鉴定了在脑干水平整合多种内源性镇痛信号的神经细胞群,将疼痛生物学与机体整体状态调控紧密联系起来,为理解“疼痛作为一种大脑状态”提供了具体的细胞与环路基础。在应用层面,lPBN中Y1R阳性神经元及NPY信号通路为开发新型镇痛策略指明了新的方向。通过模拟或增强这一内源性的镇痛通路,未来或许能开发出副作用更小、不易成瘾的非阿片类镇痛疗法。
参考文献:
1.Duan B, Cheng L, Bourane S, et al. Identification of Spinal Circuits Transmitting and Gating Mechanical Pain. Cell. 2014;159(6):1417-1432.
2.Goldstein N, Maes A, Allen HN, et al. A parabrachial hub for need-state control of enduring pain. Nature. 2025 Nov;647(8090):689-697.
本文作者:邓娟组林昕怡