髓母细胞瘤(medulloblastomas,MB)是儿童中最常见的恶性脑肿瘤,占所有儿童脑肿瘤的15%至25%。脑部特殊的环境决定了MB的生长受到血脑屏障、复杂的神经元细胞和免疫细胞相互作用等多种肿瘤微环境因素的调控,是其疗效不佳、预后较差的重要因素之一。基于经典的甲基化测序, MB可被划分为四个分子亚群:SHH、WNT、Group 3(三型)和Group 4(四型),其中SHH和WNT亚型患者生存期相对较长,而三型和四型预后不良。早期的癌症基因组学未能在MB中鉴定到高频突变,尤其对于三型和四型MB的驱动机制仍然不清楚。目前, MB的治疗尚未有有效的药物,仍依赖于手术和放化疗。既往单细胞转录组测序(scRNA-seq)的工作揭示了MB瘤内异质性,并通过将MB细胞图谱与发育中的小鼠或人类小脑进行比较来推断亚组可能的起源细胞。然而由于传统的转录组测序并不能有效测量支配不同基因表达的调控机制,且目前髓母细胞瘤的分型仍局限于甲基化分类,临床上缺乏高特异性的转录组和蛋白组生物标记。因此,阐明MB的分子亚型标志物及其调控将为MB的治疗策略提供新的参考。

近日,我院双聘PI杨辉课题组(复旦大学附属华山医院青年研究员)与复旦大学附属华山医院毛颖教授和中国科学院北京基因组研究所(国家生物信息中心)蒋岚研究组合作,在Advanced Science杂志上发表了题为”Single-Cell Chromatin Accessibility Analysis Reveals Subgroup-Specific TF-NTR Regulatory Circuits in Medulloblastoma” 的论文,绘制了人类MB各亚型的单细胞染色质可及性图谱(Chromatin accessibility),并且揭示了神经递质受体在不同肿瘤分子亚型中的特异性和治疗意义。
研究团队克服了病理组织冻存样品难以进行单细胞测序的难题,成功获取了11例人类髓母细胞瘤样本来源的共59015个单细胞的高质量染色质可及性信息。通过甲基化微阵列的金标准检测表明甲基化分型结果与单细胞数据分子分型结果完全一致。团队随后鉴定了MB中影响细胞命运的顺式调控元件(Cis-regulatory elements)和转录因子(Transcription factors,TFs),并筛选了亚型特异性的TFs。这些调控元件通过招募不同的转录因子来影响细胞命运,揭示了MB肿瘤细胞的分化和发展。
研究表明,神经肿瘤细胞与神经元发生相互作用,促进恶性演进。由于髓母细胞瘤是一种起源于神经细胞的肿瘤,肿瘤细胞与周边神经细胞的不同细胞交流与信号传输的方式可能是导致肿瘤内异质性产生的原因。联合snATAC-seq与scRNA-seq MB数据集,团队发现MB细胞中存在广泛的突触合成基因表达,基于神经递质受体(NTR genes)基因特征集表达的队列分型与甲基化金标准几乎一致(准确性>98%),这为肿瘤分类提供了新的生物标记。
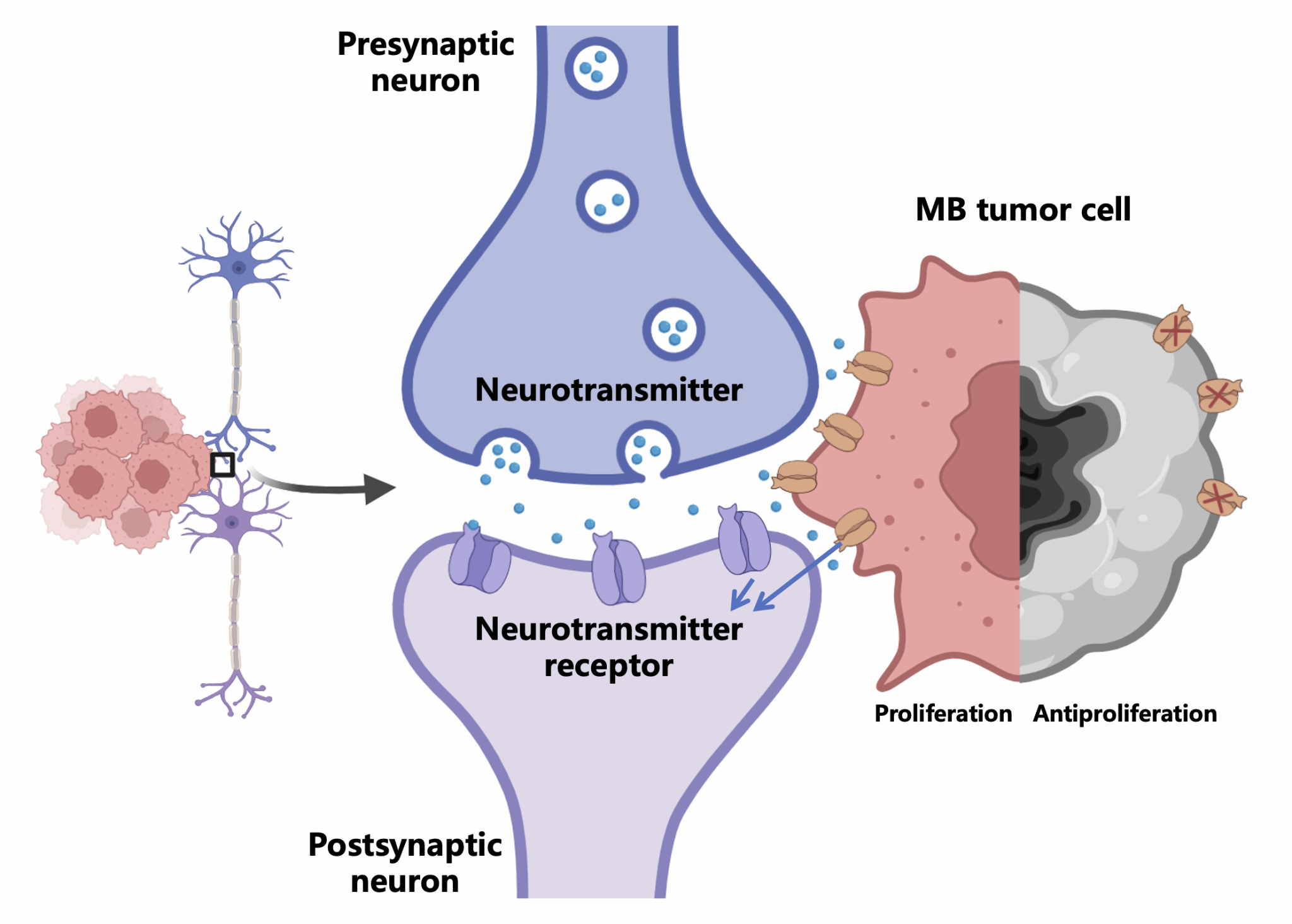
图1:髓母细胞瘤中的亚型特异性神经递质受体基因影响肿瘤细胞生长
团队进一步证实MB亚型中的特异性的癌症驱动通路(WNT,SHH等)对于NTR表达的调控具有特异性并绘制了调控图谱,这解释了为何MB存在亚型特异性的NTR基因。由于神经元和肿瘤细胞间的相互作用主要依赖于电化学突触,MB细胞中存在大量亚型特异性的NTR基因表达,表明MB的生长和起源可能与肿瘤细胞与神经元形成突触的作用存在重要关联。体外和体内的基因敲除实验证明NTR基因的敲除能够抑制相应分子亚型的肿瘤细胞增殖。这些结果证实了TF-NTR网络可作为MB分子分型的依据,神经信号参与了髓母细胞瘤的增殖。

图2:转录因子-神经递质受体调控网络具有髓母细胞瘤分子亚型特异性

综上所述,该研究通过构建髓母细胞瘤的染色质可及性图谱,从神经突触合成维度,发现神经递质受体基因的不同髓母亚型特异性,为髓母细胞瘤的分子分型和对应治疗提供了新依据。
该研究由复旦大学附属华山医院毛颖教授,华山医院/脑科学转化研究院杨辉研究员,中国科学院北京基因组研究所(国家生物信息中心)蒋岚研究员合作完成,蒋岚组硕士研究生高晓玥,复旦大学附属华山医院博士研究生庄骐源,蒋岚组特别研究助理李芸以及助理研究员李国超为文章的并列第一作者。蒋岚组博士研究生黄正,硕士研究生孙少省、陈甚之参与了单细胞ATAC-seq数据以及CNV数据的分析。该项工作也获得了复旦大学脑科学转化研究院实验平台大力支持。