肺癌是全球癌症致死的主要原因,而发生脑转移的肺癌患者面临更加严峻的预后。这类患者的生存率显著降低,亟需新的治疗策略。近年来,以奥希替尼为代表的第三代酪氨酸激酶抑制剂(TKI)已显示出在靶向EGFR突变的肺癌脑转移患者中具有良好的疗效。然而,耐药问题的出现则显著影响了治疗的持续性和有效性,成为临床医生和患者共同面临的重大挑战。鉴于肺癌脑转移样本的获取难度和动物模型构建的复杂性,TKI对脑转移瘤免疫微环境影响的研究尚需深入探索。
研究启示:CTLA4阻断联合TKI克服耐药性,为肺癌脑转移治疗带来新希望
2024年10月17日,迟喻丹研究员与毛颖教授的研究团队在国际权威期刊《Cancer Cell》上发表了题为“Overcoming tyrosine kinase inhibitor resistance in lung cancer brain metastasis with CTLA4 blockade”的重要研究论文。该研究利用先进的单细胞测序技术,对肺癌脑转移样本进行了深入分析,揭示了TKI靶向药物奥希替尼在治疗过程中的耐药机制。奥希替尼不仅能够显著提升T细胞在肿瘤中的浸润度,还促使免疫检查点CTLA4的表达上调。这种机制的出现最终导致了肿瘤细胞通过免疫逃逸现象躲避T细胞的攻击。为了解决这一挑战,研究团队探索了TKI靶向药物与CTLA4单抗联合使用的策略。令人鼓舞的是,这种组合疗法能够有效激活T细胞的功能,从而克服肿瘤的免疫逃逸,为肺癌脑转移的临床治疗开辟了新的方向。

图1. EGFR突变肺癌脑转移患者TKI靶向与CTLA阻断联合治疗策略
研究团队收集了31例含常见基因突变(EGFR、ALK和P53等)和经TKI靶向治疗的病人的新鲜肺癌脑转移肿瘤样本,构建了携带不同基因突变肺癌脑转移肿瘤的全景细胞微环境图谱。结果显示,相较于其他类型转移瘤,EGFR突变的肺癌脑转移样本中,T细胞浸润的数量相对较少。值得注意的是,TKI治疗后,样本中的T细胞浸润程度显著增加,但表现为免疫检查点CTLA4的表达升高,这表明尽管靶向治疗提高了T细胞数量,其功能却未能充分发挥。这一重要发现已在196例临床样本中得到了验证。
在机制研究上,本研究阐明了TKI治疗能够促进肿瘤细胞释放HMGB1和CALR等免疫活性分子,并通过激活巨噬细胞Toll样受体(TLR)来招募T细胞,从而提高T细胞的浸润程度。同时,浸润的T细胞也能够直接识别HMGB1等免疫分子,进而激活下游的炎症信号通路,其中p65转录因子可与CTLA4结合,导致CTLA4表达上调。
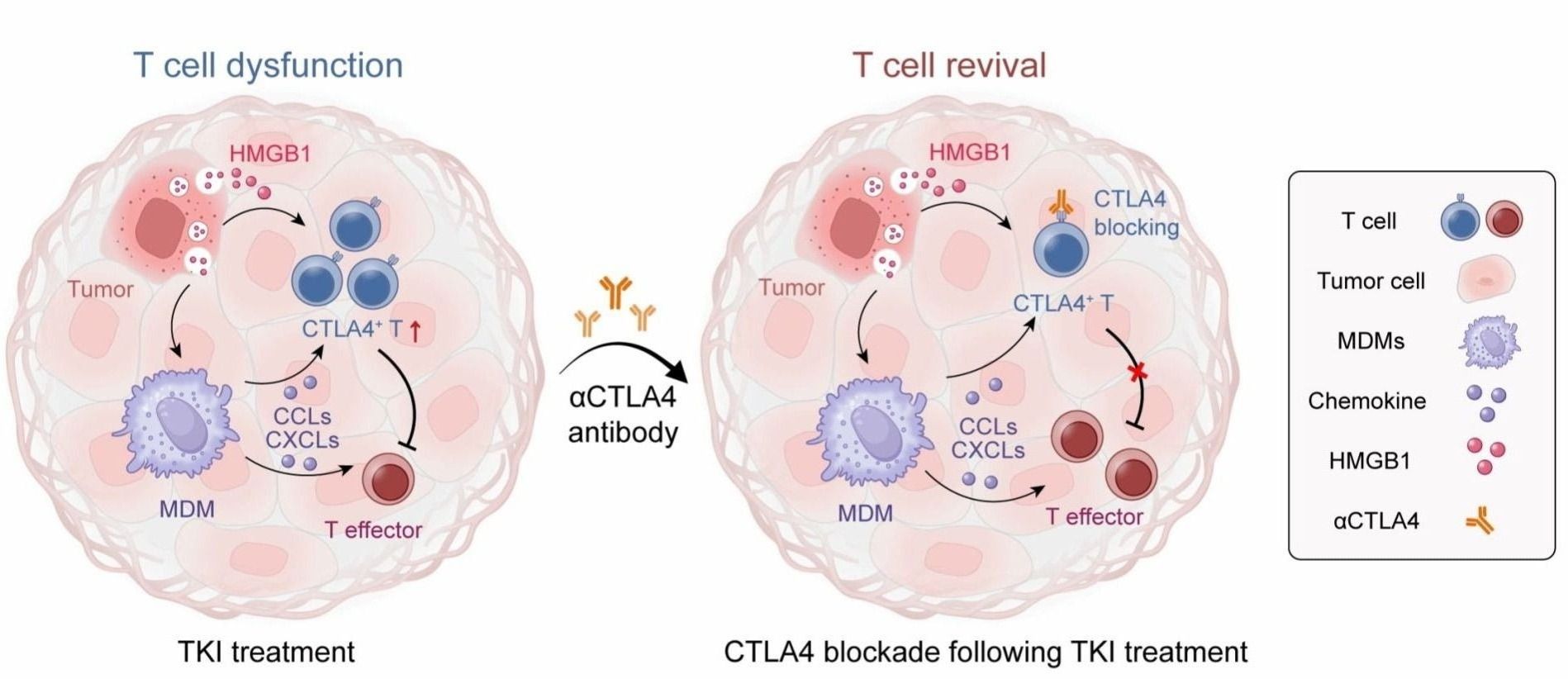
图2. 耐药T细胞的重塑与CTLA阻断后T细胞的重振
该研究还构建了EGFR突变肺癌脑转移的小鼠模型,模拟了临床上EGFR突变肺癌脑转移的病理特征。在该动物模型中,联合TKI与CTLA4单抗的治疗策略显著延长了荷瘤小鼠的生存期。进一步分析显示,联合治疗能够提高效应T细胞的比例,强化T细胞的抗肿瘤效应,从而成功克服了免疫逃逸现象,实现了耐药后的免疫重振。更重要的是,经联合治疗的荷瘤小鼠肝脏和肺部等脏器未出现明显的毒理损伤,且血液生化指标正常,表明该联合治疗方案具备良好的安全性。
综上所述,本研究全面描绘了TKI治疗前后肺癌脑转移免疫微环境的变化,揭示了TKI如何通过上调CTLA4重塑抑制性免疫微环境的机制,并在临床前模型中成功实现免疫重振,为靶向TKI耐药的肺癌脑转移患者的临床治疗开辟了新的方向。该研究不仅为理解肺癌脑转移治疗中的TKI耐药机制提供了重要见解,还为在临床上优化治疗方案提供了新的思路,标志着精准治疗时代的进一步推进。通过整合靶向治疗和免疫治疗,未来将可能提高肺癌脑转移患者的治疗效果和生存质量。复旦大学附属华山医院神经外科的毛颖教授、花玮教授与脑科学转化研究院迟喻丹研究员共同担任该论文的通讯作者,华山医院博士生傅敏杰与脑科学转化研究院赵加旭博士为共同第一作者。
迟喻丹课题组长期招聘博士后和研究生。我们致力于脑转移的基础转化研究,采用单细胞转录组学、空间转录组学、代谢组学、蛋白组学等多组学技术,结合临床前动物模型,探索靶向药物与免疫治疗的联合策略。我们欢迎对肿瘤生物学、免疫学、神经生物学及相关领域有浓厚兴趣的优秀人才加入我们的团队,共同攻克肺癌治疗中的耐药难题。感兴趣的候选人请将个人简历及相关材料发送至chiy@fudan.edu.cn。期待与您共同携手,为提升癌症患者的精准治疗贡献力量,共同开创基础与临床研究相结合的新未来!