神经病理性疼痛是全球健康领域的重大挑战之一,而人口老年化的发展使这一问题更加严峻。因此,解析神经病理性疼痛的发展机制,寻找新的治疗靶点显得尤为重要。脊髓是将外周信息传递至脑的核心节点。以往的研究认为,脊髓投射神经元主要将痛觉信息传递至对侧脑。随着研究技术的发展,多个团队报道脑干臂旁核(PBN)同时接收对侧和同侧脊髓的信息输入。2020年,邓娟解析了同侧脊髓-PBN通路在疼痛诱导的舔舐行为中发挥重要作用,这一发现为痛觉信息的上行机制研究提供了新的思路。然而,这一双侧投射通路在神经病理性疼痛发展过程中的功能仍然未知。
2024年12月23日,复旦大学脑科学转化研究院/附属华山医院邓娟课题组与复旦大学附属华山医院麻醉科王英伟教授合作在国际权威期刊《Neuron》上发表了题为“Tachykinin signaling in the right parabrachial nucleus mediates early-phase neuropathic pain development”的研究论文。该研究揭示了右侧(而非左侧)PBN在神经病理性疼痛的早期发展中发挥重要作用,并且PBN对神经病理性疼痛的偏侧化调控依赖于速激肽-1受体(NK1R)的活性。这些发现为神经病理性疼痛的机制研究提供了新的靶点,也为神经病理性疼痛的早期预警提供了生物标记物。

研究者利用SNI神经病理性疼痛模型,解析了脊髓投射神经元和接收脊髓信息输入的PBN神经元的功能,发现特异性凋亡靶标右侧PBN的神经元能显著缓解病理性疼痛诱发的痛觉过敏,而凋亡靶标左侧PBN的神经元不影响病理性疼痛的发展。研究团队进一步采用光遗传学结合全细胞电生理记录技术解析了这种偏侧化调控的机制,发现靶标右侧PBN的脊髓-PBN通路在慢性疼痛发展早期(术后第三天)发生短时程可塑性增强。进一步,研究者发现阻断速激肽1型受体NK1R,或敲低NK1R的编码基因Tacr1显著性消除了由神经病理性疼痛诱导的环路可塑性。
为进一步验证NK1R这一关键靶点在病理性疼痛发展中的功能,研究者采用药遗传学、药理学和基因编辑等一系列技术,在右侧PBN中特异性抑制Tacr1阳性神经元、阻断NK1R受体或者敲低Tacr1基因,发现这些调控手段都能显著缓解神经病理性疼痛诱导的痛觉敏化。说明,NK1R的活性在神经病理性疼痛相关痛觉敏化发展过程中至关重要。最后,研究团队在病理性疼痛发展后期对投射到PBN的脊髓神经元以及PBN中的Tacr1神经元进行抑制,发现并未改善由SNI引起的痛敏症状。这些结果表明,右侧PBN仅在神经病理性疼痛发展的早期发挥调控作用。
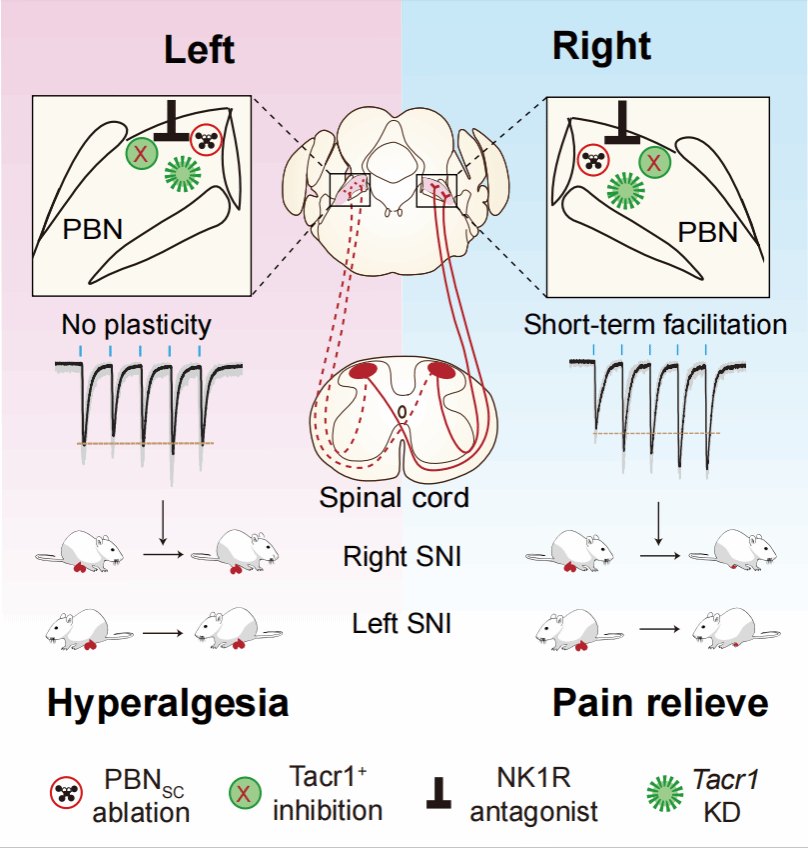
图1 右侧臂旁核调控病理性疼痛发展的机制。PBN接收双侧脊髓的信息输入(左侧PBN红色虚线,右侧PBN红色实线);在病理性疼痛发展过程中,靶标右侧PBN的脊髓上行通路发生短时程可塑性增强(Short-term facilitation);在右侧PBN中凋亡接收脊髓输入的神经元(PBNSC)、抑制Tacr1阳性神经元、阻断NK1R或者敲低Tacr1基因显著缓解左侧和右侧SNI导致的痛觉敏化。
复旦大学脑科学转化研究院/附属华山医院邓娟研究员和复旦大学附属华山医院麻醉科王英伟教授为该论文的通讯作者。复旦大学脑科学转化研究院博士生李银霞和博士后Ngoc T Ha为该论文共同第一作者。邓娟课题组科研助理李娟、硕士生严雅馨等为该论文做出了重要贡献,研究过程得到了中国科学院脑智卓越中心(神经所)孙衍刚研究员、复旦大学脑科学转化研究院程田林研究员和李博研究员的大力支持。该研究得到了科技创新2030—“脑科学与类脑研究”青年项目、国家自然科学基金、临港实验室“求索杰出青年计划”开放课题、上海市启明星等项目的资助。
邓娟课题组长期招聘博士后,致力于慢性疼痛的基础转化研究。采用病毒示踪、光遗传学、化学遗传学、动物行为学及电生理学等技术方法,结合多种慢性疼痛动物模型,探索慢性疼痛及相关情绪障碍的发生发展机制。探究脊髓电刺激镇痛的机制,希望通过机制研究优化刺激模式,研发神经调控与药物治疗的联合策略。课题组欢迎对神经环路、疼痛机制、神经调控及相关领域有浓厚兴趣的优秀人才加入。感兴趣的候选人请将个人简历和能够证明其相关工作能力的应聘材料通过电子邮件发至juandeng@fudan.edu.cn。期待与您携手,为缓解疼痛贡献力量。
原文链接:https://www.sciencedirect.com/science/article/pii/S089662732400878X