随着人口老龄化加剧,阿尔茨海默症(AD)已经成为全球严峻的公共健康挑战。然而,AD的遗传机制复杂,虽然全基因组关联分析已识别出超过70个AD风险基因座,但仍存在大量的“遗传力缺失”,可能源自基因组中的罕见变异。此外,当前的AD基因组学研究主要集中在欧美人群。相比之下,尽管中国已成为世界上AD患者人数最多的国家,针对中国AD人群的遗传研究仍然相对匮乏。
为此,我院程田林团队与复旦大学类脑智能科学与技术研究院特聘教授赵兴明/陈靖祺团队合作,聚焦中国AD人群中罕见且可能有害的基因组变异开展了相关研究。基于张江国际脑库(ZIB)神经退行性疾病队列中988名中国受试者的全基因组测序(WGS)数据及外部重复队列,团队成功鉴定了11个罕见大效应变异所介导的AD候选基因,并探讨了它们与AD多模态表型之间的关联。此外,体外细胞实验进一步验证了内吞通路中关键基因罕见变异的功能影响,为AD的治疗提供了潜在新靶点。相关成果以《Integrating rare pathogenic variant prioritization with gene-based association analysis to identify novel genes and relevant multi-modal traits for Alzheimer's disease》为题,于2024年12月23日正式发表在AD领域高水平期刊Alzheimer's & Dementia: The Journal of the Alzheimer's Association。
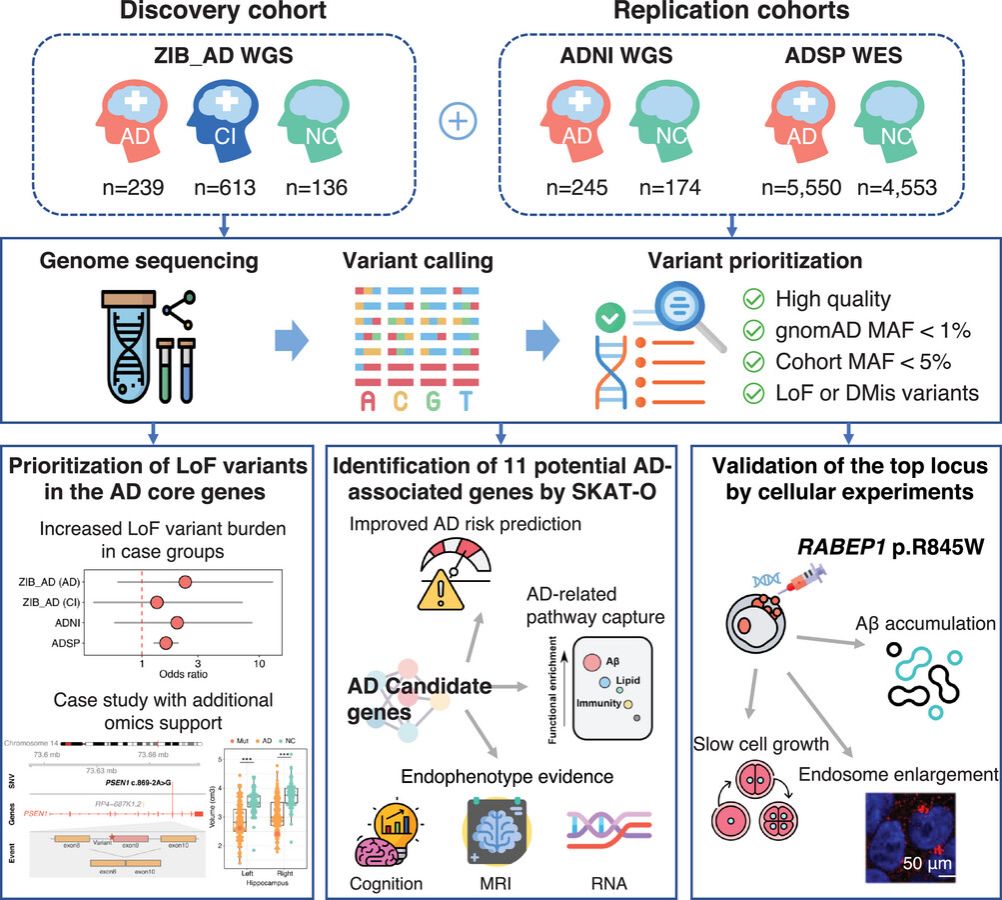
图 1 研究设计
研究团队从WGS数据出发,设计了结合基因组功能注释和计算预测的变异优先级方法,以鉴定罕见且可能有害的基因组变异。研究发现,已知AD风险基因中的功能丧失(Loss-of-Function)变异显著富集于病例组,验证了罕见大效应变异在AD遗传中的重要作用。通过应用SKAT-O (optimal sequence kernel association test)方法,团队成功鉴定了11个AD候选基因,其中7个为首次在AD遗传研究中报告。进一步分析显示,部分候选基因受东亚人群特异的罕见变异主导,但其机制通路与欧美人群的研究结果仍较为相似,为未来AD的个性化治疗提供了理论基础。值得注意的是,RABEP1、VIPR1、RPL3L和CABIN1等关键基因还与认知功能下降和多个AD相关脑区的萎缩密切相关。
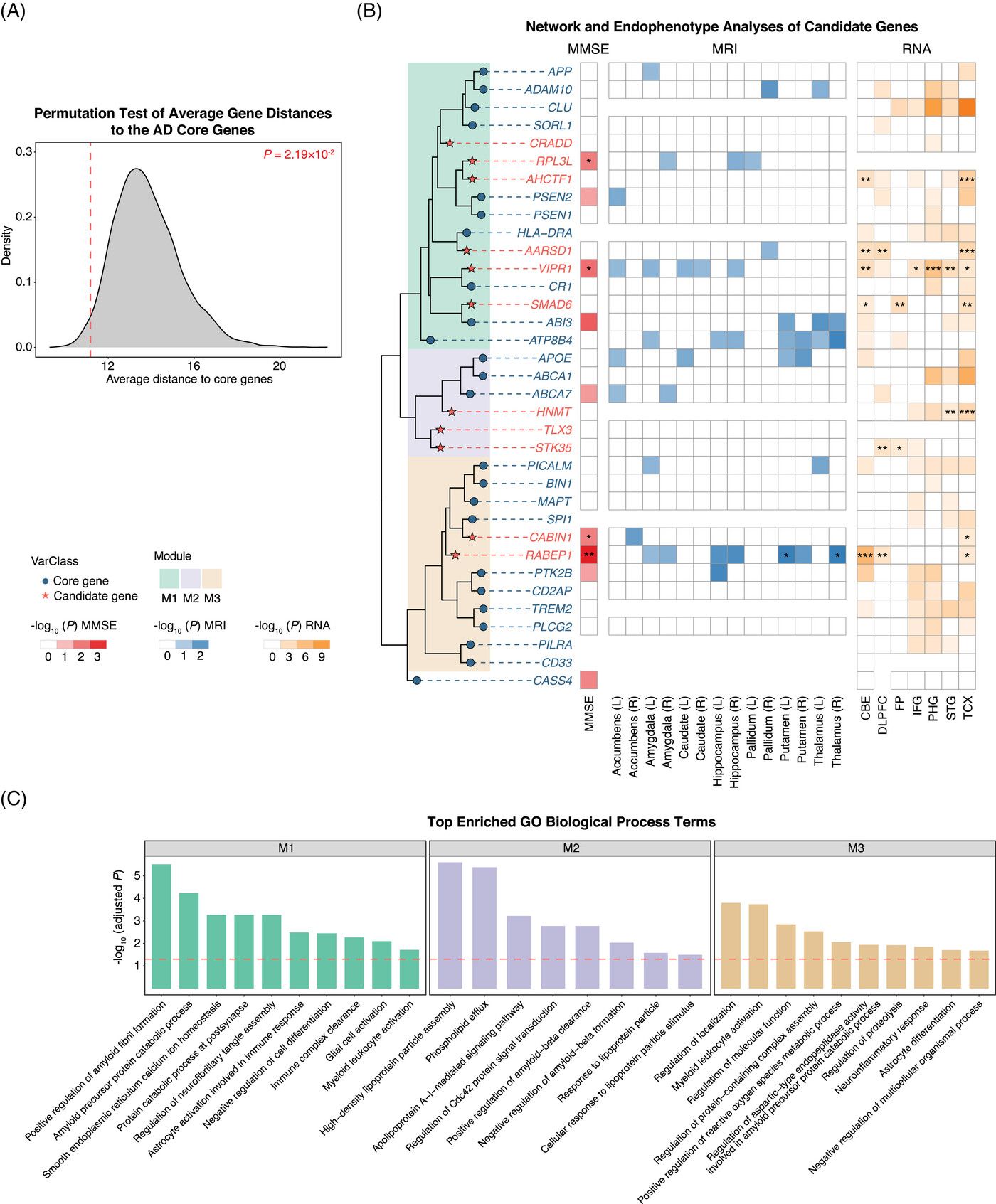
图 2 AD候选基因的网络和内表型分析
进一步,团队通过构建基因编辑HEK293T细胞系模型,对关键位点RABEP1 p.R845W的功能进行验证。相较于野生型细胞,突变型细胞的增殖速度显著减缓,早期和晚期凋亡的增加,并表现出内吞功能的潜在异常。更重要的是,突变型细胞中神经毒性β-淀粉样蛋白异常累积,这与AD的重要病理机制一致。综合以上结果,团队提出RABEP1 p.R845W变异可能通过影响内吞作用、诱导APP加工失调,从而在AD中发挥病理作用。
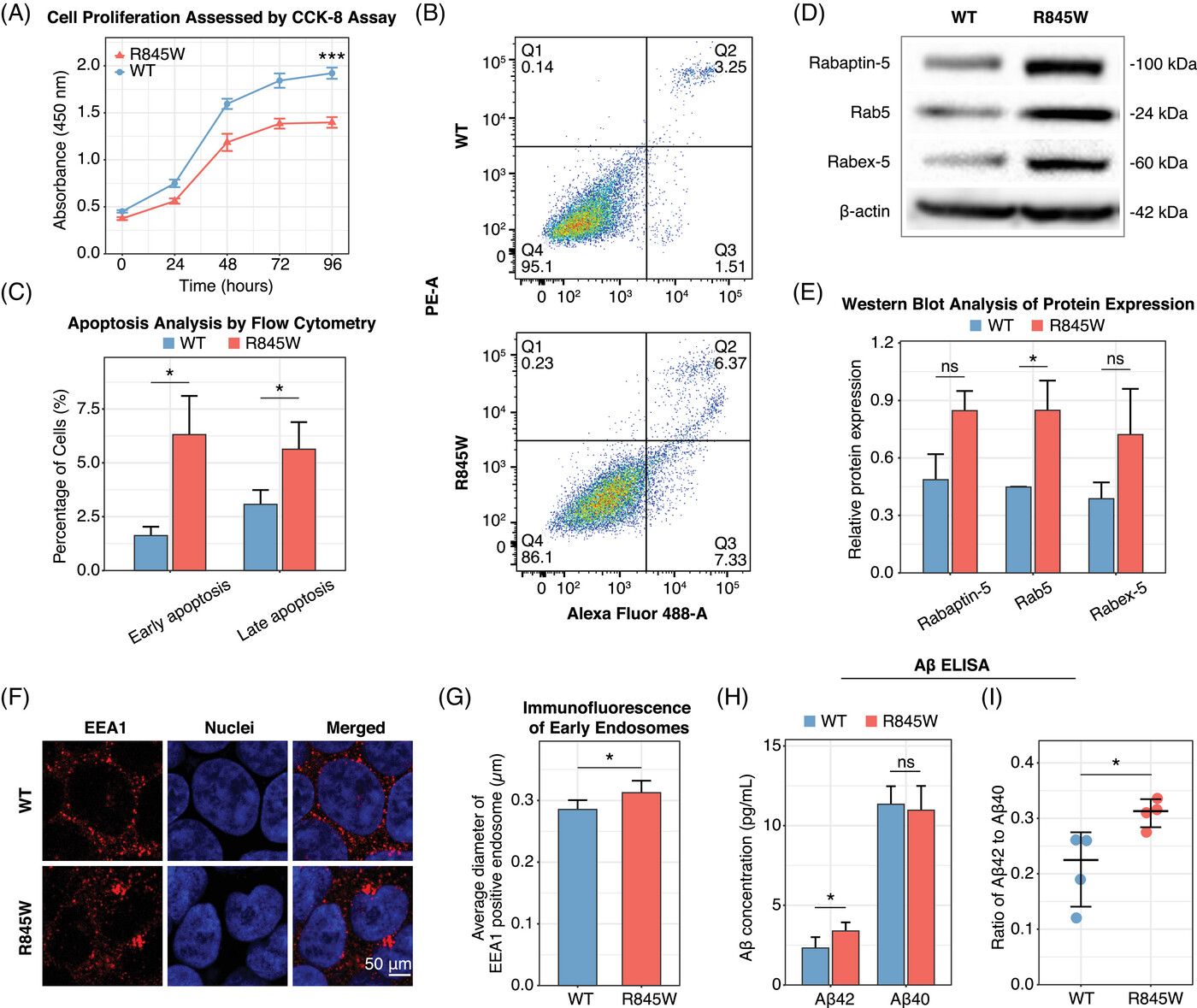
图 3 关键基因座RABEP1 p.R845W的体外实验验证
本研究强调了罕见大效应变异对阿尔茨海默症遗传机制的重要贡献,并通过对中国AD人群的深入分析,为AD的遗传研究提供了新见解,也为未来的治疗策略提供了潜在新靶点。
复旦大学类脑智能科学与技术研究院博士生曹际新、复旦大学脑科学转化研究院博士生张成为本文共同第一作者。复旦大学类脑智能科学与技术研究院赵兴明教授、陈靖祺副研究员,以及复旦大学脑科学转化研究院程田林研究员为本文通讯作者。该论文受到国家重点研发计划、国家自然科学基金委、上海市科技委员会、上海市科技重大专项、临港实验室等经费资助。