脊髓损伤(Spinal cord injury,SCI)堪称 “神经修复领域的顽固难题”—— 一旦发生,往往引发瘫痪、感觉丧失等不可逆后遗症,让患者生活陷入困境!核心症结在于中枢神经系统再生能力极弱,且损伤后形成的抑制性微环境,会像 “无形屏障” 般阻碍神经轴突再生与功能重塑。因此,如何打造能替代受损神经组织、重建神经环路、唤醒肢体功能的新型治疗方案,成为全球科研团队争相攻克的核心目标!
2025年12月19日,复旦大学脑科学转化研究院邵志成团队联合空军军医大学武胜昔教授在国际著名期刊《Brain》上发表了题为“Transplantation of engineered spinal cord organoids restores functions after spinal cord injury”的研究论文,在该方向取得了重要突破。这项研究不仅首次证实了基于工程化材料支撑的脊髓类器官在修复完全性脊髓损伤中的可行性与有效性,也为未来开发用于临床的“人工脊髓组织”提供了关键理论基础与技术储备。同时,该研究所构建的具备复杂结构与功能的大型类器官模型,也为研究神经发育、脊髓疾病机制及药物筛选提供了重要的实验平台,推动了神经再生医学与类器官领域的发展。

该团队创新性地利用羧化纤维素纳米纤维(CCN)复合基质胶(Matrigel),构建了一种具有仿生血管网络结构的纳米支架系统。CCN-Matrigel仿生支架不仅能维持类器官的正常发育路径,还能显著提升其存活能力。支架结构大幅改善了类器官内部的营养物质交换效率,使细胞凋亡相关基因表达显著降低,有效避免了中心坏死现象(图1)。
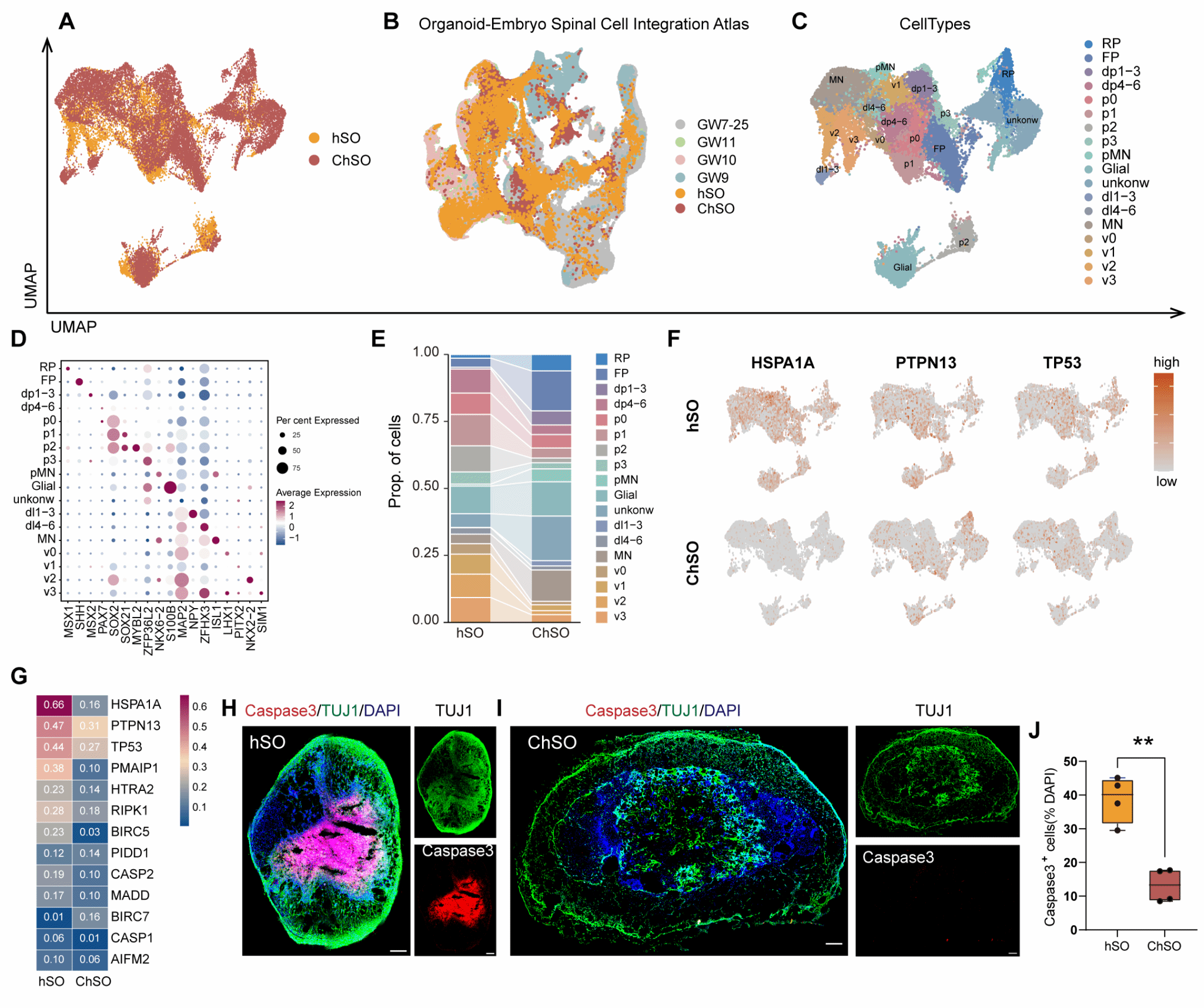
图1. CCN-Matrigel 支架在维持脊髓类器官层级分化的同时有效防止其中心坏死
长期培养的工程化脊髓类器官(ChSO)展现出惊人的结构成熟与功能整合能力。它们能自发延伸出定向排列的轴突束,并实现包裹轴突的髓鞘化,模拟了体内神经纤维的传导结构。在此基础上,这些类器官进一步形成具有同步化电活动的神经网络,表现出复杂的自发放电、突触传递甚至节律性振荡,成功重现了成熟脊髓组织的关键电生理功能,为研究神经环路发育和损伤修复提供了高度仿生的体外模型(图2)。
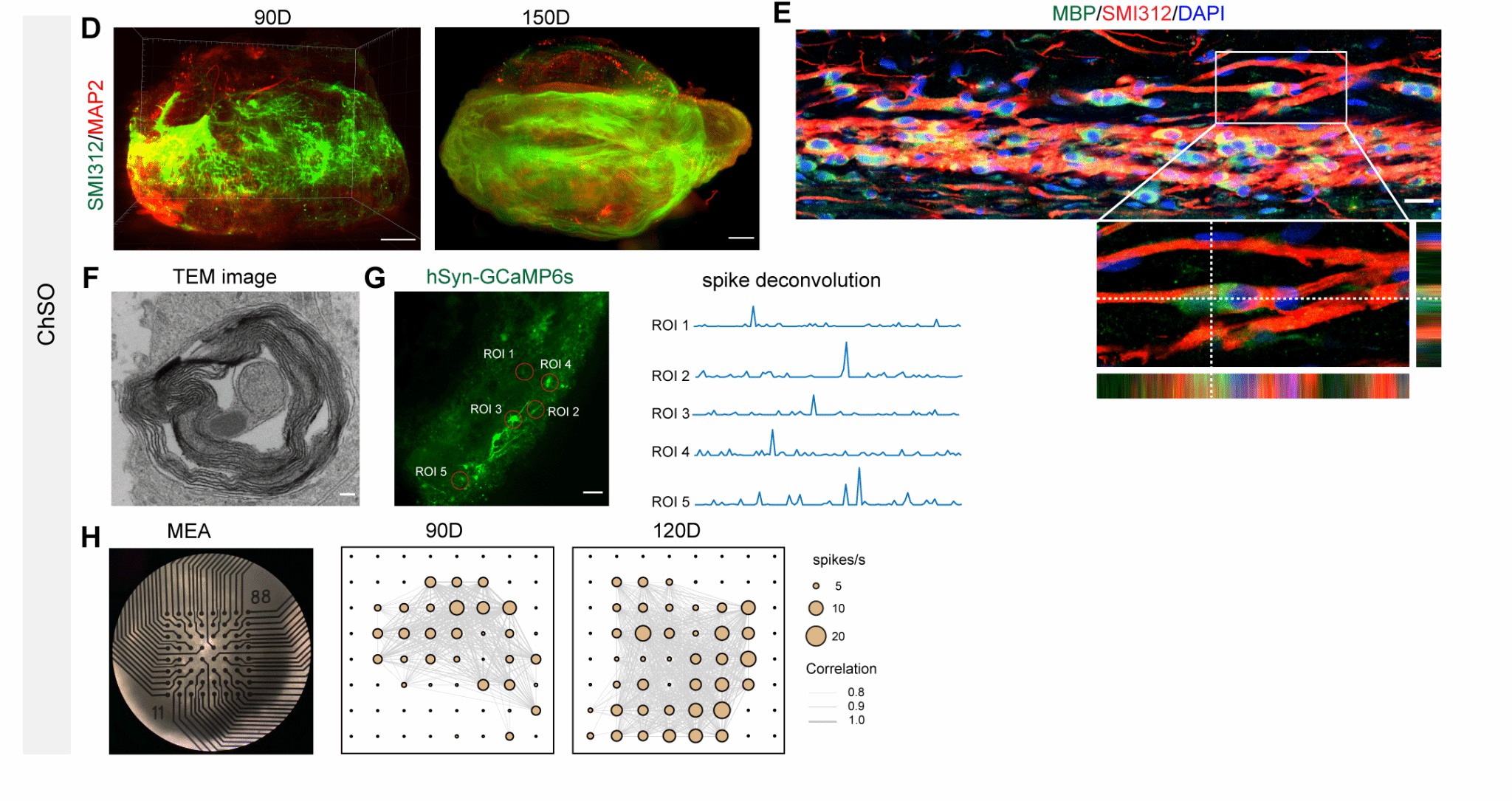
图2. 长期培养的工程化脊髓类器官展现出更成熟的神经元功能,并形成轴突束与髓鞘
研究团队进一步将培养成熟的工程化脊髓类器官(ChSOs)移植至完全性脊髓损伤的小鼠模型中。组织学分析表明,移植的ChSOs在损伤区域表现出优异的存活率与结构整合,它们不仅能够分化为包括运动神经元、兴奋性/抑制性中间神经元在内的多种具有明确背腹侧特性的脊髓神经元,还能产生星形胶质细胞与形成髓鞘的少突胶质细胞。这些结果证明了ChSOs在体内环境中保持了其多向分化的潜能,并能与宿主组织共同构成一个包含神经元与支持细胞的复杂神经微环境,为功能修复奠定了细胞基础(图3)。
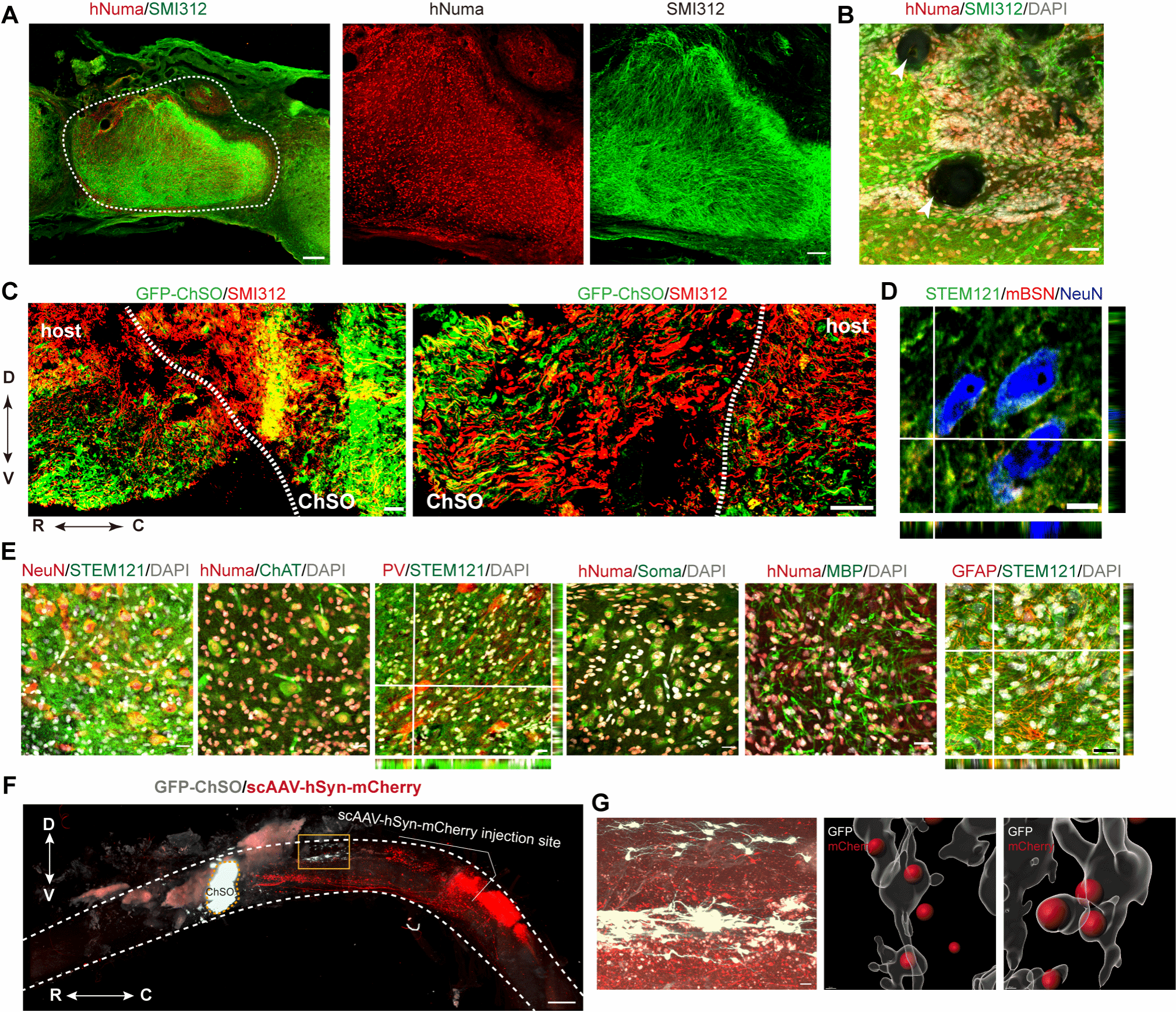
图3. 移植ChSOs在完全性SCI小鼠体内的存活与神经元分化
在为期12周的长期行为学评估中,接受ChSOs移植的小鼠表现出显著且持续的神经功能恢复。通过Basso Mouse Scale评分系统量化发现,小鼠后肢的运动功能评分持续提升,显著优于未移植或仅移植支架的对照组。触觉测试显示,移植组小鼠的足部缩回阈值显著降低,表明其感觉感知能力得到有效恢复。值得注意的是,部分小鼠甚至恢复了后肢的交替步态和支撑能力,体现出高级运动协调性的改善。这些行为学证据共同证实,移植的ChSOs能够促进完全性脊髓损伤后的感觉运动功能重建(图4)。
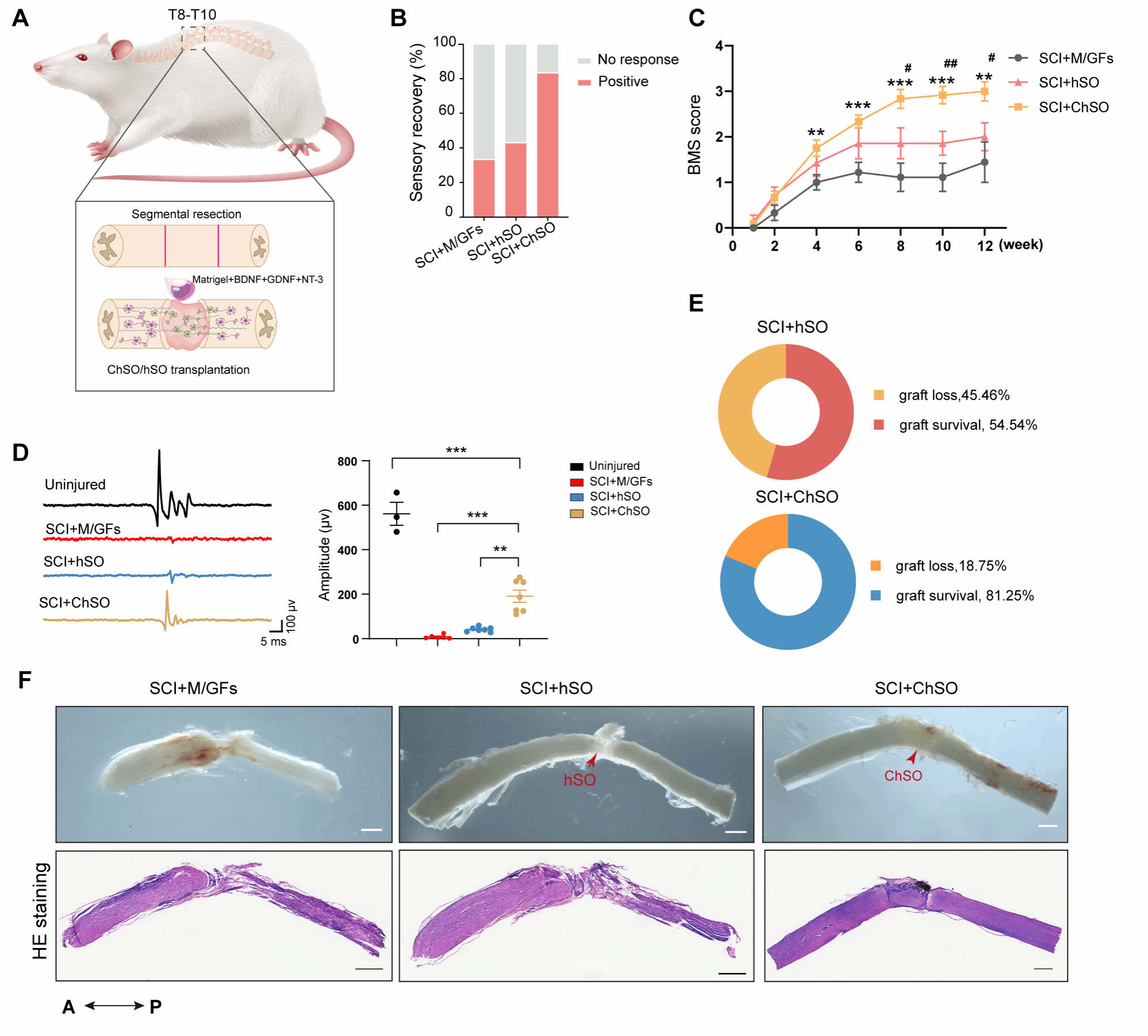
图4. 工程化脊髓类器官(ChSOs)与传统类器官(hSOs)在完全性SCI模型中的存活与功能恢复效果对比
综上所述,该团队成功构建的人源大尺度脊髓类器官,不仅为脊髓再生研究开辟了全新的治疗路径,也为脊髓相关疾病提供了高度适配、可转化性强的研究模型。这一突破性进展有力推动了类器官技术在中枢神经系统再生领域的发展与转化应用,为未来临床治疗策略的创新奠定了重要基础。
复旦大学脑科学转化研究院邵志成研究员与空军军医大学武胜昔教授为该论文的共同通讯作者,脑科学转化研究院博士后刘琳琳与副研究员薛伟伟为该论文的共同第一作者。该研究得到国家自然科学基金原创探索项目、国家重点研发计划以及长三角联合创新攻关等项目支持。
原文链接:https://academic.oup.com/brain/advance-article/doi/10.1093/brain/awaf471/8384044?login=true