2025年1月15日,复旦大学脑科学转化研究院李保宾课题组联合云南大学生命科学中心陈庆锋团队和法国蒙彼利埃大学 Jean-luc Battini 团队在 Nature Communications 杂志发表题为“ Structural basis of phosphate export by human XPR1 ”的研究论文,报道了人源磷酸盐(Pi)外排蛋白XPR1 两种构象下的高分辨冷冻电镜结构,并结合体外转运实验和计算生物学等手段,揭示了XPR1 向细胞外转运Pi的结构基础,为未来进一步深入的机制研究和靶向该蛋白的药物开发奠定了基础。
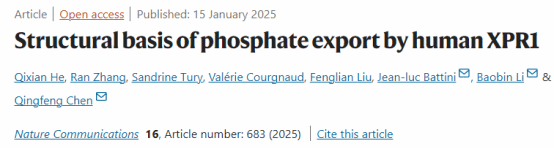
磷在各种生物体内都是必不可少的,对维持生命活动至关重要。在细胞水平上,Pi的摄取与外排是由特定的转运蛋白来介导的,它们协同作用来维持细胞内的Pi平衡;细胞内Pi浓度失衡可引起一系列人类疾病,比如佝偻病、心血管疾病、骨软化症等。在脊椎动物中,SLC20 和 SLC34 等蛋白家族的成员负责将Pi摄入细胞内。相比之下,参与细胞 Pi 外排的蛋白则知之甚少,XPR1 及其同源蛋白是目前唯一被报道参与 Pi 外排的蛋白。XPR1 功能异常与家族性脑钙化(PFBC)、血栓等疾病相关,同时 XPR1 还可作为舌鳞状细胞癌的诊断标志物。XPR1由一个具有多个跨膜螺旋的跨膜结构域和一个位于胞质内的SPX结构域。有研究表明, SPX 结构域能够感知细胞内肌醇焦磷酸(PP-InsP)水平,从而调节细胞对Pi的摄取、储存和利用。除了单独SPX结构域的晶体结构外,此前关于XPR1的结构信息仍较少。同时,XPR1 是否为Pi外排蛋白以及其如何外排Pi,仍然悬而未决。
该研究解析了人源XPR1野生型(XPR1WT) 和PP-InsP结合位点突变体(XPR13mut) 的冷冻电镜结构,揭示了其同源二聚体的整体构架。这些结构的跨膜结构域(transmembrane domain,TMD)分辨率较高,而SPX结构域则因其内在柔性而几乎完全不可见。在TMD中,每个单体有10个跨膜螺旋(TMs),其中TM1、TM3-4组成支架结构域(scaffold domain),而(TM2、TM5-10)则组成核心结构域(core domain),后者在结构上与转运离子的视紫红素蛋白(rhodopsin)有着远缘同源。
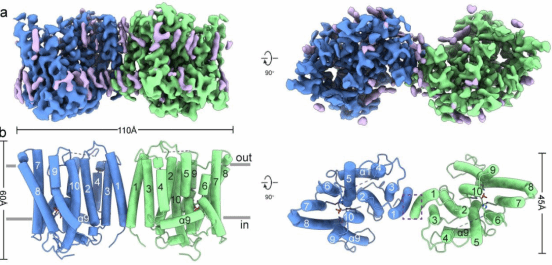
在核心结构域中,各TM围成一个桶状结构,在其内形成一个连续的离子转运通路。在离子转运通路的最窄处(通路中心靠近细胞内侧),形成了Pi的结合位点,从而将该通路分隔成胞内前庭(IV)和胞外前庭(EV)两部分。有研究表明,在PP-InsPs合成受阻的情况下,动物细胞中的 Pi 外排水平较低,表明 XPR1可能受PP-InsPs激活打开。与之相符的是,PP-InsP结合位点突变体XPR13mut 的EV处于闭合状态,而XPR1WT的EV则处于开放状态,主要是由TM9 和 W573 侧链的结构变化来引起的。这些结构研究的结果表明,XPR1的工作原理更接近于离子通道。
云南大学生命科学学院硕士研究生何其先、复旦大学脑科学转化研究院副研究员张然、蒙彼利埃传染病研究所Sandrine Tury为该论文的共同第一作者。云南大学陈庆锋教授、复旦大学脑科学转化研究院李保宾研究员和蒙彼利埃大学Jean-luc Battini教授为共同通讯作者。该研究工作得到了中国国家科技创新2030重大项目、国家自然科学基金、the Fondation pour la Recherche Médicale等基金项目的资助。
全文链接:https://www.nature.com/articles/s41467-025-55995-8