一种有效的药物必须在合理剂量和给药间隔下,对其靶点产生足够时长的抑制调节作用。药效动力学(Pharmacodynamic, PD)研究——即药物如何动态调控体内生化途径——对药物设计优化及临床应用至关重要。然而,传统动物模型的PD评估依赖组织解剖与生化分析,过程耗时费力。由于单只动物仅能提供单一时间点的单一药物数据,导致实验需消耗大量动物与候选药物,显著增加了研发成本。如果有一种更高效且成本更低的PD检测方法,能够在减少资源投入的同时精准解析药物动态效应,将大大加速先导化合物优化和候选药物筛选,具有重要价值。

2025年2月11日,美国斯坦福大学Michael Z. Lin教授与我院苏一驰青年研究员合作,在国际权威化学生物学期刊《Nature Chemical Biology》发表题为"Pharmacodynamics of Akt drugs revealed by a kinase-modulated bioluminescent indicator"的研究论文。该研究开发了一种非侵入性生物发光成像技术,实现活体动物中Akt靶向药物效应的动态可视化。研究团队基于ATP非依赖性萤光素酶NanoLuc,设计出基因编码的Akt激酶调控生物发光指示蛋白(KiMBI),其发光信号强度与Akt活性呈负相关。通过在活体小鼠肿瘤、大脑等靶组织内表达Akt KiMBI,并在给药后的多个时间点进行生物发光成像,成功构建了Akt药物作用的完整PD时间曲线。

利用该技术,研究团队揭示了多项关键发现:大脑中的KiMBI成像显示,临床候选药物ipatasertib能够穿过血脑屏障并抑制Akt活性;为了展示该“光学药效动力学”策略的优异性,研究人员在ipatasertib的基础上,进行单原子修饰设计并合成两种新型类似物,并借助KiMBI快速地完成候选药物的体外与活体表征,以极低的成本完成了 “结构-药效”的关系分析。其中,类似物ML-B01成功地抑制了大脑和身体中的Akt。而另一类似物则因细微结构差异导致脑部活性缺失,凸显分子修饰对PD特性的显著影响。
此外,研究团队发现靶向Akt的蛋白水解靶向嵌合体降解物(PROTACs)展示了非典型的PD。与传统非共价抑制剂相比,小分子降解剂表现出更持久的药效动力学。特别是,研究团队发现单剂量小分子Akt降解剂INY-05-040后,肿瘤中的Akt活性在体内被抑制了三天,揭示了Akt的持续降解可能允许极长的给药间隔。因此,Akt KiMBI的生物发光成像为活体动物中Akt抑制剂和降解剂的药效动力学提供了高效、非侵入性的体内可视化方法。
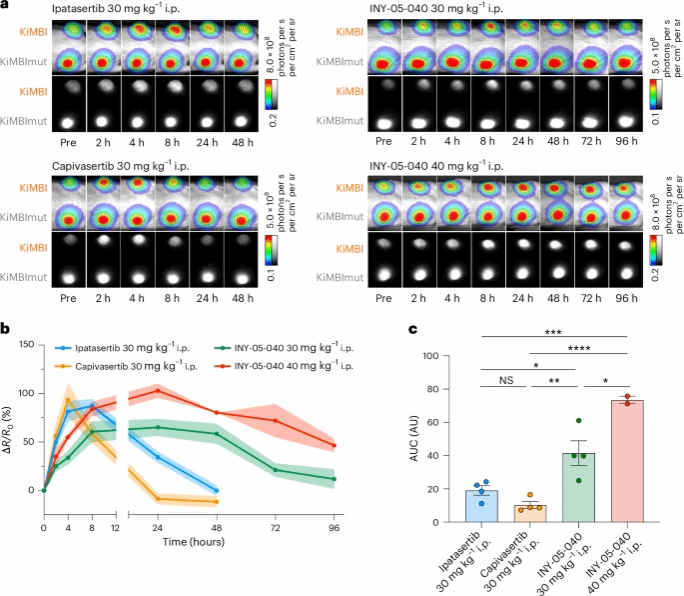
该研究建立的"光学药效动力学"策略展现出显著优势:纵向活体成像可获取至少8个时间点的动态数据,使单次实验药物用量减少了至少8倍;单只动物可同步评估至少6种药物效应,相当于动物使用量降低了至少48倍。相较于依赖解剖的传统终点检测,这种非侵入方法为药物研发提供了更高效、更经济的评估体系。此项研究不仅革新了药效动力学的评估范式,更通过分子探针与成像技术的深度融合,为药物研发提供了"所见即所得"的动态可视化工具。
论文链接:https://www.nature.com/articles/s41589-025-01846-y