以丘脑底核(Subthalamic nucleus, STN)为靶点的高频深部脑刺激(Deep brain stimulation, DBS)是一种治疗中晚期帕金森病(Parkinson's disease, PD)的有效手段。然而,DBS的具体作用机制是什么、为什么高频刺激才有疗效等关键科学问题尚未阐明。深入研究DBS的神经机制将为优化DBS刺激模式与参数、提升临床疗效提供重要理论依据。
2025年4月19日,复旦大学脑科学转化研究院舒友生课题组在国际学术期刊《Nature Communications》上发表了题为“Deep brain stimulation alleviates Parkinsonian motor deficits through desynchronizing GABA release in mice”的研究论文。该研究首次揭示了GABA递质的非同步化释放(Asynchronous release, AR)模式在高频DBS治疗中的关键作用,从细胞、突触及神经环路层面系统解析了STN-DBS的神经机制,为优化帕金森病临床治疗提供了新方向。

研究表明,帕金森病患者的丘脑底核常出现异常同步化的神经电活动,而通过植入电极进行高频脉冲电刺激(通常高于100 Hz)可显著抑制神经网络电活动的同步性,改善运动功能障碍。舒友生团队的前期研究发现,大脑皮层中特殊的突触传递模式AR具有对动作电位发放时间精确性的调控作用,即去同步化(Desynchronize)神经元电活动(Neuron 2020,Cerebral Cortex 2021)。基于AR强度与DBS疗效均呈现类似的频率依赖特征,即都需要高频刺激。因此,该团队提出科学假设:高频STN-DBS过程中可能导致神经递质的AR,去同步化PD病理条件下STN神经元的电活动与异常同步的网络活动,从而实现临床疗效。
在多巴胺耗竭的PD小鼠模型上,利用离体脑片电生理记录技术对STN神经元进行电活动检测,发现临床常用的130 Hz高频电刺激可显著诱发神经递质γ-氨基丁酸(GABA)和谷氨酸的强烈AR,初期短暂抑制STN神经元后,随即去同步化其电活动。相比之下,如果给予临床上无疗效且加重症状的20 Hz低频电刺激,仅检测到非常微弱的AR,且不影响STN神经元的电活动。进一步的药理学实验显示,STN-DBS的运动改善效应由GABA能抑制性突触传递所介导,表明GABA的释放在此过程中起到主导作用。
进一步结合在体电生理记录、光遗传学等技术,发现STN上游核团外侧苍白球(Globus pallidus externa, GPe)的GABA能抑制性突触输入在STN-DBS中至关重要。在STN进行的高频DBS通过诱导来源于GPe小清蛋白(PV)阳性神经元轴突上GABA的非同步化释放,去同步化STN神经元电活动,抑制局部场电位中的低频β振荡,从而缓解PD小鼠模型的运动功能障碍。但是,特异性激活非PV神经元轴突则不能起到类似的效应。结合特异性凋亡的实验进一步证明, PV神经元轴突的特异性激活是STN-DBS发挥疗效的充分和必要条件。
最后,团队通过特异性调控AR强度验证其在DBS疗效中的作用。在STN局部给予慢钙螯合剂EGTA-AM显著降低AR强度,阻断了高频STN-DBS的运动功能改善效果;而通过RNA干扰技术特异性敲降GPe中PV神经元的钙感受器蛋白Synaptotagmin-1的表达,可显著增强20 Hz低频刺激诱导的AR强度,使低频DBS也能改善运动功能。这些结果表明,AR强度是优化STN-DBS刺激模式和参数的重要生物标志物。该研究首次从突触释放模式——非同步化递质释放的新视角,阐释了高频DBS治疗帕金森病的细胞、突触和环路机制(图1),或将推动帕金森病治疗从经验性参数调整向基于AR生物标志物的精准神经调控范式的转变。
复旦大学脑科学转化研究院舒友生教授和中南大学生命科学学院邓穗馨助理教授为该论文的通讯作者。复旦大学脑科学转化研究院博士生徐宗艺为第一作者,博士生段威和苑书语做出了重要贡献。复旦大学华山医院郁金泰教授和王坚教授、复旦大学上海数学与交叉学科研究所尤翀副教授、中南大学生命科学学院李家大教授对该研究提供了大力支持和帮助。研究得到了国家自然科学基金(32130044,T2241002)、科技创新2030-重大项目(2021ZD0202500)、上海市优秀学术/技术带头人项目(21XD1400100)、湖南省自然科学基金(2025JJ40019)、长沙市自然科学基金(kq2502169)的资助。
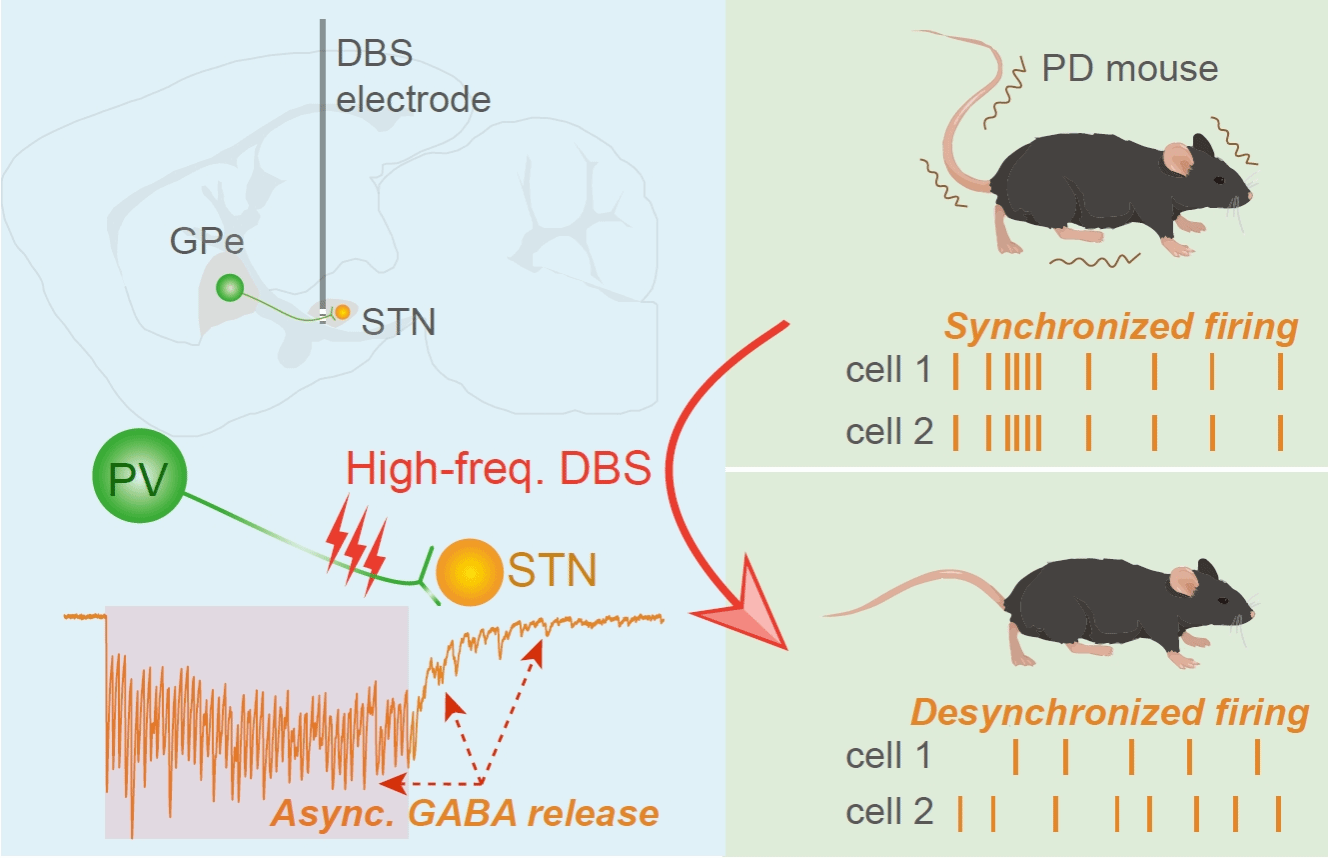
图 1:丘脑底核高频DBS治疗帕金森病的神经机制。高频电刺激导致PV神经元轴突上的GABA非同步化释放,从而去同步化STN神经元的电活动,实现对运动症状的治疗作用。