2025年4月30日,复旦大学脑科学转化研究院李保宾课题组联合中国药科大学理学院汪津课题组在 Nature Structural & Molecular Biology 杂志发表题为“ Gating mechanism of the two-pore-domain potassium channel THIK1”的研究论文,报道了双孔钾离子通道THIK1及其突变体的高分辨率冷冻电镜结构,并结合全细胞电生理实验和分子动力学模拟揭示了THIK1的离子运输机制和独特的门控机制,为开发靶向THIK1的调节剂奠定基础。

双孔钾离子通道THIK1主要分布于小胶质细胞表面,参与调控小胶质细胞免疫监视、形态分支、吞噬清除等生理功能。THIK1的失调或功能障碍与自闭症、多发性硬化症、阿尔茨海默病和其他神经发育疾病的发生关联密切,这使得THIK1成为神经疾病重要的治疗靶点。THIK1 的活性受多种调节因子调控,包括温度、多不饱和脂肪酸 (PUFA)、异氟烷、氟烷、G 蛋白等。探究 THIK1 的门控机制不仅对于阐明其生理功能至关重要,而且有助于发现靶向THIK1的调节剂,有望治疗与其相关的神经系统疾病。
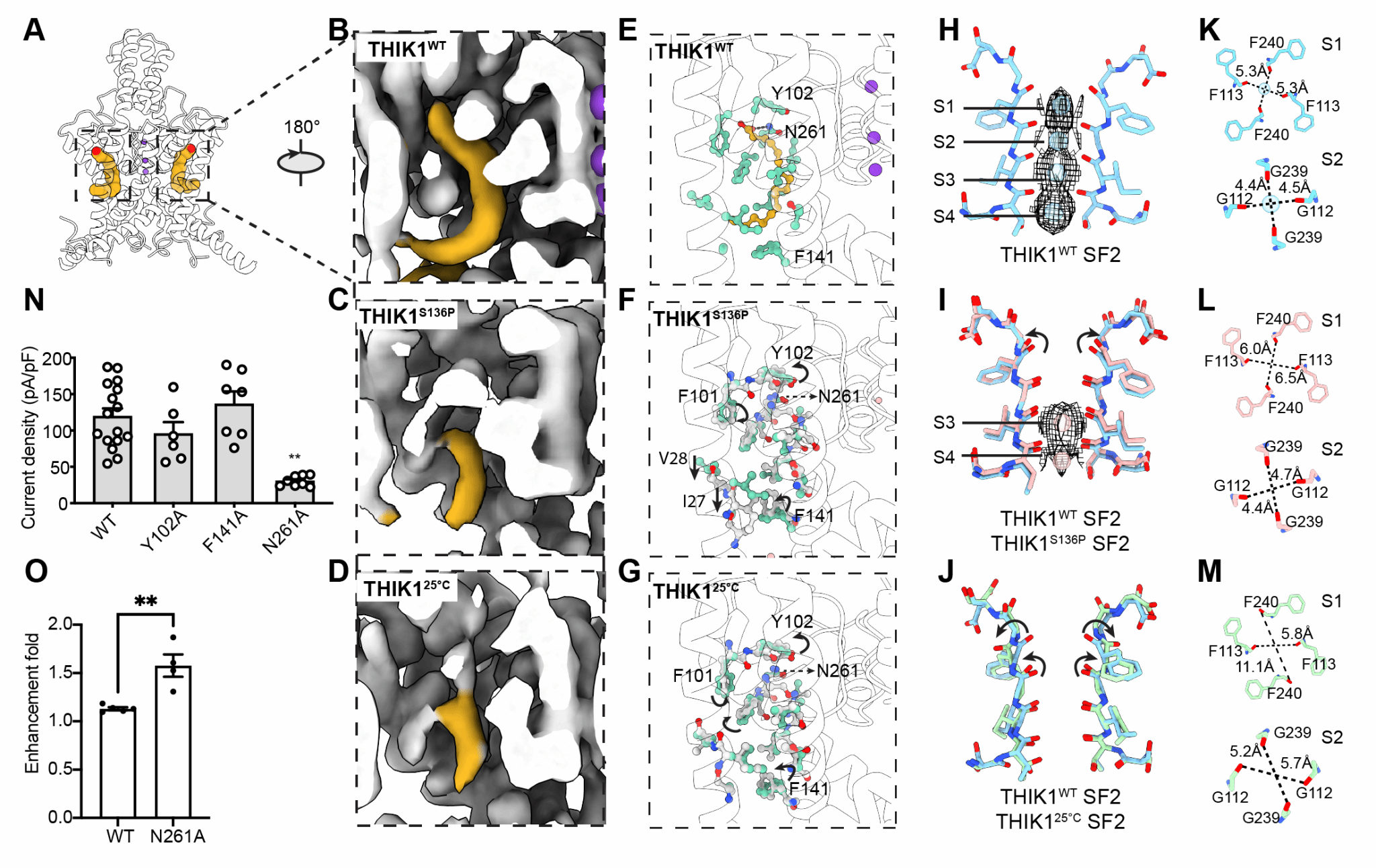
该研究解析了人源全长THIK1野生型(THIK1WT)和S136P(THIK1S136P)突变体的冷冻电镜结构,两个结构分辨率分别为2.7 Å和3.1 Å。THIK1具有K2P典型的结构特征,通道由两个亚基组成,每个亚基包含四个跨膜螺旋片段 (TM)和两个孔形成模序,其中孔形成模序构成K2P的钾离子选择性过滤器 (SF)。值得注意的是,THIK1展现出一系列不同于其他 K2P的结构特征与门控机制。THIK1内部存在两个控制钾离子运输的门控开关。其中一个开关位于选择性过滤器下方,由一对酪氨酸残基(Tyr273)构成,其空间位阻,限制了 SF 下方的钾离子传导通路。而在THIK1胞内前庭的下方,有一对C末端短螺旋封闭了胞内前庭的入口并阻碍了钾离子的传导。THIK1S136P的结构和电生理实验表明,THIK1的C末端可以直接作为胞内门响应各种生理刺激,可能涉及caspase 8的切割和G蛋白的调控。
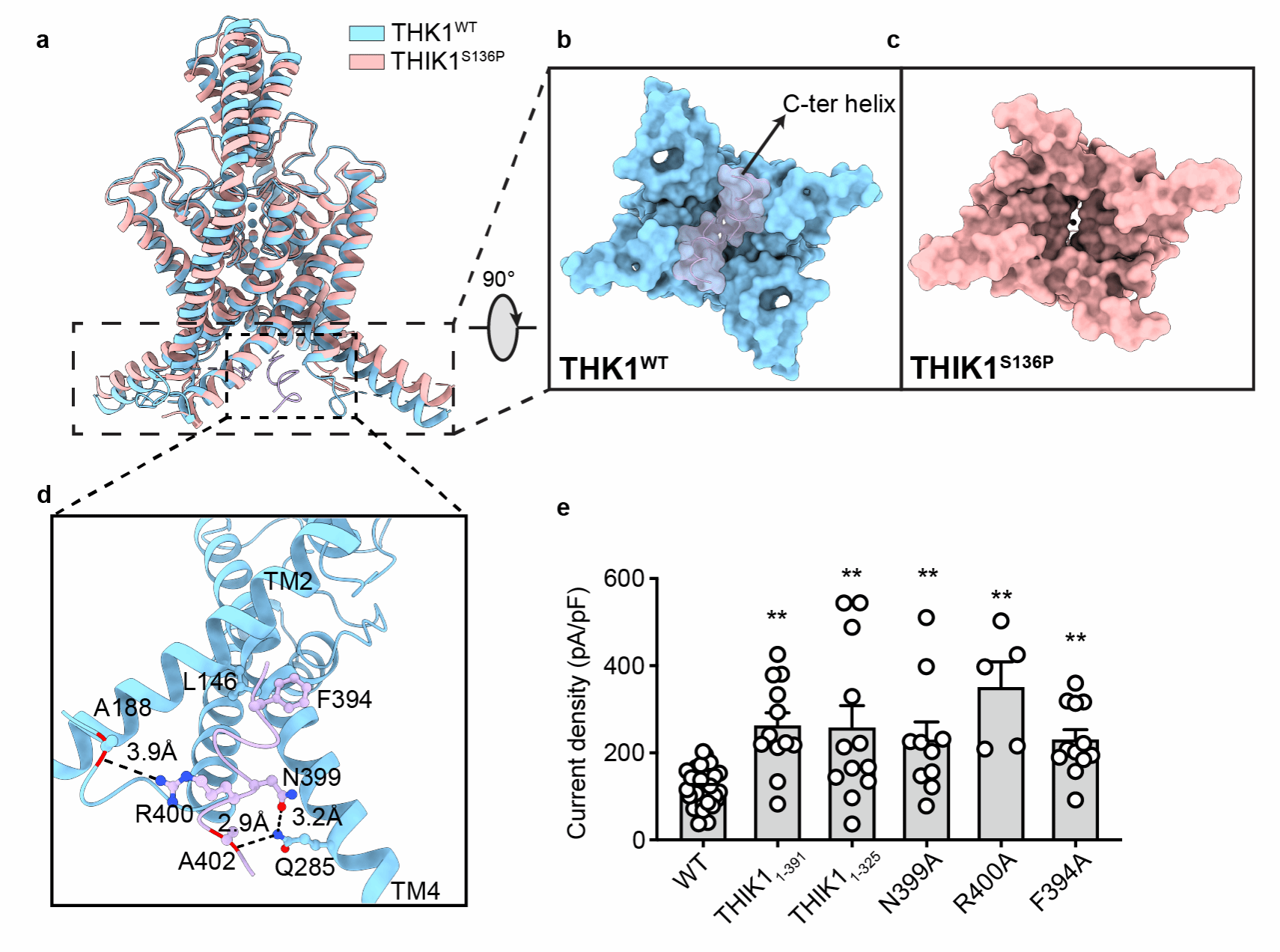
此外,研究还发现在两个亚基的SF1附近存在约20 Å长的疏水口袋,该口袋由一个亚基的TM2和TM4以及相邻亚基的TM1组成。一对不饱和脂肪酸(PUFA)占据该疏水口袋,口袋中结合的PUFA可以稳定SF并调控通道活性。
复旦大学脑科学转化研究院博士生方湘芸、中国药科大学理学院硕士生金海潮为该论文的共同第一作者。复旦大学脑科学转化研究院李保宾青年研究员、复旦大学脑科学转化研究院张然青年副研究员、中国药科大学理学院汪津研究员为共同通讯作者。该研究工作得到了科技创新2030—“脑科学与类脑研究”重大项目(青年)、国家自然科学基金等基金项目的资助。