六月上海悄然进入了阴雨连绵的梅雨季节,许多小伙伴起床后面对阴郁的天气心情不由得低沉下来,浑身说不出的难受,期待着大太阳的好天气赶快到来。连连下雨不仅仅是在生活上给我们带来不便,户外天气不同带来的光照强度变化也在神经调控的角度影响生物体的方方面面。

在哺乳动物中,外界光线对大脑功能的影响主要由特定的视觉环路介导。环境光照条件对生物体的各种生理功能有深远的影响,包括昼夜节律、情绪、认知、睡眠和感官知觉,这些广泛的影响起源于视网膜中一类特殊的感光细胞—内在感光神经节细胞(intrinsic photosensitive retinal ganglion cells, ipRGC)。视网膜作为视觉环路的起始点,其中的光敏细胞将光信号转化为生物电信号,并传递到不同的大脑区域。在哺乳动物视网膜中,有三种类型的光敏细胞:视杆细胞、视锥细胞和内在光敏视网膜神经节细胞。 其中ipRGC在于图像形成视觉无关的视觉环路中发挥保守且重要的作用,它们介导光对各种大脑功能的影响,如情绪、记忆、疼痛感知、睡眠、昼夜节律、大脑发育和新陈代谢。[1]
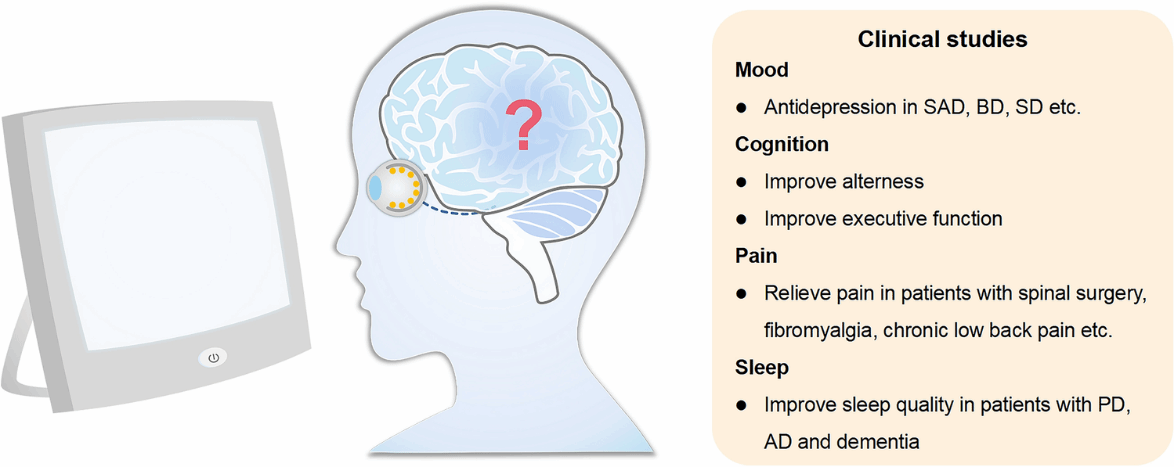
光照在调节情绪、认知、疼痛和睡眠方面的临床研究
近日,暨南大学的任超然研究员带领的团体在在Cell Reports杂志上发表了题名为A visual circuit related to the parabrachial nucleus for the antipruritic effects of bright light treatment的文章[2]。研究者发现小鼠中一条与臂旁核(PBN)相关的非成像视觉环路,可在强光治疗条件下起到止痒的作用,具体通过视网膜中一类内在感光神经节细胞,将强光信号上行传递以激活腹侧外侧膝状核和膝间小叶(vLGN/IGL)中的GABA能神经元,vLGN/IGL的GABA能神经元进而投射到外侧臂旁核(LPBN)抑制其中的兴奋性神经元发挥止痒功能。任超然团队发表的本篇文章和2022年其已发表在Neuron上的强光治疗通过影响PAG进而镇痛的文章[3]一同为我们介绍了光线对动物躯体感觉的影响,并且揭示强光治疗痛痒背后的神经环路机制,为未来针对躯体感觉异常的“光疗”奠定了基础。
任超然团队重点研究非成像视觉功能的神经机制,并探索靶向光信息传导系统改善神经系统疾病的新型物理干预策略,以期为临床疾病的治疗提供新视角。除上文提到的两篇与躯体感觉相关的文章外,该团队已经探究了强光治疗对改善压力下睡眠障碍、抗抑郁作用相关的神经环路基础。发现强光治疗通过激活vLGN/IGL-LHb-RMTg通路降低慢性应激的 NREM 睡眠促进作用[4];通过激活视网膜-vLGN/IGL-LHb 通路发挥抗抑郁作用[5]。下面让我们以这这篇专注在强光抑制瘙痒的文章为例,为大家介绍他们是如何发现光线对我们的潜在影响。
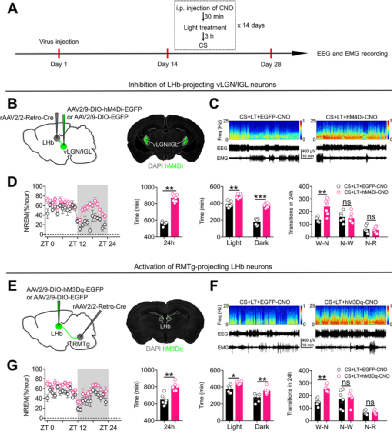
强光治疗通过激活vLGN/IGL-LHb-RMTg通路降低慢性应激的 NREM 睡眠促进作用
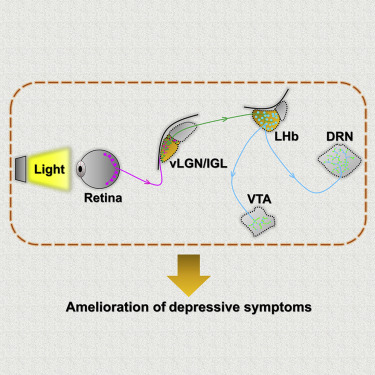
强光通过视网膜-vLGN/IGL-LHb 通路发挥抗抑郁作用
vLGN/IGL GABA能神经元通过直接投射抑制LPBN 谷氨酸能神经元
此前,vLGN/IGL 神经元已被证明可以投射到臂旁核[1]。而PBN是处理瘙痒相关信息的主要目标,并且在不同物种中高度保守。[6]作者采用了多种技术来研究vLGN/IGL-PBN通路的形态与功能特征:
首先通过将 AAV2/9-hSyn-ChR2-eYFP 注射到vLGN/IGL 中,诱导 vLGN/IGL 神经元中ChR2与黄色荧光蛋白 eYFP融合蛋白(ChR2-eYFP) 的表达(图1A),发现 vLGN/IGL 神经元可以向 LPBN 密集投射,但向 MPBN投射很弱(图 1A)。
接下来,作者探索了向LPBN投射的vLGN/IGL神经元的类型和分布模式。将rAAV2/2-Retro-Cre注射到LPB,随后,将编码 eYFP的 Cre 依赖性病毒AAV2/9-DIO-eYFP注入 vLGN/IGL,由此可以特异性标记向LPBN投射的vLGN/IGL神经元。进行免疫荧光染色发现这些神经元多是vLGN/IGL中的GABA能抑制性神经元(97.3%)。采用类似的策略,作者发现LPB中接受vLGN/IGL投射的神经元多是谷氨酸能兴奋性神经元(图1B).这些发现提供证据证明vLGN/IGL GABA能神经元的一个子集直接支配LPBN 谷氨酸能神经元。进一步的,作者以图1A的病毒策略在离体脑片上进行电生理记录,发现突触后IPSC强度远大于EPSC(图1C),进一步证明vLGN/IGL向LPB的投射的抑制性的。
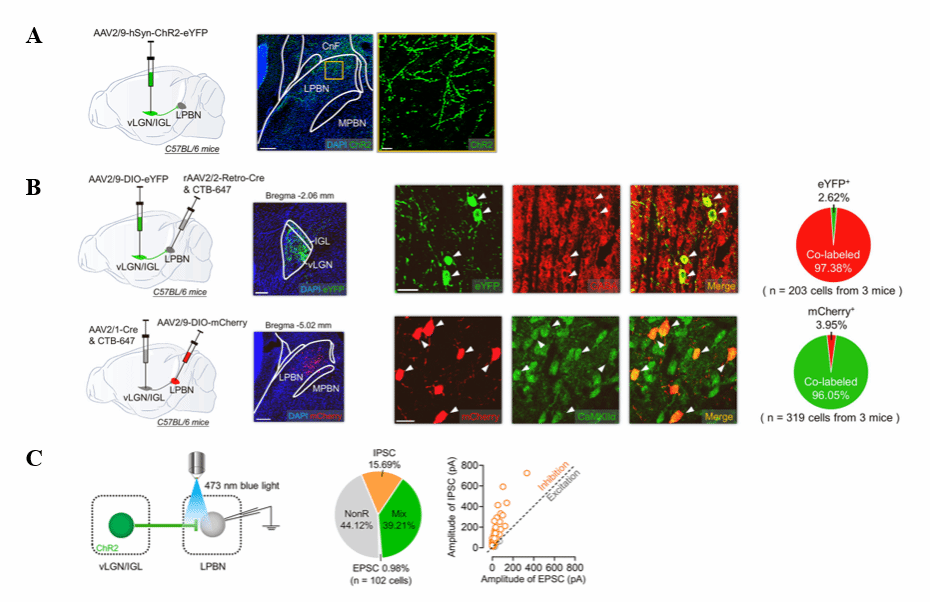
图1:vLGN/IGL-LPB神经元类型鉴定及投射类型
激活 vLGN/IGL-LPBN 通路可减弱LPBN神经元兴奋性进而缓解瘙痒相关行为
鉴于LPBN是脊髓产生的感觉信息的主要靶标,可以编码与瘙痒相关的信号,基于发现 vLGN/IGL 主要将抑制性输入传递到 LPBN,作者认为vLGN/IGL 神经元的激活可能会减弱瘙痒刺激诱导的 LPBN 突触后神经元的激活,并且进而减少瘙痒相关行为的发生。由此进行了进一步的实验:
作者将 AAV2/1-Cre 和AAV2/9-hSyn-hM3Dq-mCherry注射至 vLGN/IGL,AAV2/9-DIO-GCaMP7s注射在LPB,以实现在进行CNO给药的条件下激活vLGN/IGL向LPB的投射并光纤记录LPN中接受投射的兴奋性神经元的钙信号。对在给小鼠背部以组胺等化学致痒化合物的刺激后,可以发现使用CNO进行化学遗传激活的小鼠中LPB的钙信号显著减弱(图2A),表明vLGN/IGL神经元的激活可以抑制瘙痒原诱导的LPBN神经元的激活。
类似的,作者将AAV2/9-DIO-hM3Dq-mCherry注射至 vLGN/IGL,将rAAV2/2-Retro-Cre注射在LPB,以实现vLGN/IGL向LPB投射的特异性激活。
在给小鼠同样的化学瘙痒原并给予CNO进行化学激活后,观察到小鼠因瘙痒引起的抓挠行为的次数与持续时间均显著下降,并且在条件性厌恶实验中展现出对因瘙痒而引起的厌恶情绪的挽救(图2B),表明激活 vLGN/IGL-LPBN 通路可减少瘙痒原诱导的抓挠行为,并减轻与瘙痒相关的厌恶情绪体验。
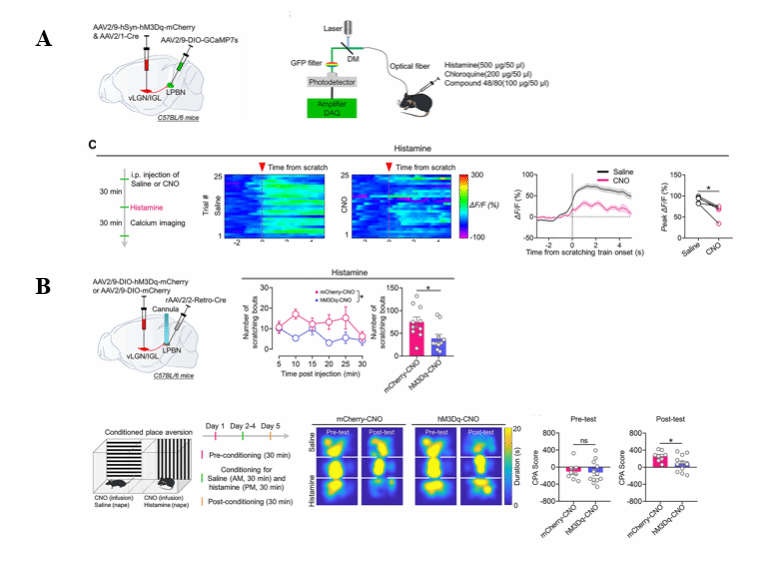
图2:激活vLGN/IGL-LPB可减弱LPBN神经元兴奋性进而缓解瘙痒相关行为
强光作用于视网膜中ipRGC并上行至vLGN/IGL-LPBN 通路缓解瘙痒相关行为
vLGN/IGL作为视觉信息的重要中继站,接收来自视网膜神经节细胞的直接投射。[1]为了研究视网膜神经节细胞是否直接支配vLGN/IGL-LPBN通路,以及这类细胞是否具有其特殊性。作者采用了一种基于狂犬病毒的逆行示踪方法,以图3A示方法分别在vLGN/IGL注射辅助病毒,在LPBN注射RV-DsRed,即可特异性感染vLGN/IGL-LPBN 通路中vLGN/IGL投射到LPBN的神经元,并且在其中复制可以跨单突触的狂犬病毒,进而感染视网膜投射的神经节细胞。通过免疫荧光染色和电生理记录获得这类视网膜神经节细胞的特性,发现其高表达SMI-32而低表达视黑蛋白,其发放类型符合“ON”型神经节细胞的特性,(图3A)综合以上结果作者认为这类神经节细胞属于ipRGCs的M4亚型。采用与上文类似的化学遗传策略激活投射到vLGN/IGL的这类ipRGCs也可产生减少瘙痒原诱导的抓挠行为,并减轻与瘙痒相关的厌恶情绪体验的效果。(图3B)

图3:视网膜中投射到vLGN/IGL的ipRGC的激活可抑制瘙痒
基于以上的结果,作者假设视网膜检测到的光增加可能会由于激活ipRGCs- vLGN/IGL通路进而抑制直接接收 vLGN/IGL 输入的 LPBN 神经元的活动,从而抑制与瘙痒相关的行为。为了验证这一假设,我们首先检查了暴露在强光下是
否能够抑制LPBN神经元的钙活动。作者采用如图4A的病毒策略,记录给强光是LPBN神经元钙活动的变化,结果显示强光显著降低了化学瘙痒源导致的LPBN神经元钙活动。(图4A)进一步作者观察强光下小鼠因化学瘙痒源引起的抓挠行为,以及进行条件性厌恶实验,发现强光可减少瘙痒原诱导的抓挠行为,并减轻与瘙痒相关的厌恶情绪体验。(图4B)
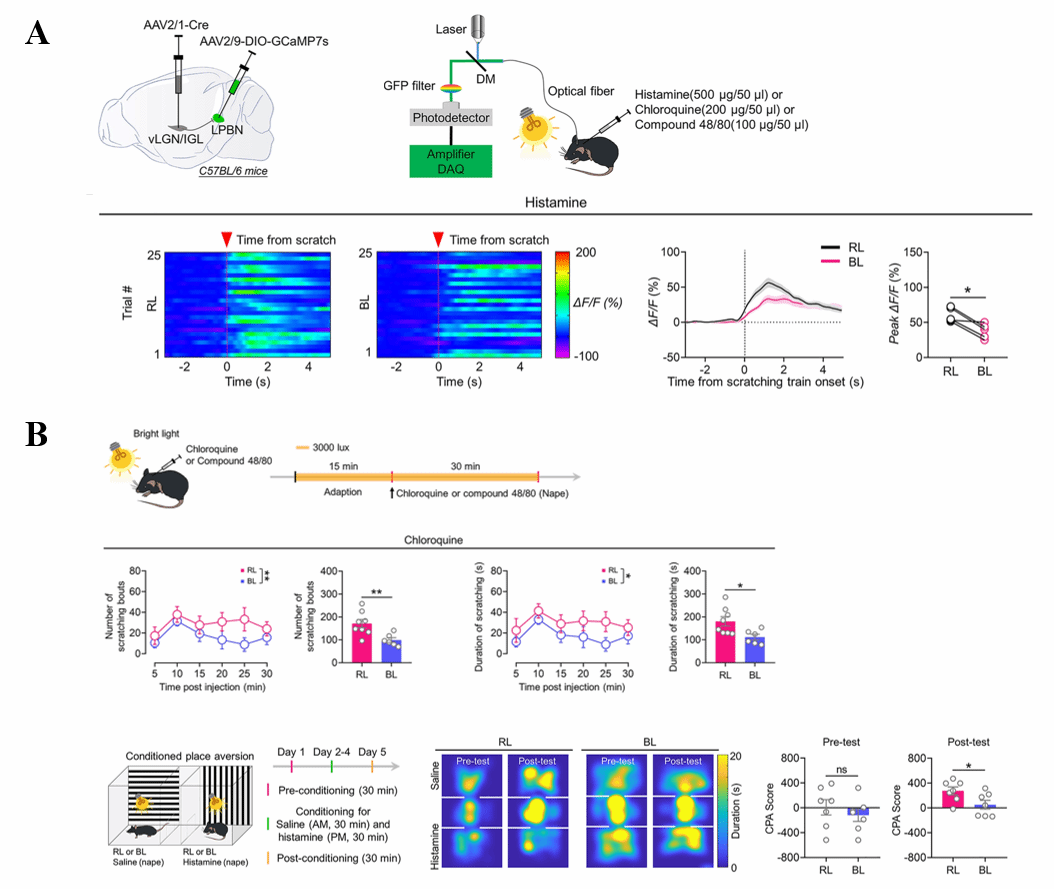
图4:强光可直接引起LPB神经元兴奋性减弱并具有止痒效果
激活ipRGCs-vLGN/IGL-LPBN 通路是强光的止痒作用所必需的
为了评估ipRGCs-vLGN/IGL-LPBN 通路在强光的止痒作用中的必要性,作者分别抑制ipRGCs-vLGN/IGL通路、vLGN/IGL-LPBN通路以确定强光能否在该通路抑制的情况下诱发止痒效果。首先作者在 vLGN/IGL 中双侧注射 rAAV2/2-Retro-Cre 和眼内注射 AAV2/2-hM4Di-mCherry 在vLGN/IGL 中特异性地引入 hM4Di 表达。在施加化学瘙痒源后进行化学遗传抑制并且给予强光,发现化学遗传抑制显著逆转了强光的止痒效果。(图5A)类似的,化学抑制vLGN/IGL-LPBN投射也显示出相同的逆转作用。(图5B)综上所述,ipRGCs-vLGN/IGL-LPBN 通路在介导强光的止痒作用中起着至关重要的作用。
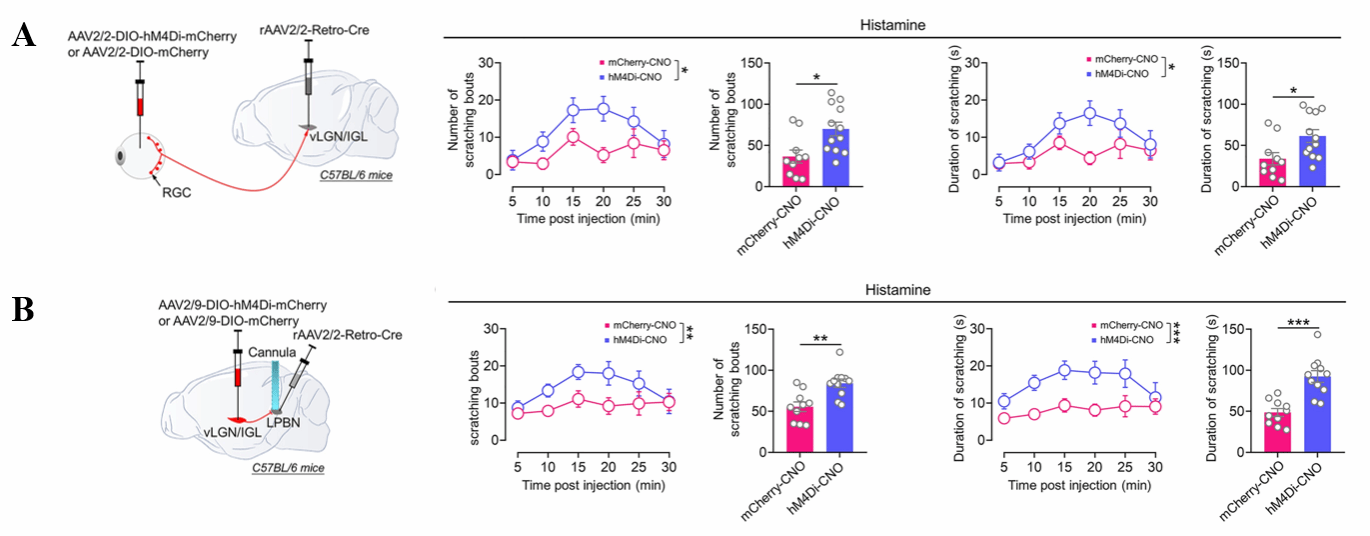
图5:抑制ipRGCs-vLGN/IGL-LPBN通路可直接阻断强光的止痒作用
总结
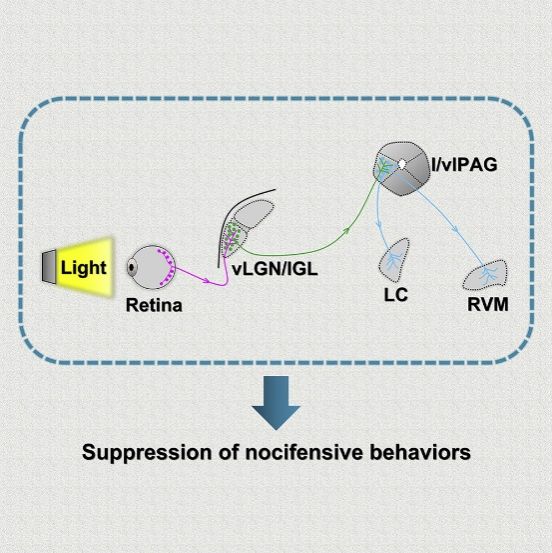
除了在成像中的作用外,光还具有非图像形成的视觉功能。尽管已有临床证据表明强光治疗具有止痒作用,但光对瘙痒相关行为影响的神经环路机制仍然知之甚少。在这项研究中,作者证明强光通过视网膜ipRGCs-vLGN/IGL-LPBN环路减少小鼠的瘙痒相关行为。具体来说,视网膜神经节细胞 (RGC) 的一个亚群支配腹侧外侧膝状核和膝间小叶(vLGN/IGL) 中的 GABA 能神经元,随后抑制外侧臂旁核(LPBN) 中的谷氨酸能神经元。重要的是,文章证明强光的止痒作用依赖于视网膜ipRGC -vLGN/IGL-LPBN 通路的激活,该环路是强光止痒作用的基础。
类似的,在前文提到作者的发现强光通过影响PAG进而镇痛的文章采用类似的研究方法中发现视网膜ipRGCs-vLGN/IGL-l/vlPAG通路是强光镇痛作用的环路基础。基于这些研究基础,期望在将来能够通过“光疗”缓解人们痛痒相关的不良体验。而结合其他文章不难看出,视网膜ipRGC -vLGN/IGL通路可能是强光治疗的对各种生理状态影响的起点,而其区别可能就在于光线激活的ipRGCs的类型以及更加细致的细胞亚分类的区别。若能更加细致的解析其中的奥秘相信会会更加发挥出其治疗的价值。总而言之,多多接受光照总是好处十足!看完这篇推送你是不是更想赶快结束这烦人的雨季,出门晒晒太阳了呢?

参考文献:
1.Huang X, Tao Q, Ren C. A Comprehensive Overview of the Neural Mechanisms of Light Therapy. Neurosci Bull. 2024;40(3):350-362. doi:10.1007/s12264-023-01089-8
2.Hu Z, Huang X, Liu J, et al. A visual circuit related to the parabrachial nucleus for the antipruritic effects of bright light treatment. Cell Rep. Published online June 11, 2024. doi:10.1016/j.celrep.2024.114356
3.Hu Z, Mu Y, Huang L, et al. A visual circuit related to the periaqueductal gray area for the antinociceptive effects of bright light treatment. Neuron. 2022;110(10):1712-1727.e7. doi:10.1016/j.neuron.2022.02.009
4.Huang L, Chen X, Tao Q, et al. Bright light treatment counteracts stress-induced sleep alterations in mice, via a visual circuit related to the rostromedial tegmental nucleus. PLoS Biol. 2023;21(9):e3002282. Published 2023 Sep 7. doi:10.1371/journal.pbio.3002282
5.Huang L, Xi Y, Peng Y, et al. A Visual Circuit Related to Habenula Underlies the Antidepressive Effects of Light Therapy. Neuron. 2019;102(1):128-142.e8. doi:10.1016/j.neuron.2019.01.037
6.Mu D, Deng J, Liu KF, et al. A central neural circuit for itch sensation. Science. 2017;357(6352):695-699. doi:10.1126/science.aaf4918
本文作者:邓娟组李翔宇