背景
当你在阳光明媚的一天出去游玩后,在你的脑海里留下不只有如画的春日美景(视觉信息),还有燕子往来梭巡的呢喃繁语(听觉信息)、春雨过后泥土的阵阵清香(嗅觉信息)、轻抚花朵的细腻柔软(触觉信息)等,这些来自不同感觉器官的特定信息汇合在一起,共同构成了一段完整的场景(context)记忆。其中,由不同感官分别获得的信息,是这段场景记忆的特定感官特征(feature),包括视觉特征、嗅觉特征、触觉特征、听觉特征等。一段时间后,每一种特定感官特征都能使你回想起这段美好的时光,说明不同的感官特征组合形成了大脑“联合表征”,即谓场景记忆的大脑代表区(representations)。目前认为,海马是将场景记忆编码为联合表征(多种感官特征的组合)并进行存储的脑区[1, 2],但对于特定感官特征的存储位置尚不清楚。
当你回想往事,这些不同的感官特征如同一块块记忆“拼图”,它们存放在何处?如何拼接为完整的记忆?
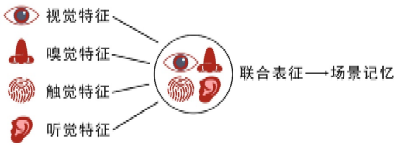
2022年7月13日,来自美国洛克菲勒大学的Priyamvada Rajasethupathy教授团队在Nature上发表的题为“Prefrontal feature representations drive memory recall”的研究论文提出,联合表征存储在海马CA1中,而构成场景记忆的特定感官特征,如视觉特征、听觉特征等,则存储在前额叶皮层的前扣带回(anterior cingulate, AC)[3]。该研究阐释了大脑中记忆处理的分布特征,为特定感官特征存储和提取的神经机制提供了全新见解。

结果
为探究场景记忆存储与提取的神经机制,研究人员开发了一种基于虚拟现实(virtual reality, VR)的记忆提取试验:小鼠重复体验不同场景,每种场景由多种感官特征如听觉、视觉、嗅觉、触觉等组成,在小鼠形成、存储和提取场景记忆时,对海马和大脑皮层进行实时可视化的检测和操纵。
此处有视频
小鼠通过接受训练,将四种感官特征(听觉、视觉、嗅觉、触觉)信息组成的场景与获得奖赏(给予蔗糖)、中性(给予水)或厌恶(给予水的同时喷气)体验联系起来,在训练之后,研究人员通过舔舐频率来评估小鼠的学习情况。与中性和厌恶场景相比,在奖赏场景下,小鼠舔舐的频率显著增加,提示小鼠成功形成了场景记忆。
在场景记忆提取测试中,小鼠被给予训练时场景的全部感官特征(听觉[A]、视觉[V]、嗅觉[O]和触觉[T])或部分感官特征组合(AT、AO、OT、AOT)。结果显示,小鼠可通过全部或部分感官特征组合来提取这一场景记忆。给予全部或部分感官特征组合,小鼠可以回忆起既往在特定场景中的经历,或开心地期待糖水,抑或注意令人讨厌的喷气(图1)。
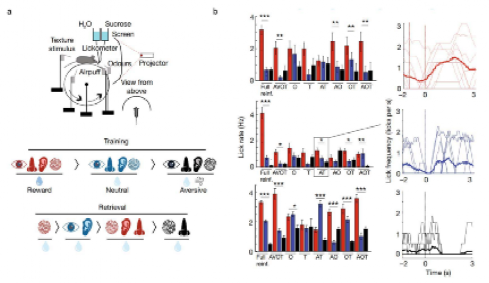
图1. 小鼠场景记忆训练和提取的行为范式。a.训练和提取范式。b.小鼠舔舐频率。
为评估海马是否编码联合表征、特定感官特征或两者兼有,研究人员给小鼠背侧CA1注射了基因编码的Ca2+探针(GCaMP6f,可用于监测神经元活动)并植入梯度折射率(GRIN)透镜,以便对训练和提取时同一视野进行双光子成像观察(图2)。
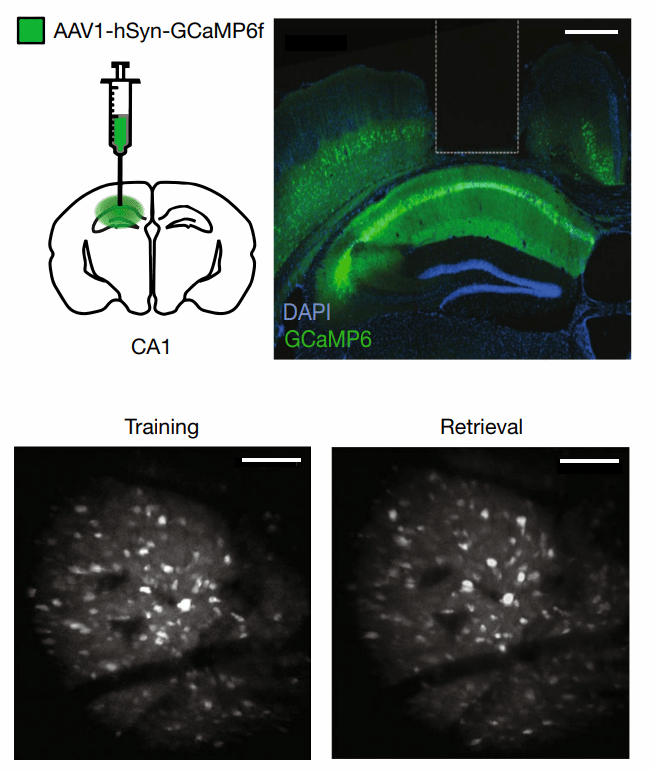
图2. 训练和提取时小鼠CA1同一视野的Ca2+活动监测
在训练过程中,约10%的神经元选择性响应奖赏性或厌恶性场景。在记忆提取过程中,研究人员再次观察到CA1神经元对全部或部分感官特征做出联合反应,但很少观察到选择性响应特定感官特征的神经元(图3),提示海马CA1中存储了场景记忆的联合表征,而缺乏特定感官特征的存储。
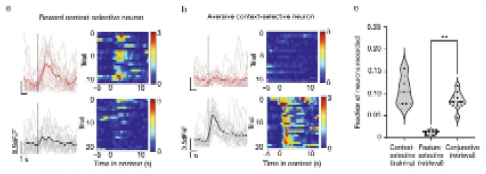
图3. 海马存储联合表征而非特定感官特征。选择性响应奖赏性场景(a)和厌恶性场景的神经元(b)在奖赏和厌恶场景记忆提取中的反应。(c)记忆提取过程不同类型神经元激活的比例。
这就提出了两个问题:(1)特定的感官特征在哪里存储?(2)它们如何与海马中联合表征相互作用并驱动回忆?
对于第一个问题,因为海马内环路通过CA3存储并提取联合表征而非特定感官特征,因此研究人员猜测,存在海马外的大脑环路为CA1提供特定感官特征记忆的输入。通过逆向示踪,研究人员确定了两个向背侧海马发出投射的主要脑区:前额叶皮层的前扣带区(anterior cingulate, AC)和内嗅皮层的外侧区(lateral entorhinal cortex, LEC)。过去研究表明,这两个脑区都在记忆提取中发挥重要作用[4]。
为了评估AC和LEC在场景记忆中对海马CA1神经元的作用,研究人员在小鼠基于特定感官特征的记忆提取过程中,通过表达抑制性视蛋白st-GtACR2来抑制AC或LEC神经元活动,同时监测CA1神经元活动。结果显示,抑制LEC导致CA1神经元的广泛抑制,而抑制AC导致CA1场景选择性神经元的特异性抑制,对非场景选择性神经元的抑制可忽略不计(图4)。
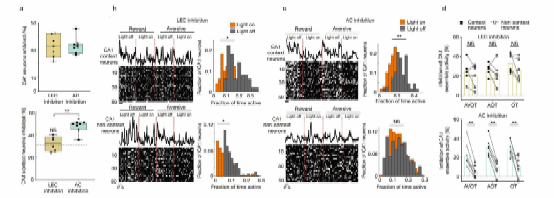
图4. AC导致海马CA1场景选择性神经元的特异性抑制。a. 抑制LEC和AC后CA1神经元(上)和CA1场景选择性神经元抑制比例(下)。b. LEC抑制前后海马CA1场景选择性神经元和非场景选择性神经元的响应(左)和比例(右)。c. AC抑制前后马CA1场景选择性神经元和非场景选择性神经元的反响应(左)和比例(右)。d. LEC抑制(上)和AC抑制(下)后场景选择性神经元和非场景选择性神经元在不同类型记忆提取试验中的激活比例。
行为学研究也证明,在AC抑制后,小鼠基于部分感官特征的记忆提取表现出显著缺陷,而LEC抑制后未出现这种现象(图5)。这些结果提示,AC向CA1发出的兴奋性投射在基于特定感官特征的场景记忆提取中发挥了重要作用。
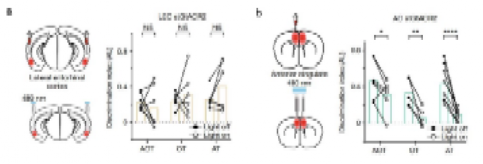
图5. AC在基于部分感官特征的记忆提取有重要作用。光遗传学抑制双侧LEC(a)或AC(b)前后小鼠在记忆提取过程中的行为学表现。
为了进一步确认AC是否编码并存储特定的感官特征,研究人员在训练和提取过程中对AC进行双光子成像。结果显示,在训练过程中,与海马CA1一致,AC神经元在单个神经元或群体水平都表现出场景选择性,但在提取过程中,AC神经元表现出与海马CA1不同的特点,即对特定感官特征的选择性和对多种感官特征组合的混合选择性(图6)。
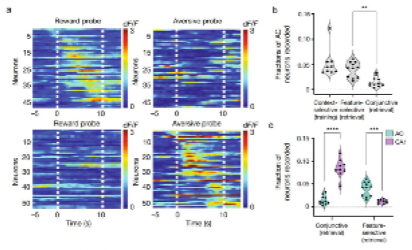
图6. AC神经元显示出感官特征选择性。a. 奖赏场景选择性神经元(上)和厌恶场景选择性神经元(下)在奖赏和厌恶探索实验中的反应。b. AC中场景选择性神经元(训练时)、特征选择性和联合反应性神经元(记忆提取时)激活的比例。c. AC和CA1中联合反应性和特征选择性神经元(记忆提取时)激活的比例。
为明确这些感官特征选择性神经元在记忆提取中的作用,研究人员利用了一种神经细胞群靶向重组(targeted recombination in active populations, TRAP)技术,标记了场景记忆提取阶段激活的神经元,使其选择性表达抑制性视蛋白st-GtACR,发现光遗传抑制这些特征选择性神经元(约占所有神经元的20%)导致基于特定感官特征的记忆提取缺陷,而第二天不进行光遗传学抑制可挽救该提取缺陷。相比之下,在记忆训练阶段光遗传抑制大小相似的随机神经元集群(占20%左右)不导致基于特定感官特征的提取缺陷,这些结果进一步证实了AC中感官特征选择性神经元在基于部分感官特征的场景记忆提取中的关键作用(图7)。
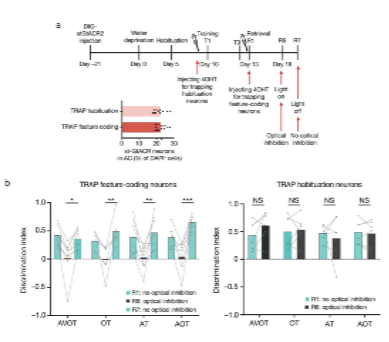
图7. AC感官特征选择性神经元在记忆提取中的作用。a. 利用TRAP技术抑制特征选择性神经元的实验范式和表达st-GtACR的AC神经元的百分比。b. TRAP小鼠在光遗传抑制特征选择性神经元前后的行为表现。
综上所述,该研究首次清晰地揭示了场景记忆在大脑中的存储规律,其中场景记忆的联合表征存储在海马CA1,而特定感官特征则存储在前额叶皮层AC。
AC特定感官特征编码使大脑可以识别更多感官细节,以便随后提取相关的场景记忆信息,这对于记忆提取的准确性具有重要意义[5, 6]。此外,对特定感官特征记忆进行单独存储,使大脑对场景记忆进行更新、修改或调整特定感官特征权重时,可以不影响海马中的原始记忆编码。
当你回想往事,存放在AC的一块块感官特征记忆“拼图”,在海马CA1拼接为完整的场景记忆。
参考文献
1. Wood, E.R., P.A. Dudchenko, and H. Eichenbaum, The global record of memory in hippocampal neuronal activity. Nature, 1999. 397(6720): p. 613-6.
2. O'Reilly, R.C. and J.W. Rudy, Conjunctive representations in learning and memory: principles of cortical and hippocampal function. Psychol Rev, 2001. 108(2): p. 311-45.
3. Yadav, N., et al., Prefrontal feature representations drive memory recall. Nature, 2022. 608(7921): p. 153-160.
4. Rajasethupathy, P., et al., Projections from neocortex mediate top-down control of memory retrieval. Nature, 2015. 526(7575): p. 653-9.
5. Eichenbaum, H., A.P. Yonelinas, and C. Ranganath, The medial temporal lobe and recognition memory. Annu Rev Neurosci, 2007. 30: p. 123-52.
6. Xu, W. and T.C. Sudhof, A neural circuit for memory specificity and generalization. Science, 2013. 339(6125): p. 1290-5.