介绍
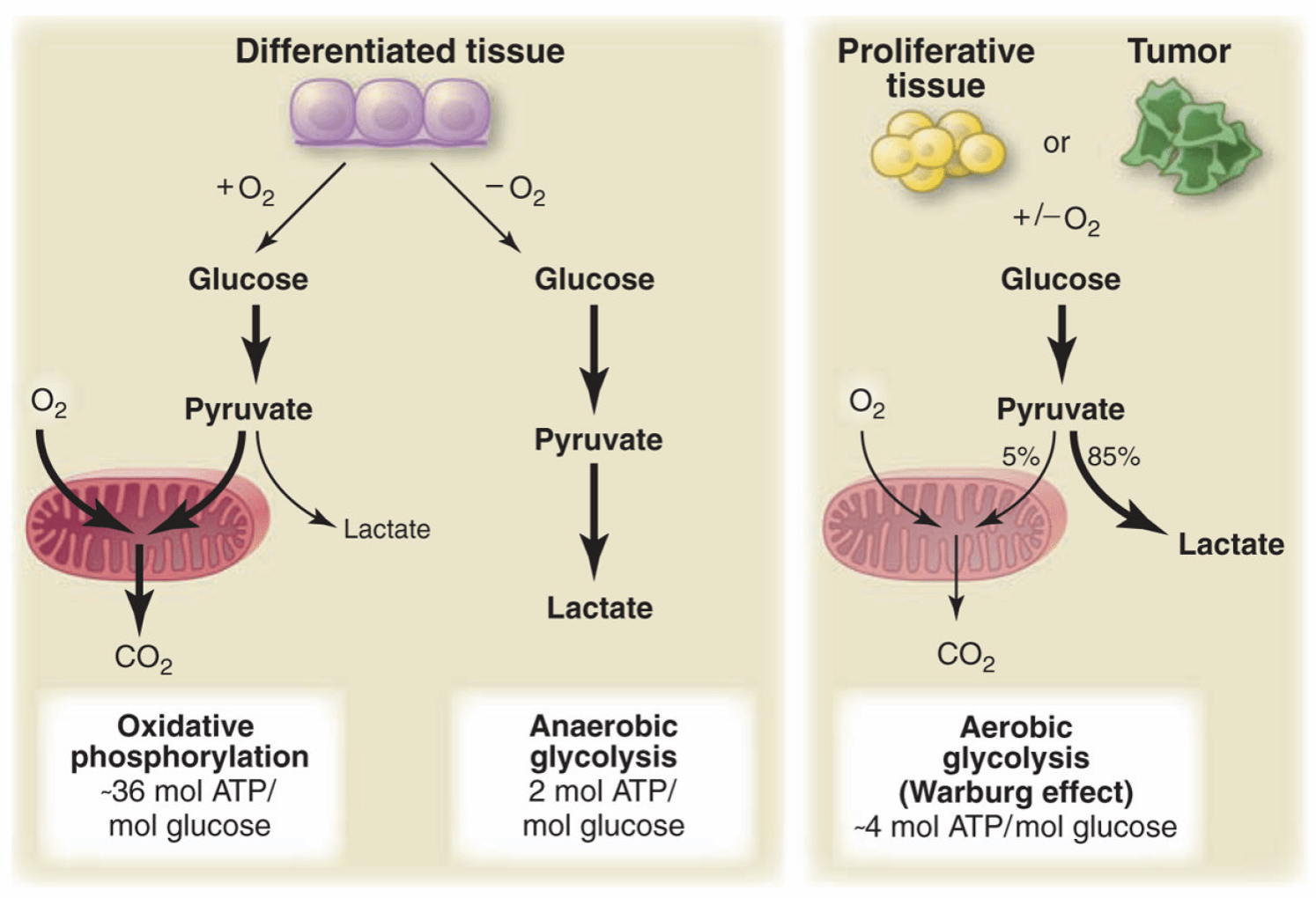
线粒体通过氧化磷酸化产生ATP,为细胞提供能量;除此之外细胞凋亡、炎症、细胞分化和自噬等过程也与线粒体有着紧密的联系。正常的组织在氧气存在的情况下,首先葡萄糖通过糖酵解代谢为丙酮酸,然后在线粒体中的大部分丙酮酸通过氧化磷酸化转变成二氧化碳;当氧气受限时,细胞可以通过厌氧糖酵解生成乳酸,产生的ATP最少。Warburg发现:不管是否有氧气存在,癌细胞倾向于将大部分葡萄糖转化为乳酸。这种有氧糖酵解一直被认为是癌细胞的主要能量途径,胶质母细胞瘤(GBM)亦是如此。然而,包括GBM在内的很多肿瘤都存在着很强的瘤内异质性,其所在的肿瘤微环境也多种多样。最近的研究表明,在复杂的肿瘤微环境中存在着多种代谢途径,其中线粒体呼吸也是细胞的代替能量途径之一,对于肿瘤的异质性、进展和转移发挥重要作用。
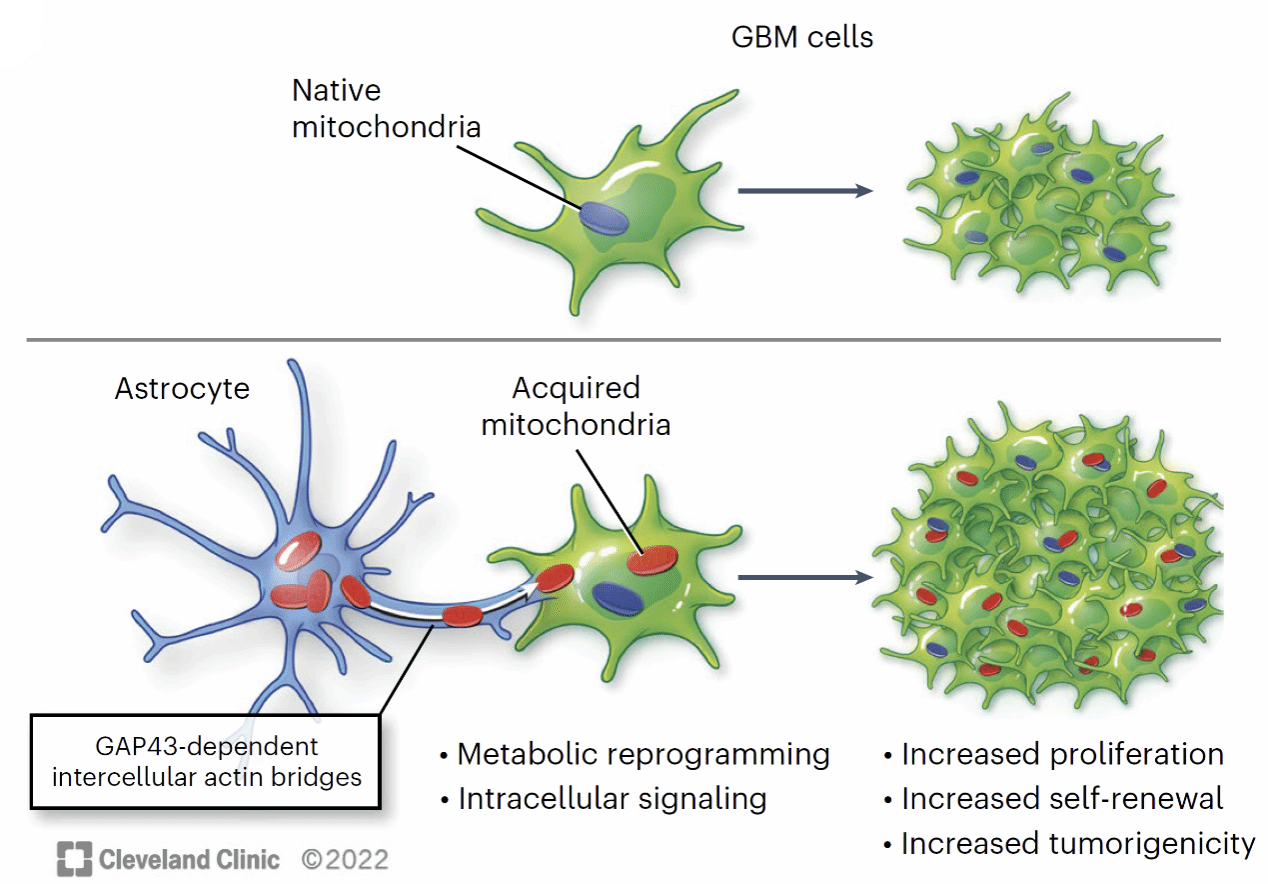
有趣的是,线粒体在细胞间还存在转移现象:早在2016年,Hayakawa等人就发现了线粒体可以通过细胞外囊泡从星形胶质细胞转移到神经元中;接下来的数年中,又有研究相继报道了线粒体通过隧道纳米管(Tunneling nanotubes,TNTs)的转移现象。那么问题来了,供体细胞送出的这份线粒体“大礼”能给受体细胞供给能量吗,这个过程能给受体细胞带来什么呢?2023年5月,来自美国克利夫兰诊所和勒那研究所的Dionysios C. Watson等人在Nature Cancer上发表了题目为GAP43-dependent mitochondria transfer from astrocytes enhances glioblastoma tumorigenicity的文章,他们发现GBM细胞经常从星形胶质细胞中获得线粒体,在接受了星形胶质细胞转移线粒体的GBM细胞中,ATP含量升高、谷氨酸盐等代谢物水平升高,这些改变可以保护恶性增殖的细胞免受氧化压力的损伤,使得GBM的致瘤性大大增强。
星形胶质细胞的线粒体转移依赖于肌动蛋白骨架的相互作用,而且在线粒体供体细胞和受体细胞的接触中,GAP43促进了线粒体的转移。GAP43是一种肌动蛋白相关蛋白,也是TNT的主要结构蛋白,是线粒体从星形胶质细胞转移到GBM细胞所必需的。在线粒体转移后的GBM细胞中,线粒体相关基因,特别是与电子传递和线粒体组装相关的基因显著上调,且这些受体GBM细胞的基础呼吸和最大呼吸速率也相应增加;此外,具有高线粒体转移的GBM细胞活力更强,具有更高致瘤性。
结果
1.GBM接受来自肿瘤微环境细胞中的线粒体
为了研究GBM微环境中的线粒体转移现象,作者首先构建了mKate2荧光蛋白和cytochrome c oxidase 8(定位在线粒体内膜)融合表达的小鼠(mito::mKate2),然后用稳定表达GFP的GBM细胞构建GBM原位小鼠模型(图1a),发现了GBM细胞可以接受来自宿主的线粒体(视频1);借助小麦胚芽凝集素(WGA)染色标记细胞表面,还发现这些转移的线粒体经常处于宿主-肿瘤细胞发生接触的位置(图1b-f)。除此之外,这些线粒体也会在GBM细胞之间转移。于是作者进一步使用小鼠GBM细胞和多种病人来源的胶质瘤干细胞,通过共培养的方法,发现提供线粒体的细胞主要是肿瘤微环境中的星形胶质细胞(图2a-d),并且在体内模型中观察到了肿瘤细胞(绿色标记部分)和星形胶质细胞(白色标记部分)紧密连接的线粒体转移区域(图2e)。
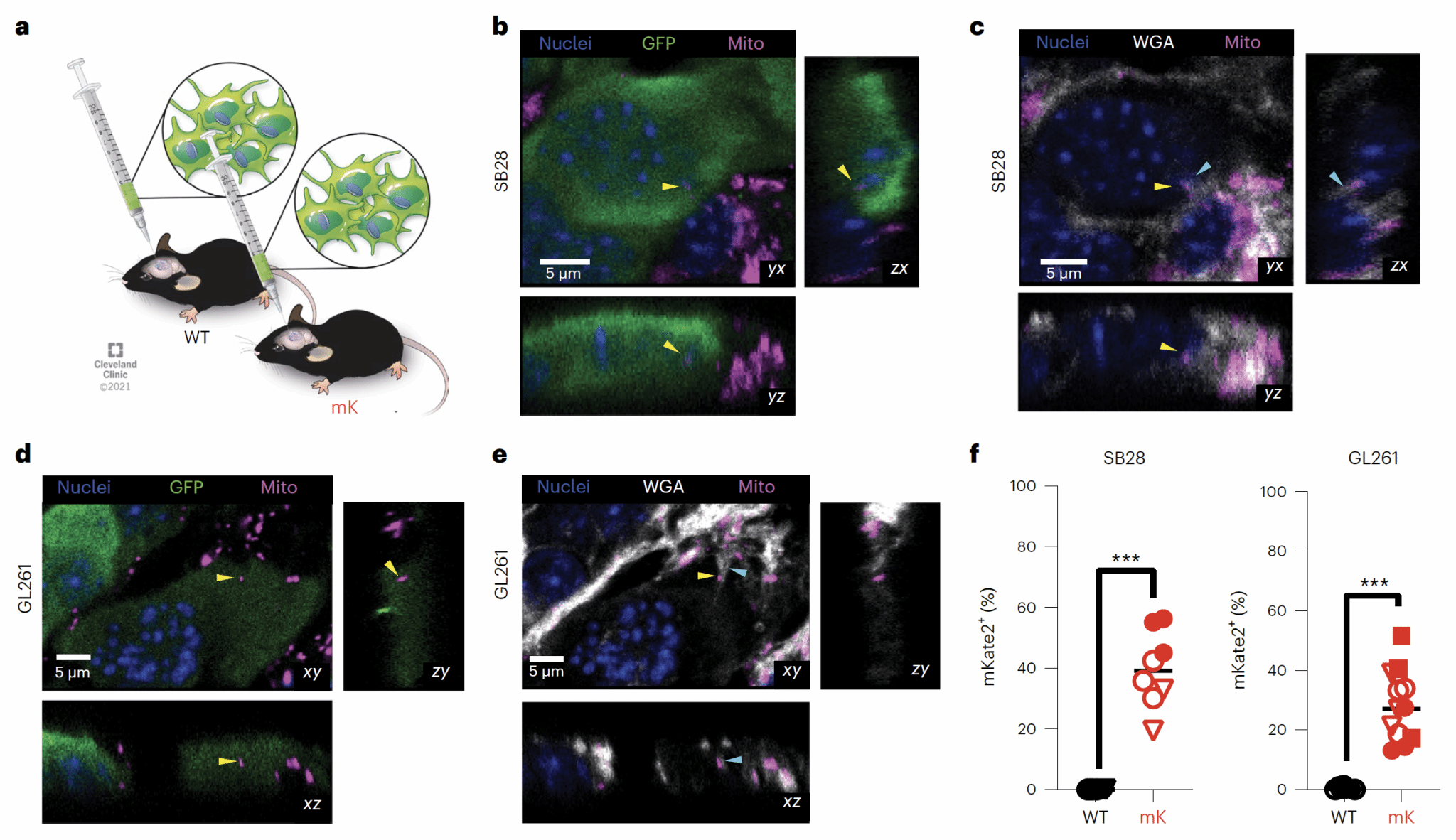
图1 GBM细胞从肿瘤微环境中获取线粒体
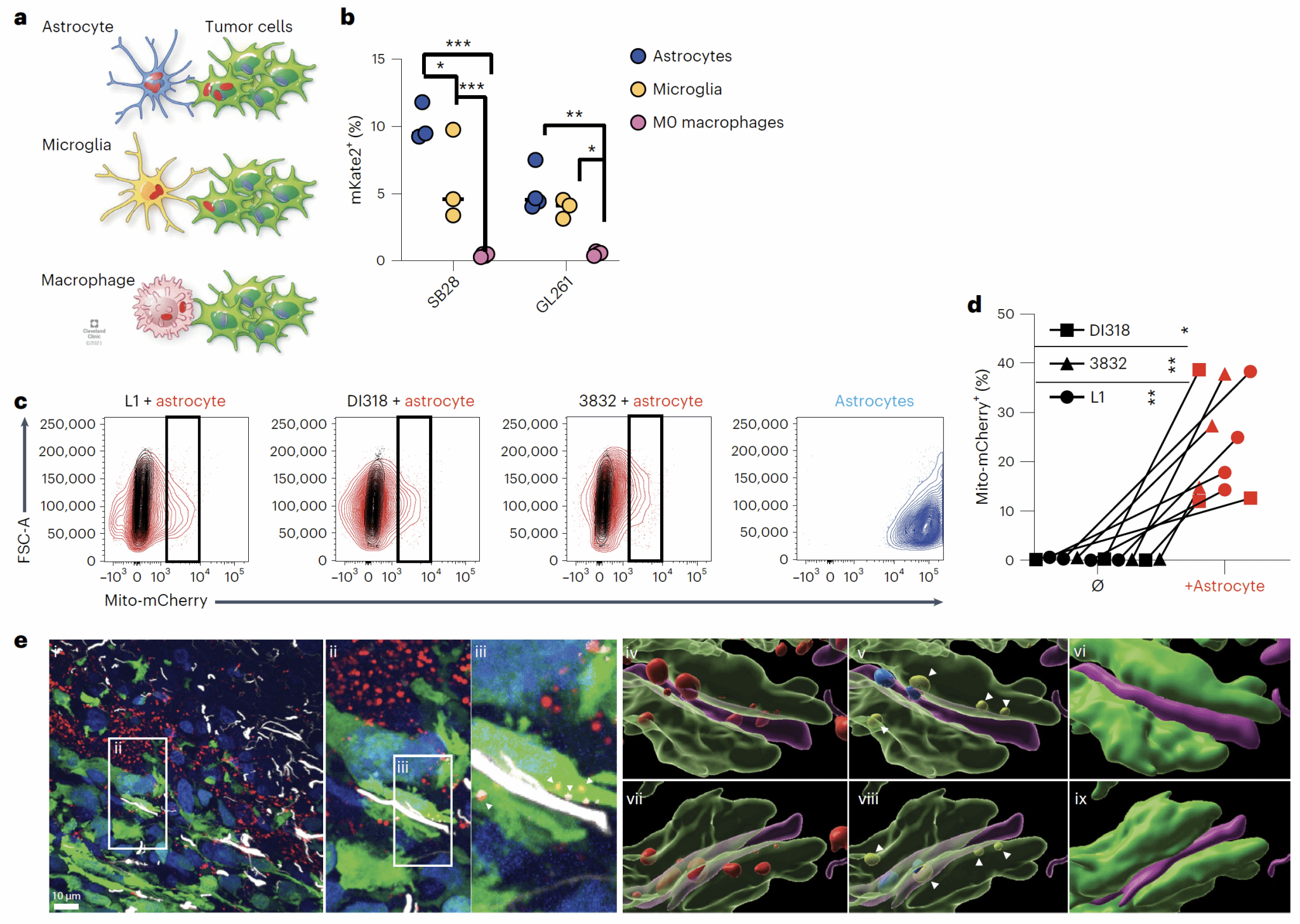
图2 GBM细胞从星形胶质细胞中获取线粒体
2.GAP43促进线粒体转移
一般认为线粒体的转移主要的方式是囊泡运输或直接接触,作者通过将星形胶质细胞和多个病人来源的GBM干细胞Transwell小室共培养或接触式共培养,发现它们之间的线粒体转移必须要通过直接接触来实现(图3a)。此外,转移中的线粒体还定位在两种细胞间的TNT内(图3b),用细胞松弛素B抑制肌动蛋白后,线粒体的转移明显减少(图3c)。于是作者结合之前的研究结果,发现了GAP43在星形胶质细胞和GBM细胞之间的线粒体转移中发挥重要的作用:GAP43定位于星形胶质细胞和GBM细胞之间的TNT上(图4a),且干扰GAP43表达后,TNT数量和线粒体转移现象明显减少(图4b-e)。
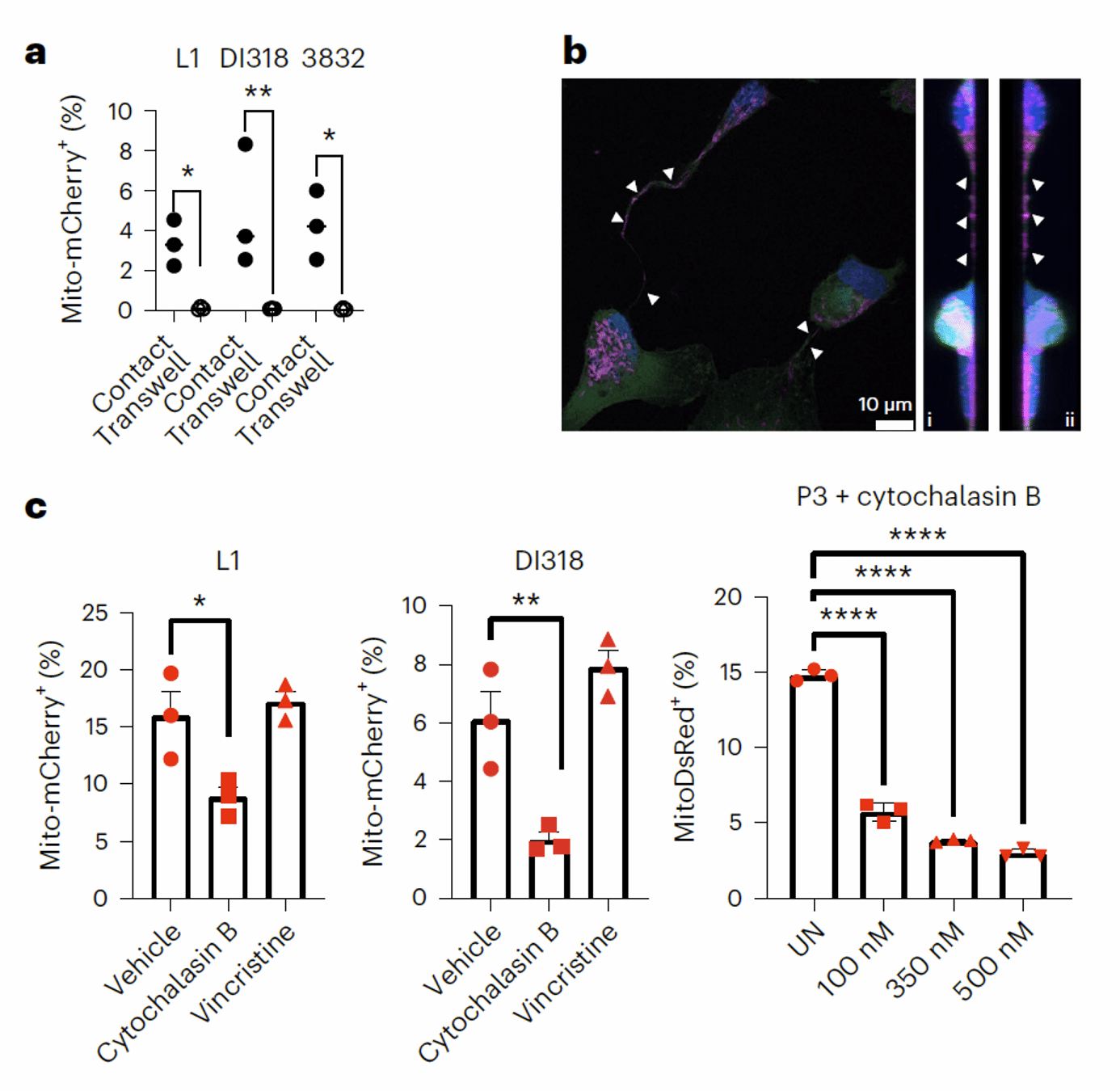
图3 星形胶质细胞通过细胞间的TNT将线粒体转移到GBM
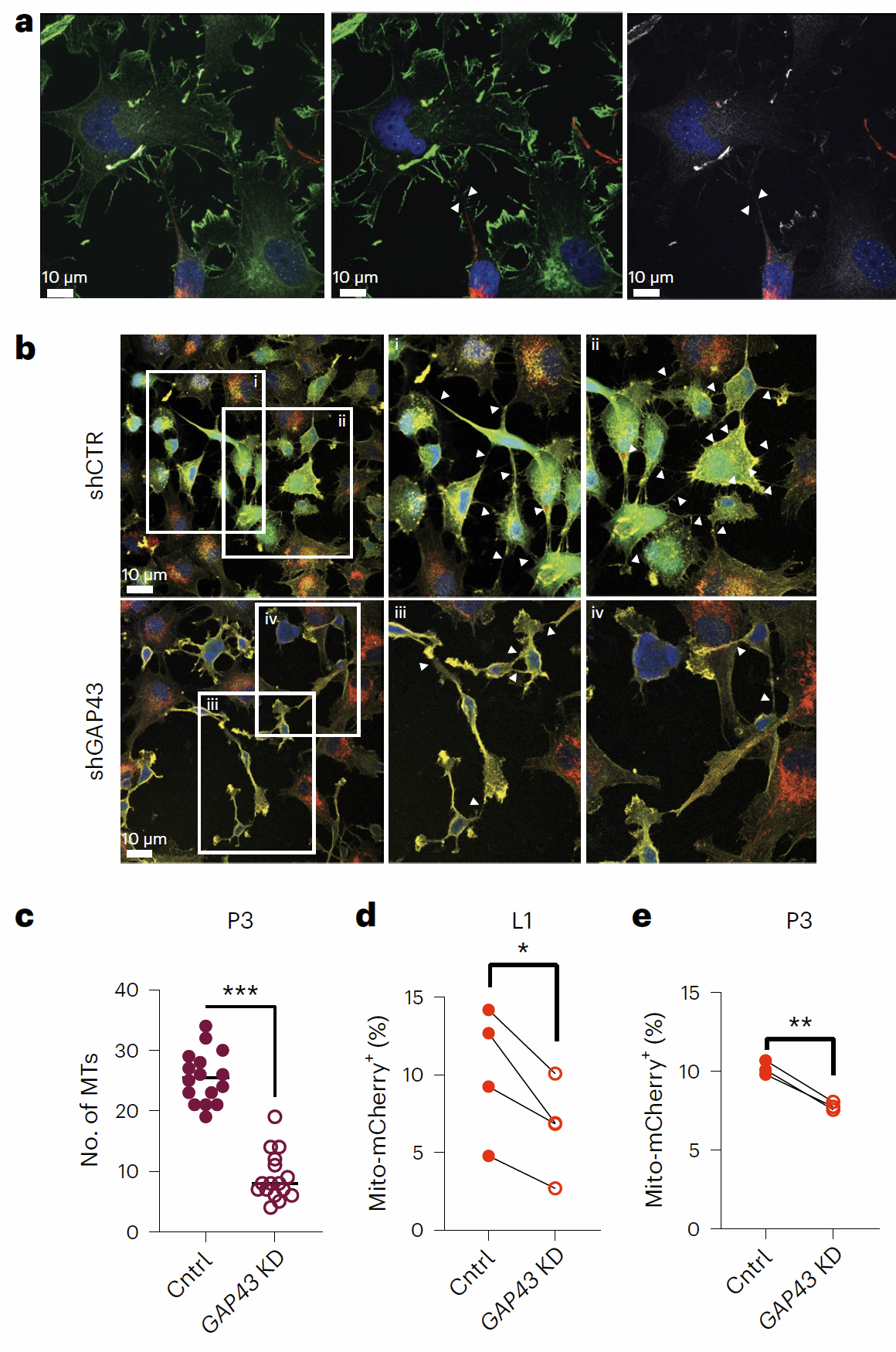
图4 GAP43通过星形胶质细胞-GBM细胞间的TNT促进线粒体转移
3.获得线粒体的GBM细胞发生代谢重编程
为了研究线粒体转移后对GBM的影响,作者首先使用海马代谢分析仪测定了接受了线粒体的细胞中能量代谢状况,发下接受了线粒体的细胞线粒体呼吸速率上升(图5a-b),细胞内ATP含量增多;然后作者进一步借助代谢组和磷酸化定量蛋白质组找到了包括谷氨酸、α-酮戊二酸和数种必需氨基酸等的多种关键差异代谢物和差异信号通路(图5c-e),且这些代谢物和通路都和GBM细胞抵抗氧化压力和恶性进展密切相关。最后,作者还在小鼠肿瘤模型中验证,相比于接受了线粒体的GBM模型,未接受线粒体的GBM小鼠模型有着更长的生存期。
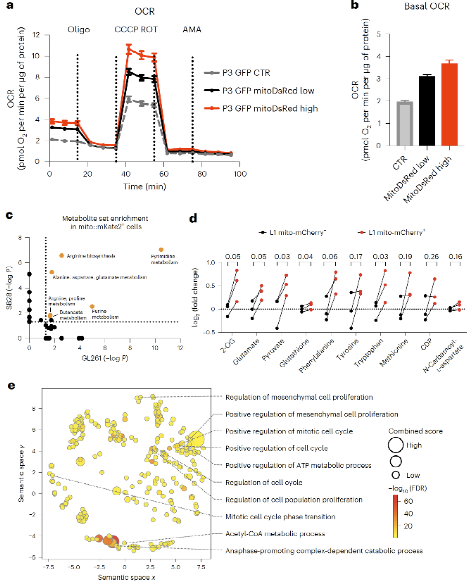
图5 线粒体转移在蛋白质和代谢组学水平上改变GBM代谢
结语
综上,该研究发现并揭示了GBM细胞接受来自肿瘤微环境的线粒体的过程,这份“礼物”使得GBM能更好的应对氧化压力,有更多的供能和更强的自我更新能力,最终使得GBM的恶性进展加快。这份来自肿瘤微环境中星形胶质细胞小小的“礼物”使得GBM内发生巨大的变化,从转录水平到蛋白质水平,最后到整个细胞的代谢变化,每一个环节都相互交织、环环相扣。全世界各个研究领域也正是在这一步一步的探索中不断前进的吧。
参考文献
1.Watson, Dionysios C et al. “GAP43-dependent mitochondria transfer from astrocytes enhances glioblastoma tumorigenicity.” Nature cancer vol. 4,5 (2023): 648-664. doi:10.1038/s43018-023-00556-5
2.Vander Heiden, Matthew G et al. “Understanding the Warburg effect: the metabolic requirements of cell proliferation.” Science vol. 324,5930 (2009): 1029-33. doi:10.1126/science.1160809
3.Hayakawa, Kazuhide et al. “Transfer of mitochondria from astrocytes to neurons after stroke.” Nature vol. 535,7613 (2016): 551-5. doi:10.1038/nature18928
4.Osswald, Matthias et al. “Brain tumour cells interconnect to a functional and resistant network.” Nature vol. 528,7580 (2015): 93-8. doi:10.1038/nature16071
本文作者:邱志欣组管益安