引言
在自然界中的大部分生物都会受到光照、温度、空间等环境的影响,为了逐渐适应周围环境的变化,大部分生物按照一定的周期性规律并且有序地进行生命活动,这种有节律性的生命活动现象被称为昼夜节律(Circadian rhythms),又被称为“生物钟”。 在细胞水平上,昼夜节律是生命适应外界环境周期变化而演化而来的内在计时机制,从而维持许多细胞活动 (如激素分泌、细胞增殖以及代谢活动),进而控制着人类以及大多数哺乳动物的体温、血压、激素以及代谢等节律1-3。在分子水平上,昼夜节律会受到昼夜节律基因调节,节律基因的振荡表达形成昼夜节律,其表达产物形成了一种复杂的转录翻译反馈环路 (transcription-translation feedback loops, TTFLs),从而通过下游一系列靶基因实现对细胞的生长、代谢、衰老、凋亡等生命活动的调控(Fig 1)2。TTFLs这一复杂环路主要发生在细胞核内,因此TTFLs中一个非常重要的过程就是核蛋白向细胞核内的运输。
Timeless(Tim)是细胞核定位蛋白,主要在细胞核内发挥维持DNA复制和DNA修复过程中基因组的稳定性的功能4-6。目前有研究表明,Tim在两个生物学过程中发挥着重要作用:一是在核输入因子Importin-α1的帮助下,Tim介导参与昼夜节律调控的转录抑制蛋白Period(Per)进入细胞核;二是在光照条件下Tim与光敏感蛋白Cryptochrome(Cry)结合,并引发一系列蛋白酶解反应来调节Tim表达水平。(Fig2 a)7。然而,Tim是如何转运至细胞核中的?光照条件又是如何调控Cry-Tim的相互作用的?这些科学问题仍然困扰着我们。
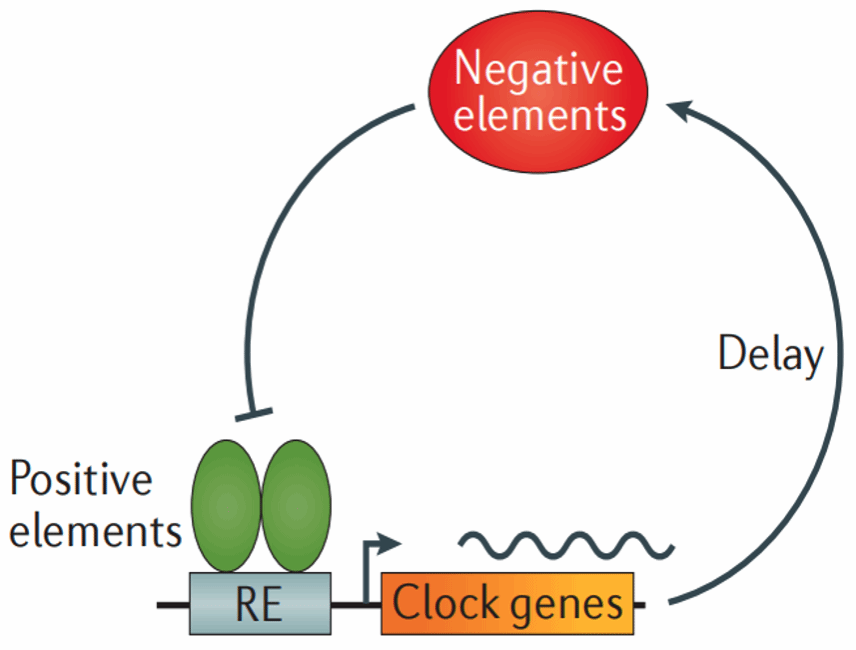
Fig 1 转录翻译反馈环路 (transcription-translation feedback loops, TTFLs)
果蝇为科学家们研究昼夜节律提供了一个十分重要的生物学模型。2023年4月26日,来自康奈尔大学的Brian R. Crane课题组在Nature上发表了题为“Cryptochrome–Timeless structure reveals circadian clock timing mechanisms”的研究论文。他们利用果蝇作为生物学模型,使用冷冻电镜技术观察到了Cry是如何与Tim识别并结合的。该结构向我们展示了果蝇中的光敏感蛋白Cry是如何与Tim之间进行相互作用的,为我们理解昼夜节律的调控奠定了理论基础。

背景
在果蝇的分子时钟中,Per和Tim首先会在细胞质中发生相互作用并一同转运进细胞核中,然后在细胞核中会抑制转录因子Clock(Clk)和Cycle(Cyc),从而使Per和Tim等其他时钟调控基因(Clock-controlled gene)表达下调7,8。由Shaggy (Sgg)和Ck2激酶引起的Tim磷酸化级联反应,为Per-Tim进入细胞核打开“大门”,从而调控昼夜节律振荡器的时间9(Fig 2a)。
而携带FAD的Cry只有在光照的条件下才会与Tim结合,并指导其参与蛋白酶体降解途径7,10(Fig 2a)。Cry与DNA修复光解酶(DNA repair enzyme photolyase)都有一个黄素结合光解酶同源区(photolyase homology region,PHR),但Cry还包含一个特定的C端拓展区域(CRY C-terminal extension,CCE)使其发挥特定的功能。植物中的Cry和动物中Cry1会感知光线的强弱来重置生物钟,而动物中Cry2会通过结合Per和以不依赖光的方式直接抑制CLK的转录。在果蝇中,色氨酸四聚体(W342, W397, W420和W394)将Cry的辅助因子FAD光还原为阴离子半醌,触发C端尾部(C-terminal tail,CTT)螺旋的释放。Cry通过结合Tim和招募E3泛素连接酶来重置Tim水平11-13。因此,Cry识别Tim是使生物钟对光感知的分子事件。虽然光敏感蛋白Cry目前也被开发为光遗传学应用的强大工具,但是关于光是如何激活Cry从而介导它们识目标蛋白的,目前我们还没有办法解释。
Cry-Tim的复合物结构:Cry和Tim的“深情相拥”
首先,作者开发了一种基于昆虫(果蝇S2)细胞表达蛋白的工作流程,用于分离264 kDa的Cry和Tim的复合物(Cry-Tim)。为进一步提高样品纯度,作者使用了纳米体改造的ALFA tag提高纯化效率,同时使用化学交联剂DSSO通过共价键稳定Cry-Tim的结构。同时,作者使用分子筛技术除去未形成复合物的Cry和Tim单体,进一步提高了Cry-Tim的浓度。
在Cry-Tim中,Tim的核心形成了一个连续三次重复的右手螺旋(ARM),且ARM结构域在序列上不连续,它们通过调换末端螺旋的位置从而实现相互作用(Fig 2c)。作者发现,Tim以一种“拥抱”的姿态将Cry搂入怀中,通过N端的ARM1和C端的柔性区域(1209-1219)与Cry相互作用。Cry-Tim复合物的相互作用界面的残基分布图如图Fig 2d,e所示。
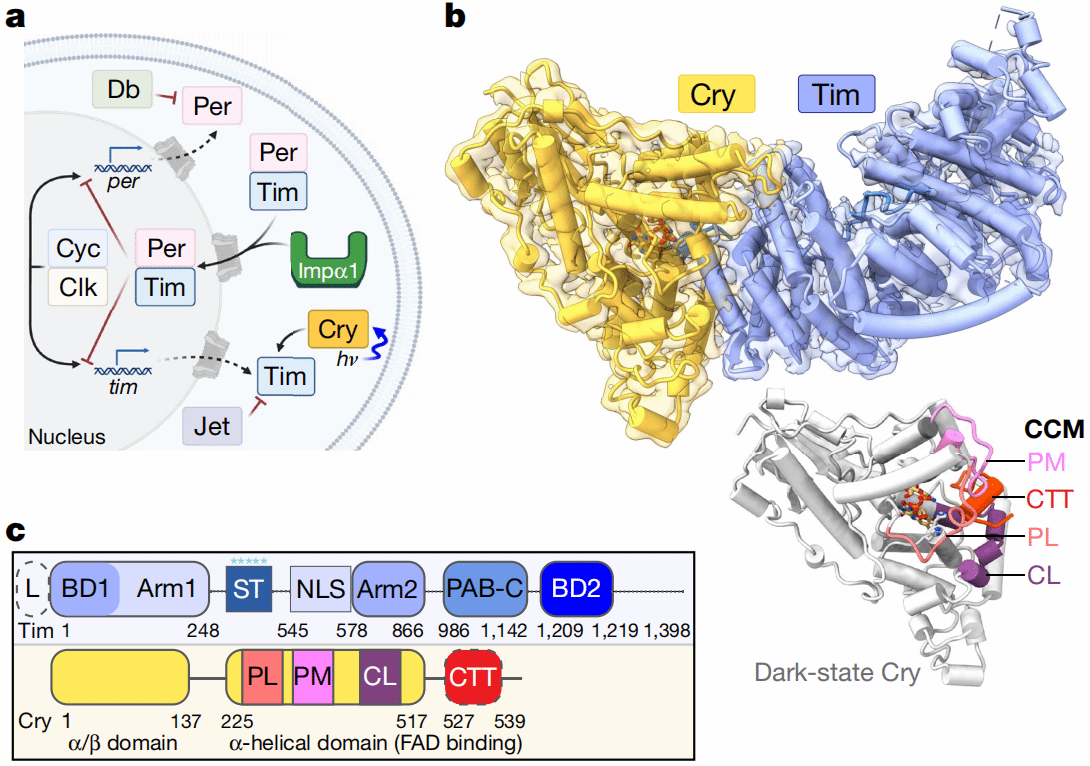
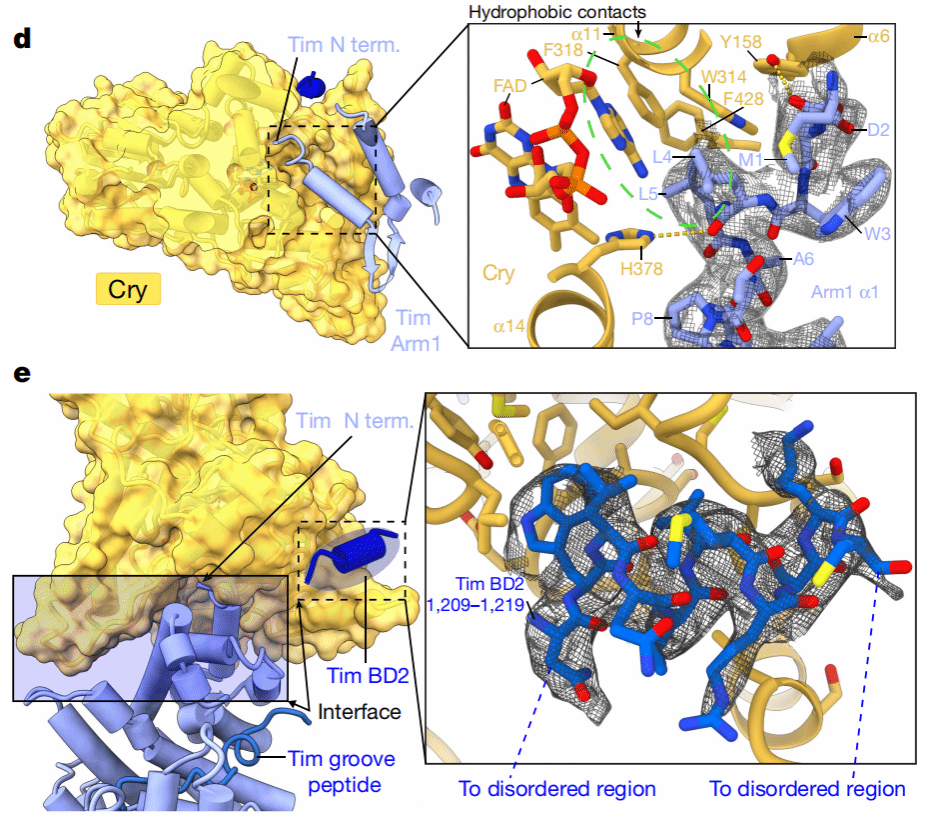
Fig 2 Cry-Tim复合物结构
Cry-Tim的变构机制:相识在阳光下
那么光照对Cry-Tim的“深情相拥”究竟有什么样的影响呢?作者们发现,在与Tim结合后,Cry的辅助因子结合口袋会发生明显的变化(Fig 3)。该构象的改变包括了腺苷和核糖部份的重新定位,二磷酸集团构象的改变以及C端的重新折叠以及与Tim的ARM1和ARM2的相互作用。作者们进一步发现,光照条件在构象转变的过程中发挥了重要的作用:在黑暗条件下,Cry与Tim并不“相识”。Cry的C端会像是盖子一样将与Tim的结合位点覆盖起来,此时,Cry无法与Tim“相拥”;然而,在光照的条件下,Cry认出了Tim的模样。Cry的C端会从结合位点脱离,Cry挥动C端“小手”招募Tim前来,并牵起Tim的N端“小手”,而位于Tim的C端臂膀——BD2,会将Cry搂入怀中。Cry-Tim的“深情相拥”为果蝇适应不同光照变化提供了分子层面的解释。
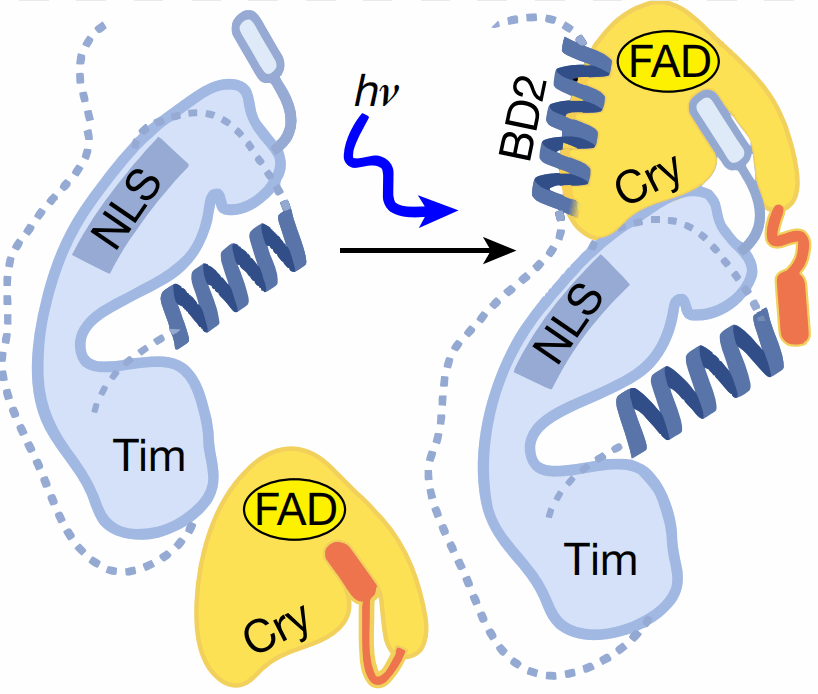
Fig 3 Cry-Tim的变构机制
Tim质核转运的调控
作者们进一步发现,Tim中含有一段重要的groove结构域(283-303),该结构域为Tim进入细胞核的机制提供了结构基础(Fig 3)。有研究表明,Tim的核转运过程会受到磷酸酶Sgg和Ck2激酶的调控,但是具体的机制目前尚不明确。作者们发现,Tim中的第90位的Thr和第92位的Pro是核输入因子Importin-α1的重要识别位点,有助于Tim进行核转运。然而,由于groove结构域的覆盖,核输入因子Importin-α1不能直接与之结合。当磷酸酶磷酸化groove结构域上的第274、278、282、286以及290的氨基酸之后,groove结构域会打开,从而有利于核输入因子Importin-α1与Tim的结合。
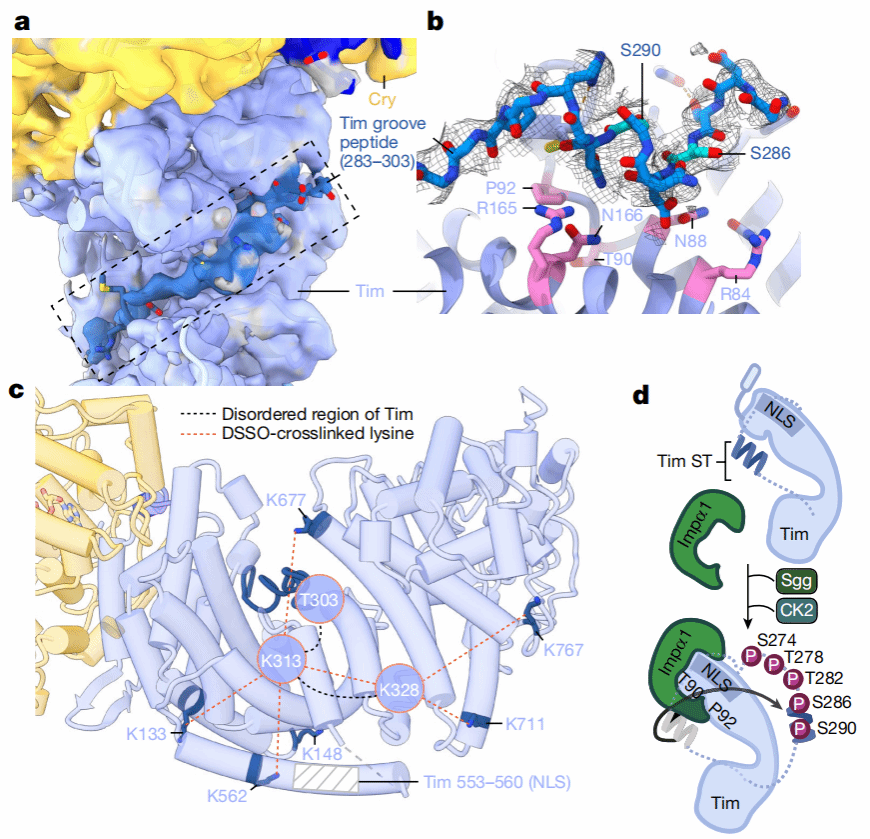
Fig 3 Tim质核转运调控机制
综上,该研究解析了Cry-Tim复合物的结构,从分子的角度揭示了光敏感蛋白Cry是如何与Tim相互作用的。同时,本文提出了一个在光照条件下Cry-Tim复合物构象的转变机制模型。最后,本文发现了位于Tim上的一个参与Tim细胞核转运的groove结构域并提出了该结构域参与Tim细胞核转运的机制。
这项研究帮助我们深入理解了昼夜节律的分子基础,提出了光照对Cry-Tim变构的调控机制。同时Cry-Tim复合物分子结构的解析,在分子层面上提示了分布在Cry和Tim中的许多重要氨基酸位点,这些重要的位点很可能会与某些疾病有着密切的联系,为后续开发相关治疗药物提供了潜在的药物靶点以及结构模型。
参考文献
1 Huang, W., Ramsey, K. M., Marcheva, B. & Bass, J. Circadian rhythms, sleep, and metabolism. J Clin Invest 121, 2133-2141, doi:10.1172/jci46043 (2011).
2 Patke, A., Young, M. W. & Axelrod, S. Molecular mechanisms and physiological importance of circadian rhythms. Nat Rev Mol Cell Biol 21, 67-84, doi:10.1038/s41580-019-0179-2 (2020).
3 Meyer, N., Harvey, A. G., Lockley, S. W. & Dijk, D. J. Circadian rhythms and disorders of the timing of sleep. Lancet 400, 1061-1078, doi:10.1016/s0140-6736(22)00877-7 (2022).
4 Lerner, L. K. et al. Timeless couples G-quadruplex detection with processing by DDX11 helicase during DNA replication. Embo j 39, e104185, doi:10.15252/embj.2019104185 (2020).
5 Baris, Y., Taylor, M. R. G., Aria, V. & Yeeles, J. T. P. Fast and efficient DNA replication with purified human proteins. Nature 606, 204-210, doi:10.1038/s41586-022-04759-1 (2022).
6 Cho, W. H. et al. Human Tim-Tipin complex affects the biochemical properties of the replicative DNA helicase and DNA polymerases. Proc Natl Acad Sci U S A 110, 2523-2527, doi:10.1073/pnas.1222494110 (2013).
7 Crane, B. R. & Young, M. W. Interactive features of proteins composing eukaryotic circadian clocks. Annu Rev Biochem 83, 191-219, doi:10.1146/annurev-biochem-060713-035644 (2014).
8 Takahashi, J. S. Transcriptional architecture of the mammalian circadian clock. Nat Rev Genet 18, 164-179, doi:10.1038/nrg.2016.150 (2017).
9 Top, D., Harms, E., Syed, S., Adams, E. L. & Saez, L. GSK-3 and CK2 Kinases Converge on Timeless to Regulate the Master Clock. Cell Rep 16, 357-367, doi:10.1016/j.celrep.2016.06.005 (2016).
10 Foley, L. E. & Emery, P. Drosophila Cryptochrome: Variations in Blue. J Biol Rhythms 35, 16-27, doi:10.1177/0748730419878290 (2020).
11 Chaves, I. et al. The cryptochromes: blue light photoreceptors in plants and animals. Annu Rev Plant Biol 62, 335-364, doi:10.1146/annurev-arplant-042110-103759 (2011).
12 Ozturk, N. Phylogenetic and Functional Classification of the Photolyase/Cryptochrome Family. Photochem Photobiol 93, 104-111, doi:10.1111/php.12676 (2017).
13 Parico, G. C. G. et al. The human CRY1 tail controls circadian timing by regulating its association with CLOCK:BMAL1. Proc Natl Acad Sci U S A 117, 27971-27979, doi:10.1073/pnas.1920653117 (2020).
本文作者:杨涵婷组孙培欣