崔奶奶已经年近八旬,是一个寡居的老太太,每天最开心的事情就是和邻居们聊天,给自己最爱的孙子孙女做好吃的,崔奶奶有三个儿子,但由于各种原因,他们都不在身边,只有孙子和儿媳妇时常前来探望她,照顾她的生活起居。
然而,最近一段时间,崔奶奶开始出现了睡眠障碍。她常常半夜醒来,紧紧抱着被子发抖,有时候也会在梦中呼唤自己已故的丈夫,白天醒过来精力减退,注意力不能集中,每天连聊天的心情都没有了。这让她的儿子和儿媳妇非常担心,特意带崔奶奶去医院的睡眠专病就诊。医生检查后发现,崔奶奶的睡眠质量很差,主要是因为年龄和身体状况的原因导致的,这个疾病影响了她白天的情绪,甚至导致了认知功能的减退。
研究表明,各种各样的睡眠困难已逐渐成为社会的一个重要问题。我国有超过一半的老年人(65岁及以上)饱受其困扰[1]。衰老相关的睡眠障碍有很多,主要可以表现为昼夜节律功能下降和神经退行性疾病相关睡眠障碍。
昼夜节律功能下降
人在进入老年后,睡眠结构会发生一系列明显的变化,如图一所示:
(1)更早的睡眠时间(即更早的就寝时间和起床时间)
(2)更长的睡眠潜伏期(即更长的入睡时间)
(3)更短的整体睡眠持续时间
(4)增加的睡眠碎片(即更少的巩固睡眠,更多的觉醒,或过渡到较轻的睡眠阶段)
(5)更脆弱的睡眠(即更有可能被外部感官刺激唤醒)
(6)较深的非快速眼动(non-rapid eye movement sleep, NREM)睡眠,即慢波睡眠(slow wave sleep, SWS)的数量减少
(7)较浅的NREM阶段1和2的时间增加
(8)较短和较少的NREM(non-rapid eye movement)- REM(rapid eye movement)睡眠周期
(9)整夜清醒的时间增加
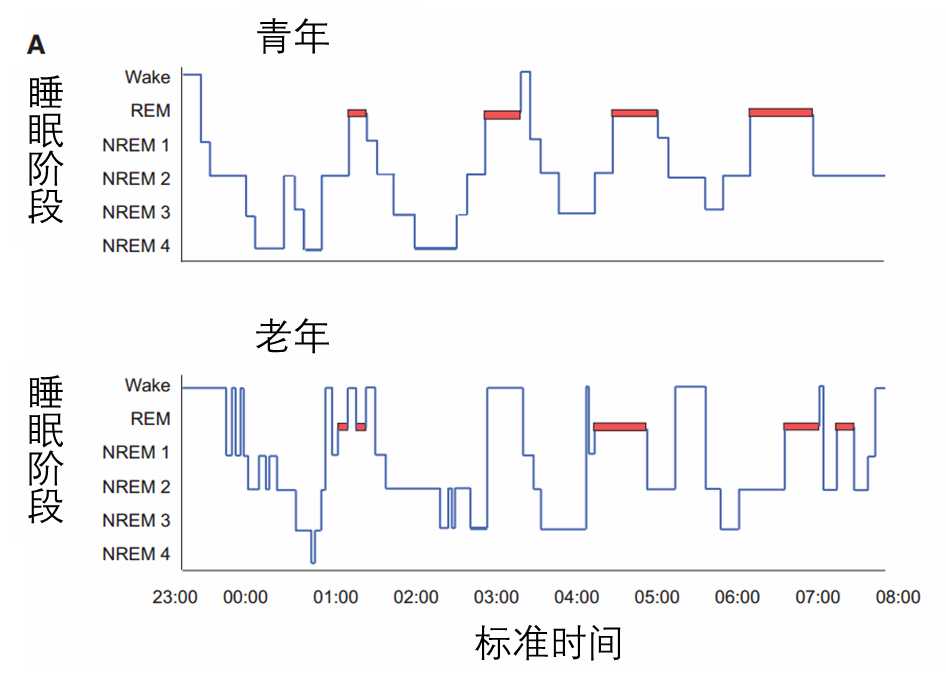
图一 年轻人(上)和老年人(下)典型睡眠结构图(hypnogram)[2]
是老人们自己不想睡吗,是随着智慧的增长,他们觉得睡眠时间是一种浪费了吗?并不是这样,衰老影响昼夜节律功能的机制有很多,主要可以分为两种,第一种是由于视交叉上核(suprachiasmatic nucleus, SCN)定时信号输出功能障碍,SCN是中央昼夜节律钟,就像交响乐团中的指挥官一样,SCN决定着我机体的昼夜节律行活动。
但是,如果视交叉上核的指挥不好,就会导致我们的生物钟被打乱,就像指挥官不擅长调节乐曲的节奏,整个乐团的声音变得嘈杂而不和谐。
通过组织学研究发现,下丘脑SCN神经元随着年龄的增长而退化,特别是那些表达血管活性肠肽(vasoactive intestinal polypeptide, VIP)的神经元;而在啮齿类动物中,尽管老龄小鼠的SCN神经元总数没有显著减少,而且单个SCN神经元能够维持老龄小鼠规范时钟基因振荡的稳健节律,但SCN神经元内的细胞间偶联和同步仍然被破坏了,主要是由于产生加压素和γ-氨基丁酸(γ-aminobutyric acid,GABA)偶联因子的SCN神经元减少。细胞间SCN耦合减少导致神经元去同步,进而导致整个SCN网络的电活动减少和SCN输出减弱。
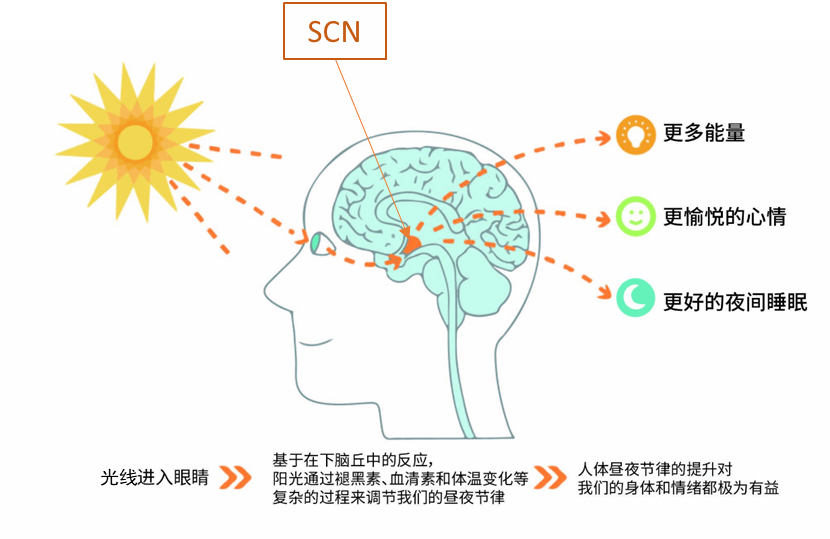
图二 SCN控制昼夜节律的机制(from website)[3]
除了由于SCN功能下降导致的昼夜节律失调,脑干与下丘脑其他区域的不稳定性也会导致老年人宏观水平的睡眠改变。睡眠碎片化就是一个很显著的特征,睡眠碎片化(Fragmented Sleep)指的是睡眠中有多次简短的觉醒状态,通常有碎片化睡眠的人是能够回想起其经历的唤醒状态的,并且每次醒来都要再次费力入睡,从而造成睡眠质量下降导致白天困倦不堪。
通过对比年轻与年老小鼠自然状态下不同神经核团自发性活动的特点,斯坦福大学的路易斯·德莱西(Luis de Lecea)实验室发现了下丘脑泌素(hypocretin, Hcrt/Orexin)神经元的活动特异性地与觉醒相关,即Hcrt神经元的自发性活动总是伴随着觉醒。年老小鼠Hcrt神经元的放电活动更为频繁,导致更加频繁的觉醒活动,使得睡眠变得更加碎片化。
使用光遗传学技术,他们发现年老小鼠的Hcrt神经元被激活后,相同的刺激让年老小鼠觉醒维持时间更长。此外,年老小鼠中表达ChR2的Hcrt神经元数量更少,结合电生理手段,作者发现年老小鼠的Hcrt神经元的静息电位有一定程度的去极化,更接近神经元动作电位的阈值,更容易放电。那么,又是什么原因让年老小鼠Hcrt神经元的膜电位产生去极化呢?作者发现在神经元复极化过程中起到重要作用的M-电流(由电压门控钾离子通道KCNQ2/3介导)在年老小鼠Hcrt中减弱,且KCNQ2表达密度更低,因此兴奋性提高,导致了睡眠碎片化的现象。
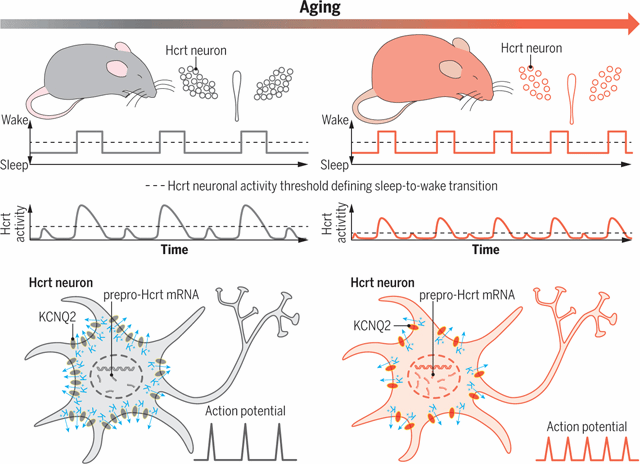
图三 衰老过程中过度兴奋的Hcrt神经元导致睡眠不稳定[4]
神经退行性疾病相关睡眠障碍
神经退行性疾病是一类累及神经系统的疾病,其主要特点是神经细胞的死亡和功能损害。常见的神经退行性疾病包括阿尔茨海默病、帕金森病、亨廷顿舞蹈病等。
不知道大家还记不记得,在央视频道曾经播出过一个公益广告,广告中的老人颤颤巍巍地把饺子塞进口袋,“这是留给我儿子的,我儿子最爱吃这个……”,他忘记了一切,却不忘对儿子的爱。不管看了多少次央视的这则公益广告,每次都忍不住眼睛一酸。

图片来源(from website)[5]
剧中的爸爸患上了阿尔茨海默症(Alzheimer's disease, AD),记忆逐渐衰退,从忘记带钥匙到不记得家在哪里,最后甚至认不出儿子。这种患上阿尔茨海默症后的无力和悲哀感,被渲染的淋漓尽致。
阿兹海默症是一种极为常见的神经退行性疾病,其特征是患者的大脑中,会出现异常的蛋白质沉积,形成所谓的β-淀粉样蛋白(amyloid-β, Aβ)和神经原纤维缠结,病人还会出现Tau蛋白的积累和扩散以及继发于tau的神经变性,这些异常的蛋白结构会干扰神经细胞之间的正常通讯和连接,最终体现为认知功能障碍和痴呆等症状。
睡眠障碍是阿兹海默症的风险因素
睡眠障碍是AD风险上升的一种标志,AD患者睡眠效率和质量的变化似乎先于认知能力下降的开始,并且与认知功能障碍和AD病理进展同时发生。据报道,AD前驱期患者比正常人更频繁地发生睡眠呼吸障碍(sleep-disordered breathing, SDB)和睡眠行为障碍(sleep behavior disorder)。
一些研究报告说,睡眠障碍和觉醒增加会增加Aβ的积累。在认知正常成人的影像学研究中,睡眠质量差,如睡眠时间缩短、睡眠效率降低和睡眠潜伏期增加,与PET扫描测得的Aβ积累密切相关,这意味着睡眠障碍对AD的发病可能有一定的促进作用。通过微透析导管对小鼠的间质液(interstitial fluid, ISF)进行纵向采样,通过留置腰椎导管对人类脑脊液进行纵向采样,研究人员发现Aβ和tau在清醒时增加,在睡眠期间减少,并且仅仅一晚的睡眠剥夺,就会导致正常年轻人清晨Aβ42蛋白水平的显著增加[6]。在动物模型中也是如此,小鼠的睡眠剥夺增加了ISF中Aβ浓度,并在21天后增加了淀粉样蛋白沉积为不溶性斑块的概率,并且,化学遗传诱导的小鼠觉醒增加使其ISF的tau浓度增加了50%。
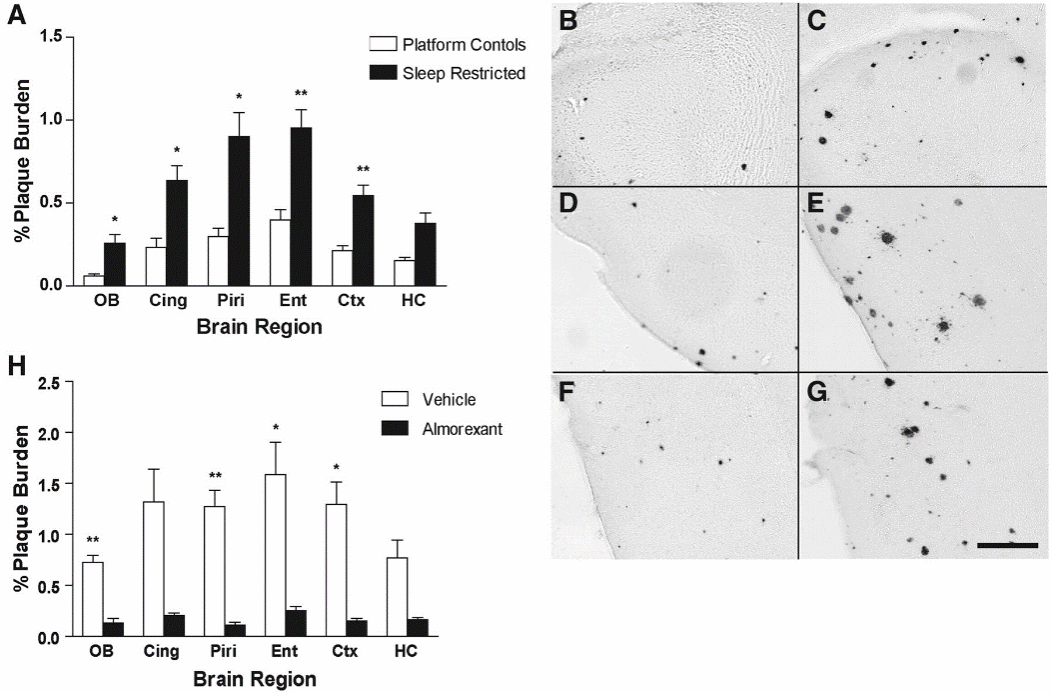
图四 小鼠慢性睡眠限制和慢性食欲素受体阻断后的Aβ斑块沉积[7] (图B、D、F为对照组嗅球、梨状皮层、内嗅皮层区域的Aβ斑块沉积,C、E、G为睡眠剥夺组)
那么,逆转睡眠障碍会不会减少患上AD的风险呢,食欲素是一种觉醒相关的神经肽,在敲除AD模型小鼠中的食欲素基因后,小鼠睡眠时间增加,大脑中淀粉样蛋白沉淀显着减少,对发生淀粉样蛋白沉积的APP转基因小鼠的其他研究发现,用双重食欲素受体拮抗剂almorexant治疗可降低可溶性Aβ浓度,而脑室内给予食欲素会增加可溶性Aβ浓度。
AD患者会出现睡眠障碍以及睡眠结构的改变
研究显示,AD患者睡眠障碍的发生率为25%-60%[8],白天过度嗜睡(Excessive daytime sleepiness, EDS)、日落综合征(sundowning)和失眠(Insomnia)是AD所致痴呆最常见的睡眠障碍,与帕金森症不同,快速眼动睡眠行为障碍在AD中很少见,日落综合征又称“黄昏综合征”或“日落现象”,是美国的一些学者提出的概念,用来描述老年痴呆患者在黄昏时分出现一系列的情绪和认知功能的改变,例如:情绪紊乱、焦虑、亢奋和方向感消失等,持续时间为几个小时或者整个晚上。在生活中,这种情况并不少见,举两个例子,45岁的王女士的母亲最近一到傍晚脾气就特别大,暴躁不安,说话语气特别冲,但过了一会又没事了,问她刚刚怎么回事,她也说不清楚;30岁的何先生发现他的外公只要是晚上出去溜达就容易分不清方向,经常性迷路,但他大早上出去买菜就从来没有过,这就是日落综合征的典型表现。
在AD患者病情的进展过程中,他们也可能会出现睡眠结构的改变,据报道,AD患者的睡眠效率、NREM睡眠时间和总睡眠时间降低,REM睡眠减少,REM睡眠潜伏期增加[9]。即使在病程早期,AD患者也会抱怨睡眠中断、失眠和频繁夜间醒来,同时,AD患者的睡眠纺锤体和K复合体频率较低且形状不良,慢波睡眠也会减少。
导致AD患者出现睡眠结构改变的一个原因可能是AD患者的大脑区域受损,基底核、桥脚被盖核和后嗅被盖核、脑干去肾上腺素能神经元等脑区神经元的退化可导致AD患者快速眼动睡眠减少。而SCN区域神经元的丢失与变性可能是更主要的原因,AD患者的尸检分析显示SCN区域出现关键神经元的细胞丢失(即血管活性肠多肽,加压素和神经降压素表达神经元)以及Tau神经原纤维缠结的积累。
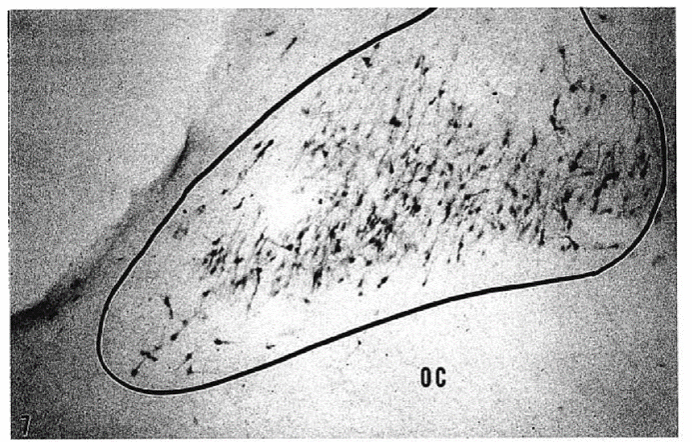
图五 SCN区域出现Tau神经原纤维缠结[10]
另外一个可能的原因是表观遗传机制,除了之前提到的SCN区域控制昼夜节律,生物钟在分子水平也受到了相应的调控,2017年诺贝尔生理或医学奖授予了下面三位教授:Jeffery C. Hall,Michael Rosbash,Michael W. Young教授,,以表彰他们在昼夜节律分子机制中的杰出贡献。他们发现了白天表达更多的PER和CRY蛋白,以及晚上表达更多的CLOCK和BMAL1蛋白。

图片来源(from website)[11]
而在阿尔茨海默病患者的死后脑样本中,BMAL1启动子甲基化改变,导致BMAL1表达改变和昼夜节律紊乱。
其他能够扰乱昼夜节律的重要因素是SCN的上游和下游通路。SCN控制昼夜节律需要视网膜投射介导的光输入同步的,在AD患者中观察到视网膜和视网膜下丘脑束的退化[12],因此可能间接损害SCN功能。同样,黄斑变性和白内障也经常出现在老年人中,似乎会提高患上AD的风险[13]。此外,临床研究表明AD患者青光眼患病率增加[14],这种疾病的特征是视网膜神经节细胞和视神经轴突的缓慢进行性退行性变。因此,即使是那些在AD过程中发生的不太显眼的症状,也可能以某种方式间接损害SCN功能从而导致睡眠障碍和睡眠结构的改变。
PD与睡眠障碍
帕金森病(Parkinson’s disease, PD)是第二常见的神经退行性疾病,临床表现为运动症状,如运动迟缓、肌肉强直、静止性震颤、姿势和步态障碍,以及非运动症状,如嗅觉功能障碍、认知障碍、精神症状、睡眠障碍、自主神经功能障碍、疼痛和疲劳。PD的病理变化主要是多巴胺能神经元和其他含色素神经元的丧失,特别是在黑质致密部(Substantia nigra pars reticulata, SNpc)中,以及在残余神经元的细胞质中出现嗜酸性粒细胞包涵体-路易体。睡眠障碍在PD中非常常见,发生率约为60-70%[15],严重影响患者的生活质量。
PD患者的睡眠障碍包括难以入睡或保持睡眠、睡眠碎片化和白天嗜睡伴白天不由自主地小睡和快速眼动睡眠行为障碍。此外,PD患者常受原发性睡眠障碍的影响,尤其是不宁腿综合征(restless legs syndrome, RLS)或阻塞型睡眠呼吸暂停(obstructive sleep apnea, OSA)。
快速眼动睡眠行为障碍(REM sleep behavior disorder, RBD)是一种睡眠异常,流行病学研究显示,RDB通常发生在50岁以后,在REM睡眠当中,个体的肌肉应该处于松弛的状态,然而在RBD患者中,他们有肌肉张力,并且可以将自己的梦付诸于行动。RBD最令人担忧的方面是大多数患者在初始 RBD 诊断后 6-15 年内发展为神经退行性疾病,RBD是目前已知的一类神经退行性疾病突触核蛋白病的最强预测因子,80-90%的患者会发展为帕金森病、路易体痴呆或多系统萎缩[16],这些联系表明,RDB本身可能就源于神经退行性过程。可能在开始,尾侧脑干出现α-突触核蛋白(α-Synuclein, α-SYN)介导的变性,并以细胞对细胞的方式不可避免地向其他区域扩散。退行性变最初以嗅觉下核(the sublaterodorsal nucleus, SLD)和髓质腹侧核(ventral medulla, vM)为目标,损害它们的功能,从而导致快速眼动睡眠张力障碍和与RBD相关的运动行为丧失。但是,随着退行性过程的推进,它们向前扩散到控制正常认知和清醒运动行为的前脑回路(即黑质,the substantia nigra, SN)中,从而导致最初的RBD症状后与突触蛋白病相关的经典认知和运动症状(例如帕金森病)。
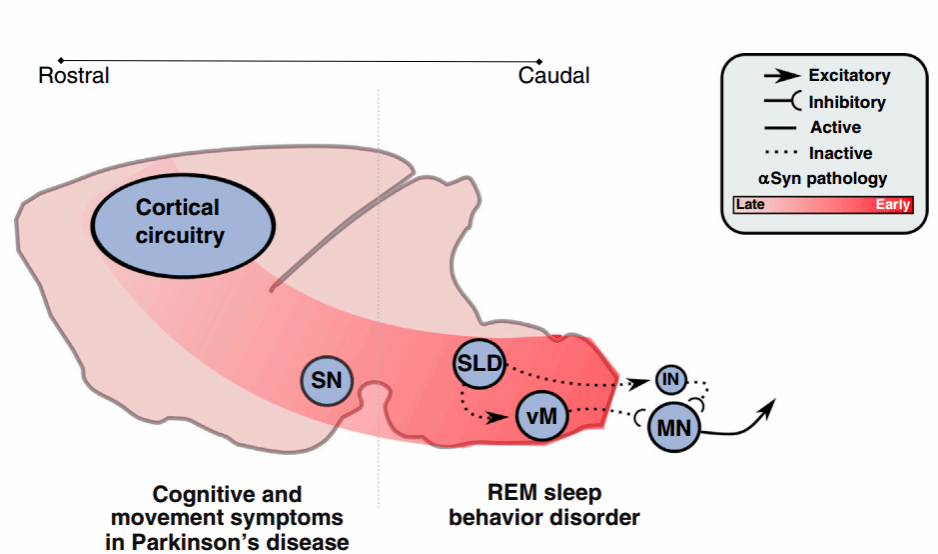
图六 快速眼动睡眠回路参与RBD的发生[17]
总之,我们不能简单地认为老年人比年轻人需要更少的睡眠,这是衰老导致的睡眠障碍的综合作用。许多老年人得不到足够的睡眠,并不意味着他们对睡眠需要减少了。一个人所需要的睡眠量从婴儿期到成年期是逐渐减少的,但这种减少的趋势在60岁左右变的不再明显。
俗话说得好“每天睡的好,八十不见老“。我们应该多去关注一下自己身边长辈的睡眠情况,让崔奶奶他们睡得peace and sound,帮助他们活得更加健康、长寿。希望各位朋友都拥有一个健康的睡眠!
参考文献
[1] 王俊秀, 张衍, 刘洋洋. 中国睡眠研究报告2022 [J].
[2] Mander B A, Winer J R, Walker M P. Sleep and Human Aging [J]. Neuron, 2017, 94(1): 19-36.
[3] https://iristech.co/sleep-light-app/
[4] Li S B, Damonte V M, Chen C, et al. Hyperexcitable arousal circuits drive sleep instability during aging [J]. Science, 2022, 375(6583): eabh3021.
[5] http://igongyi.cntv.cn/2013/10/15/VIDE1381820521900116.shtml
[6] Liguori C, Placidi F, Albanese M, et al. CSF beta‐amyloid levels are altered in narcolepsy: a link with the inflammatory hypothesis? [J]. Journal of sleep research, 2014, 23(4): 420-4.
[7] Kang J-E, Lim M M, Bateman R J, et al. Amyloid-β Dynamics Are Regulated by Orexin and the Sleep-Wake Cycle [J]. Science, 2009, 326(5955): 1005-7.
[8] Guarnieri B, Adorni F, Musicco M, et al. Prevalence of sleep disturbances in mild cognitive impairment and dementing disorders: a multicenter Italian clinical cross-sectional study on 431 patients [J]. Dementia and geriatric cognitive disorders, 2012, 33(1): 50-8.
[9] Vitiello M V, Prinz P N, Williams D E, et al. Sleep disturbances in patients with mild-stage Alzheimer's disease [J]. Journal of gerontology, 1990, 45(4): M131-M8.
[10] Stopa E G, Volicer L, Kuo-Leblanc V, et al. Pathologic evaluation of the human suprachiasmatic nucleus in severe dementia [J]. J Neuropathol Exp Neurol, 1999, 58(1): 29-39.
[11] https://www.wickedlocal.com/story/waltham-news-tribune/2017/10/02/brandeis-researcher-wins-nobel-prize/18687635007/
[12] Katz B, Rimmer S, Iragui V, et al. Abnormal pattern electroretinogram in Alzheimer's disease: Evidence for retinal ganglion cell degeneration? [J]. Annals of Neurology, 1989, 26(2): 221-5.
[13] Klaver C C W, Ott A, Hofman A, et al. Is Age-related Maculopathy Associated with Alzheimer's Disease?: The Rotterdam Study [J]. American Journal of Epidemiology, 1999, 150(9): 963-8.
[14] Tamura H, Kawakami H, Kanamoto T, et al. High frequency of open-angle glaucoma in Japanese patients with Alzheimer's disease [J]. Journal of the Neurological Sciences, 2006, 246(1): 79-83.
[15] Ma J F, Hou M M, Tang H D, et al. REM sleep behavior disorder was associated with Parkinson's disease: a community-based study [J]. BMC Neurol, 2016, 16: 123.
[16] Musiek E S, Holtzman D M. Mechanisms linking circadian clocks, sleep, and neurodegeneration [J]. Science, 2016, 354(6315): 1004-8.
[17] Peever J, Fuller P M. The Biology of REM Sleep [J]. Curr Biol, 2017, 27(22): R1237-R48.
本文作者:李世斌组王文旭