田深狡兔肥,霜降鲈鱼美,惟有莼鲈堪漫吃,下官亦为啖鱼回。人生苦短,再来一碗!所谓民以食为天,吃,是人们理所应当的美好追求。可是,当我们于华堂筵开、大快朵颐之时,病原却可能也正悄悄附着在手边的食物上伺机待发。对于这点,千百年前的苏辙深有体会,他在《寄内》中有道:“我经三伏常暴下,近喜秋风扫烝湿。病除寝食未复故,相见犹惊身似腊”。食物中毒后,机体便会启动包括恶心(nausea)、干呕(retching)和呕吐(vomiting)在内的一系列防御反应。
这个过程主要包含两大部分:一是通过呕吐将毒素或有毒化合物排出消化道,避免短期内毒素进一步侵入身体;二是通过利用恶心这一厌恶情绪,使大脑产生对有毒食物特征类型的长期记忆,避免再次摄入。由此可见,这类由毒素诱发的防御反应(toxin-induced defensive responses)对于个体生存有着极为重要的意义。
但是,除了应对食物中毒外,“恶心-呕吐”反应也同样是诸如顺铂(cisplatin)、阿霉素(doxorubicin)等化疗药物的常见副作用[1]。在治疗过程中,患者不得不服用大剂量的止吐药才能对抗频发的“恶心-呕吐”反应,给他们带来了极大痛苦。只有通过深度解析“恶心-呕吐”反应的具体机制,才可能研发出更有效的化疗止吐药。因此,研究“恶心-呕吐”反应对于临床治疗也具有重要的现实意义。
由于小鼠、大鼠等实验室常用啮齿类动物的消化道平滑肌不够发达[2],无法呕吐(vomiting),前人只能利用能产生呕吐行为的动物开展研究[3]。他们发现,通过药理学手段,NK1R和5-HT3R的拮抗剂能有效阻断化疗药物引发的呕吐行为[4]。通过生理学手段,隔下迷走神经切断术(subdiaphragmatic vagotomy)也能有效阻断“恶心-呕吐”反应[5],说明该反应可能依赖于大脑与消化道之间的肠-脑轴(gut-to-brain axis)。另外,通过分子生物学手段,他们还发现化疗药顺铂[6]和病原菌分泌的内毒素[7]能激活受迷走神经支配的孤束核(nucleus of the solitary tract,NTS)脑区。
然而,由于缺乏合适的动物和研究范式,“恶心-呕吐”行为的机制研究中还存在三个重大问题有待解决。一,究竟是肠道中哪种细胞首先检测到了病原微生物的入侵,并将这一信息传递给迷走神经?二,肠-脑轴中的这类迷走神经具有怎样的分子和生理特征?三,大脑接受迷走神经传递的情报后,如何启动下游脑区协调产生一系列防御反应?
针对这些问题,2022年11月1日,我国科学家在CELL上发表了The gut-to-brain axis for toxin-induced defensive responses一文。首次建立了以小鼠为动物模型的“恶心-呕吐”反应研究范式,并以此为基础,发现大脑中背侧迷走复合体(dorsal vagal complex,DVC)相关神经环路介导了“恶心-呕吐”防御反应[8]。

他们发现,虽然小鼠不能呕吐(vomiting),但在腹腔注射金黄色葡萄球菌分泌的肠毒素A(Staphylococcal enterotoxin A,SEA)后,仍表现出了不同于对照组的异常张嘴动作,并同时伴有膈肌和腹外斜肌收缩,即表现出“干呕样行为”(retching-like behavior)(图1A-D)。紧接着,他们进行了条件性味觉回避(conditioned flavor avoidance,CFA)实验并发现,给品尝樱桃味溶液的小鼠立即SEA,能显著减少其在后续实验中饮用樱桃味溶液的次数,即表现出对于樱桃味的“恶心”(nausea)行为(图1H-J)。因此,腹腔注射SEA的小鼠可作为研究食物中毒的新范式。
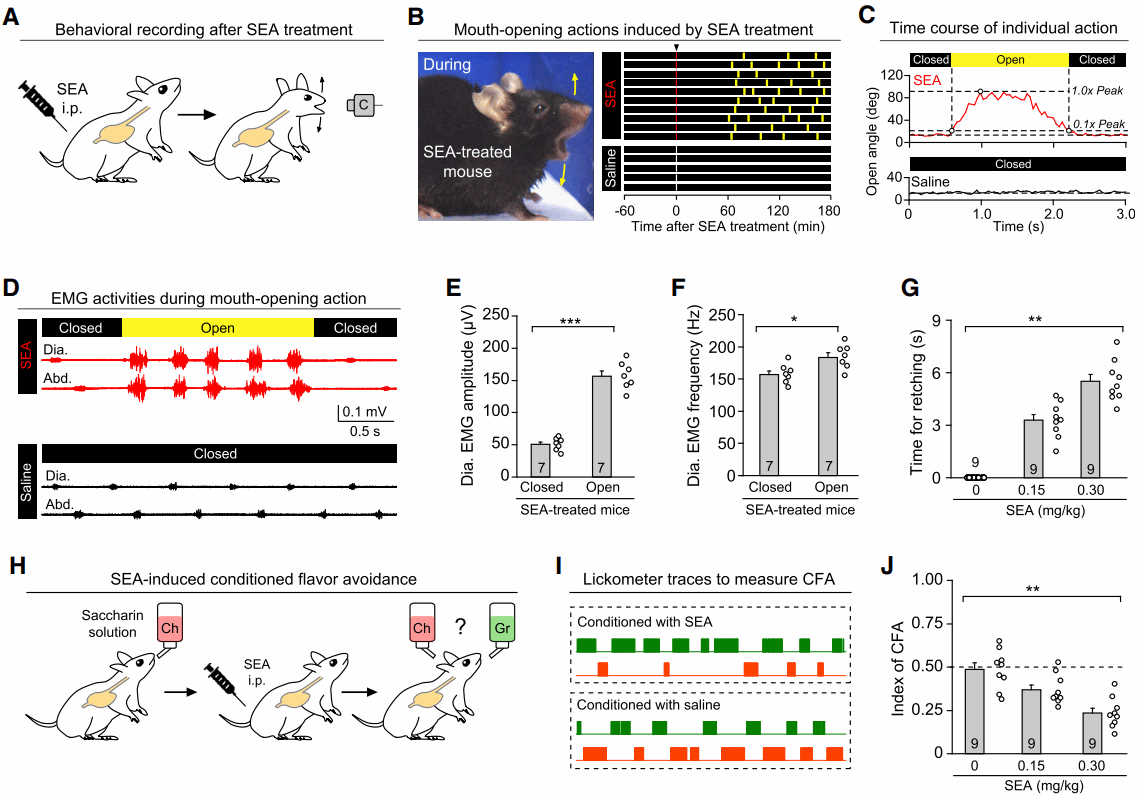
图1 SEA能引发小鼠的干呕样行为和恶心行为
进一步研究发现,双侧切断小鼠的膈下迷走神经能够显著缓解其干呕样行为和恶心行为。考虑到表达有前激素肽原-1(preprotachykinin 1,Tac1)的背侧迷走复合体(dorsal vagal complex,DVC)是延髓中接受迷走神经投射的主要脑区,且DVC中的孤束核(nucleus of the solitary tract,NTS)在SEA给药后被高度激活(图2K-L),研究者首先聚焦于DVC中的Tac1+神经元。
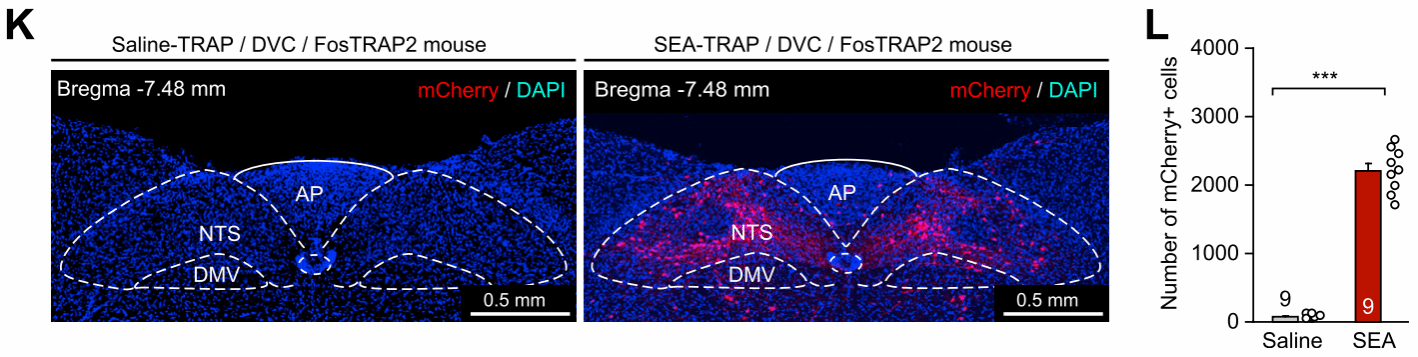
图2 小鼠DVC中的NTS脑区在接受SEA给药后被高度激活
他们发现,通过光遗传学及化学遗传学特异性激活NTS中的Tac1+神经元,能直接引发小鼠的干呕样行为和恶心行为。而反过来抑制NTS Tac1+神经元,则可以显著降低由SEA诱发的“恶心-呕吐”反应。钙成像结果进一步显示,NTS Tac1+神经元的活性在小鼠干呕时显著增强(图3)。这些结果共同表明:DVC中孤束核的Tac1+神经元介导了小鼠的“恶心-干呕”防御行为。
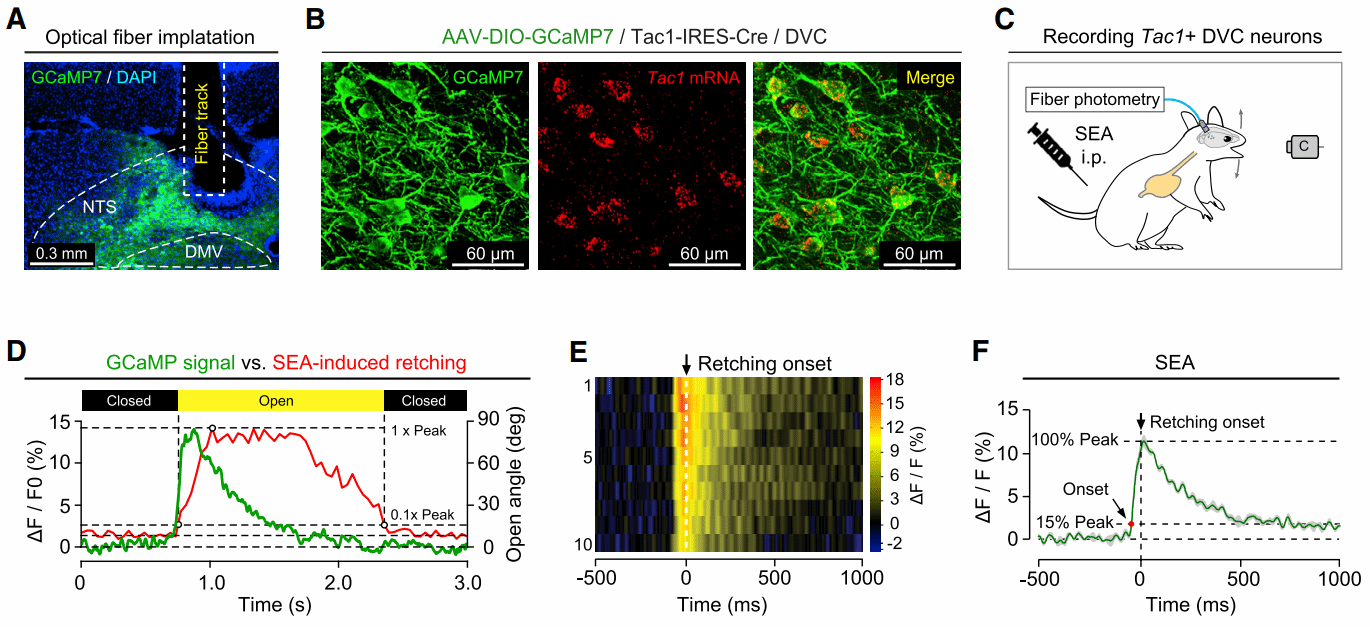
图3 光纤记录小鼠接受SEA给药后NTS Tac1+神经元的钙信号
找到关键脑区后,研究者利用逆行示踪技术标记了支配DVC中孤束核的Tac1+神经元的迷走神经,以探究DVC的上游神经环路。染色结果显示:DVC中孤束核的Tac1+神经元主要由同侧迷走神经感觉神经元单突触支配(迷走神经感觉神经元的胞体位于迷走神经结(nodose ganglion,NG)内)(图4C)。且同侧迷走神经感觉神经元的粘膜末梢主要聚集于小肠近端节段的肠绒毛处(图4D)。有趣的是,这些粘膜末梢恰好位于分泌5-HT的小肠肠嗜铬细胞(enterochromaffin cell,EC)附近(图4F,红色标记),5-HT也诱发了迷走神经感觉神经元的突触后电流。进一步研究发现,大部分被标记的迷走神经元都表达有5-HT的受体5-HT3R,且特异性敲除EC细胞中合成5-HT的限速酶基因Tph1后,小鼠由SEA引发的干呕样行为显著减少。这些结果共同表明:肠道中EC细胞能检测到SEA等有毒物质的入侵信号,并通过Htr3a+迷走神经将这一信息传递给DVC中孤束核Tac1+神经元。
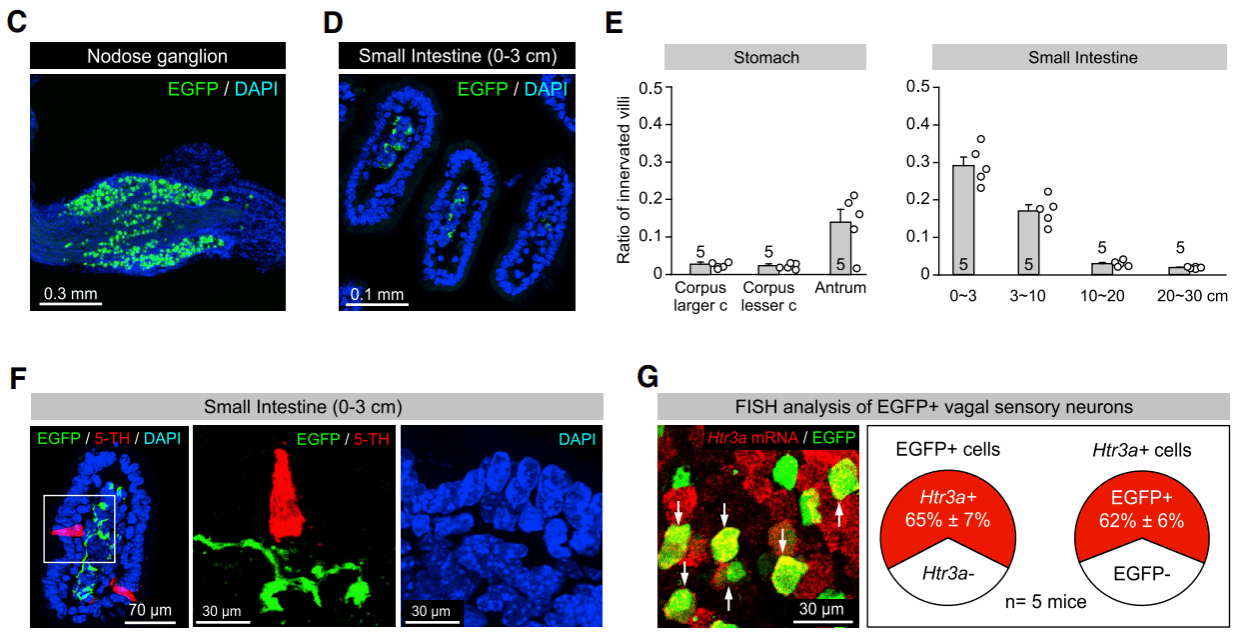
图4 支配DVC中NTS脑区Tac1+神经元的迷走神经及其粘膜末梢
应用类似的思路,研究者又利用顺行示踪技术标记了DVC中孤束核Tac1+神经元的下游投射。染色结果显示,这些Tac1+神经元主要向下游分别投射到脑桥臂旁外侧核(lateral parabrachial nucleus,LPB)和腹侧呼吸组吻端(rostral ventral respiratory group,rVRG)两个脑区(图5A-B),且投射向两者的Tac1+神经元几乎没有重叠(图5C-E)。另外,化学激活DVC-LPB环路能特异性引发小鼠的恶心行为而不引发干呕,化学激活DVC-rVRG环路则能特异性引发干呕样行为而不诱发恶心。反之亦然,化学抑制DVC-LPB环路仅能缓解小鼠在CFA实验中表现出的恶心行为,而化学抑制DVC-rVRG则仅能缓解小鼠由SEA引发的干呕样行为。以上结果共同表明,DVC中孤束核Tac1+神经元在接收到上游刺激后兵分两路,一路激活厌恶中枢LPB产生恶心行为;另一路则激活rVRG产生干呕样行为。
研究者还发现,腹腔注射化疗药物阿霉素(doxorubicin)能显著引发小鼠的恶心及干呕样行为,这与SEA的效果是类似的,化学抑制DVC Tac1+神经元活性或敲低Tac1基因也同样能显著缓解阿霉素引发的“恶心-呕吐”反应。特异性抑制DVC-LPB或DVC-rVRG环路则也能分别缓解恶心行为或干呕样行为。这说明,化疗药物可能与病原微生物类似,通过绑架进化上保守的食物中毒机制,引发了“恶心-呕吐”防御反应。

图5 DVC中NTS脑区Tac1+神经元的下游投射
至此,一条引发“恶心-呕吐”防御反应的神经环路已经清晰,在接受病原菌分泌的毒素刺激或化疗药物刺激后,小鼠肠道中EC细胞分泌5-HT充当了吹哨人,将第一手情报立即通过Htr3a+迷走神经传递给DVC中孤束核Tac1+神经元,这些Tac1+神经元再兵分两路,快马加鞭地继续激活LPB和rVRG,并分别引发恶心和干呕样行为,挽食物中毒于既倒,扶小鼠于将倾。这一研究不仅加深了研究者对肠脑轴的认识,还开辟了“恶心-呕吐”防御行为的新范式,有望为新型化疗止吐药研发提供理论依据。

原文链接:https://doi.org/10.1016/j.cell.2022.10.001
参考文献:
1.Hesketh, P.J. (2008). Chemotherapy-induced nausea and vomiting. N. Engl. J. Med. 358, 2482-2494.
2.Horn, C.C. et al., (2013). Why can't rodents vomit? A comparative behavioral, anatomical, and physiological study. PLoS One 8, e60537.
3.King, G.L. (1990). Animal models in the study of vomiting. Can. J. Physiol. Pharmacol. 68, 260–268.
4.Rojas, C., Raje, M., Tsukamoto, T., and Slusher, B.S. (2014). Molecular mechanisms of 5-HT(3) and NK(1) receptor antagonists in prevention of emesis. Eur. J. Pharmacol. 722, 26–37.
5.Fukui, H., Yamamoto, M., and Sato, S. (1992). Vagal afferent fibers and peripheral 5-HT3 receptors mediate cisplatin-induced emesis in dogs. Jpn. J. Pharmacol. 59, 221–226.
6.Reynolds, D.J., Barber, N.A., Grahame-Smith, D.G., and Leslie, R.A. (1991). Cisplatin-evoked induction of c-fos protein in the brainstem of the ferret: the effect of cervical vagotomy and the anti-emetic 5-HT3 receptor antagonist granisetron (BRL 43694). Brain Res. 565, 231–236
7.Wang, X., Wang, B.R., Zhang, X.J., Duan, X.L., Guo, X., and Ju, G. (2004). Fos expression in the rat brain after intraperitoneal injection of Staphylococcus enterotoxin B and the effect of vagotomy. Neurochem. Res. 29, 1667–1674.
8.Xie Z, Zhang X, Zhao M, Huo L, Huang M, Li D, Zhang S, Cheng X, Gu H, Zhang C, Zhan C, Wang F, Shang C, Cao P. The gut-to-brain axis for toxin-induced defensive responses. Cell. 2022 Nov 10;185(23):4298-4316.e21. doi: 10.1016/j.cell.2022.10.001. Epub 2022 Nov 1. PMID: 36323317.