引言
春节期间,小明家的饭桌上出现了各种各样的美食:有滋滋冒油的红烧肉、鲜嫩可口的清蒸鱼、新鲜爽滑的开背虾……小明胃口大开,连吃了好几天,顿顿都吃得肚子滚圆。过完年后,小明也不负众望,整整胖了五六斤。可以发现,在人类社会的不同文化中,冬天的节日往往都有着丰盛的饮食,比如中国的春节、元宵节、元旦;西方的圣诞节、感恩节等等,这也许是我们恒温进化的见证。对于恒温动物包括我们人类来说,每天摄入的热量中有很大一部分用于维持体内温度。如果环境温度降低,动物体内的“恒温器”就要加速工作了;但是,随着环境变得越来越冷,维持稳定体温所需的燃料也越来越多[1-2]。作为代偿,动物在寒冷时会吃得更多。因此,维持体内温度和进食是恒温动物生命活动的基本环节。然而,我们对寒冷引起的能量需求与进食增加联系起来的神经环路基础仍然知之甚少。
2023年8月16日,Scripps研究所叶立团队在国际顶尖学术期刊 Nature 上发表了题为:Xiphoid nucleus of the midline thalamus controls cold-induced food seeking 的研究论文[3]。该研究表明,位于丘脑中线核群的剑状核(Xiphoid nucleus,Xi)是控制寒冷诱导的摄食行为的关键脑区,其在维持恒温动物能量稳态中发挥着重要的作用。这一发现也可能会带来新的减肥和代谢健康疗法。
结果
1 低温环境会诱导食物摄入行为
小鼠在低温环境中会通过增加食物摄入来满足其能量消耗进而维持其正常生理状态[4]。作者首先采用间接测热法,通过测量氧气和二氧化碳交换来实时测定单只小鼠的能量消耗,结果表明:环境温度从23°C降低到4°C时会立即增加小鼠的能量消耗(图1a, b)。然而,温度下降与小鼠食物摄入增加之间有着显著的延迟(图1b),表明温度下降可能不是小鼠进行摄食行为的直接原因,小鼠食物摄入行为可能与能量消耗的相关性更强。作者接下来定义了5~6个小时的冷暴露为冷诱导的能量补偿(cold-induced energy compensation,CIEC)的开始,并在后续研究中聚焦在此时间段。为更好理解小鼠行为间的联系,作者使用了隐马尔可夫模型(HMM)对小鼠在冷暴露环境下的不同状态进行了分类:状态1的小鼠大多保持不动;状态2的小鼠探索并寻找食物,其进食概率最高;状态3为没有食物寻求需要的探索,即小鼠在没有食物消耗的情况下从事其他行为。研究中发现,小鼠在寒冷环境下更多会维持状态1,说明了在面临能量危机的时刻,小鼠并非会选择无限制的增加能量摄入,而是需要在保存产热能量(保持不动)和补充能量供应(寻找食物)之间做出选择(图1d)。后续为了识别CIEC驱动食物摄入的神经环路,作者进行了全脑c-fos筛查(图1h),发现丘脑活动在低温条件下受到抑制,但丘脑腹侧中线(vMT)区域内包括Xi在内的几个核团表现出高度激活(图1i, 图 2a)。

图1
2 Xi神经元与CIEC诱导的摄食相关
为了区分vMT激活是由温度骤降导致还是与CIEC相关,作者观察了低温暴露5小时(模拟CIEC)或15分钟(模拟急性降温)后c-Fos的表达。结果发现,与15分钟的低温暴露或30°C的饲养环境中的小鼠相比,5小时的低温暴露导致位于Xi的c-Fos表达(图2b , c),表明Xi的激活可能是由CIEC导致的。
作者接下来进一步确认了 Xi神经元与CIEC诱导的摄食的相关性。作者通过监测Xi钙离子的信号,发现CIEC进食事件前Xi神经元活动显著增加,但在同一个体的热中性温度(非CIEC)进食事件中未观察到Xi神经元活动的变化,表明Xi神经元与CIEC诱导的摄食相关 (图 2f-i)。作者对HMM状态进行光纤记录分析,发现Xi神经元活动与状态1(宿主节能状态)和状态2(食物寻觅状态)密切相关,而与状态3(一般的探索运动)无关(图 2j-l),证明Xi神经元在节能状态和觅食状态间的转换过程中被特异性激活,最终导致代偿性进食。
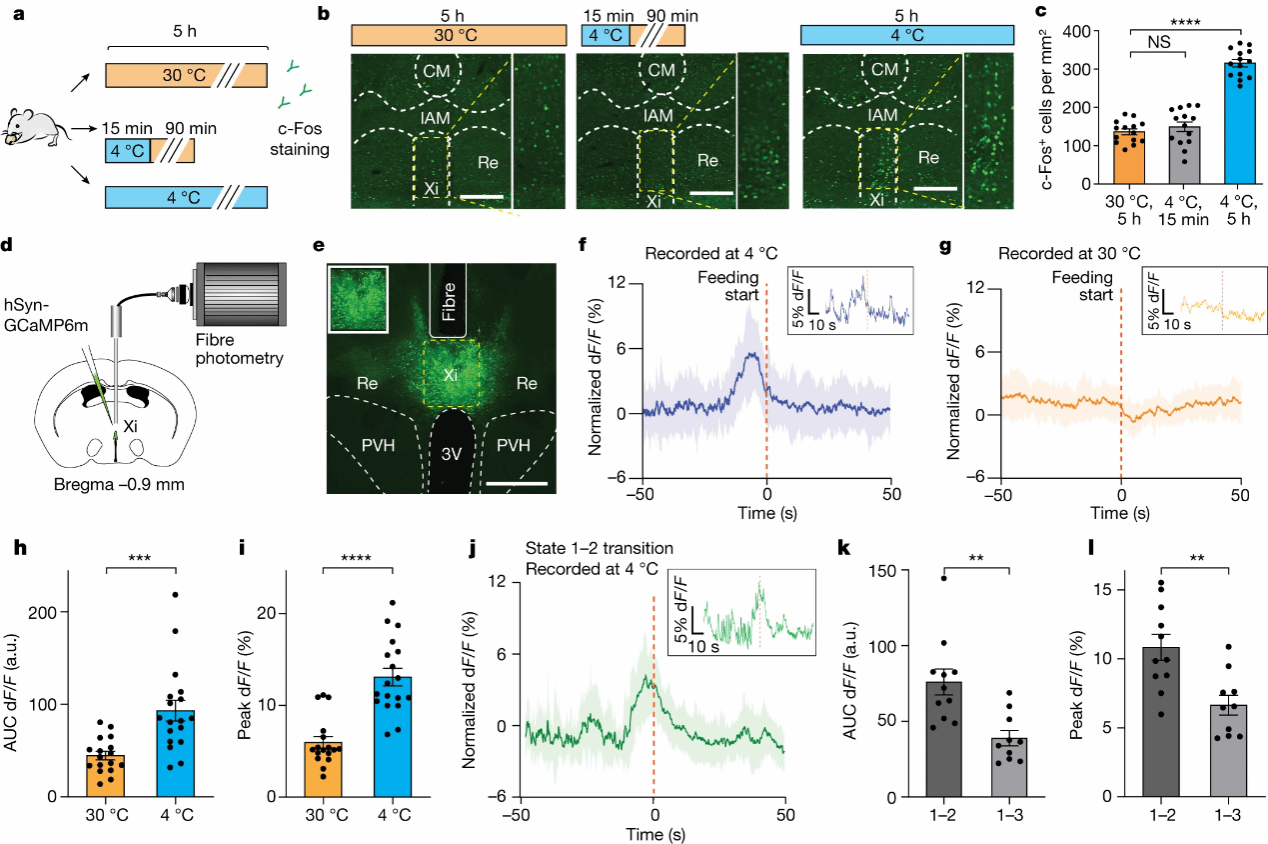
图2
然而,有关vMT的研究较少,没有明确的边界或分子标志物,为了验证Xi神经元的作用,作者利用先前验证过的基于活动依赖性的ESARE-ER-Cre-ER的vCAPTURE策略[5],通过hM3Dq(Gq)靶向激活Xi神经元(图3a-c)。结果发现,Xi神经元在4°C下被有效激活,并且这些神经元与低温诱导下表达c-Fos的神经元高度共标,但在30°C下共标的神经元较少;Gq组使用氯氮平N-氧化物(CNO)在低温条件下靶向激活Xi神经元,与红色荧光蛋白(RFP)对照组给予CNO或30°C环境饲养小鼠给予CNO相比,低温下Gq组食物摄入量显著增加,进一步表明Xi神经元主要调控低温诱导的进食(图3f-i)。
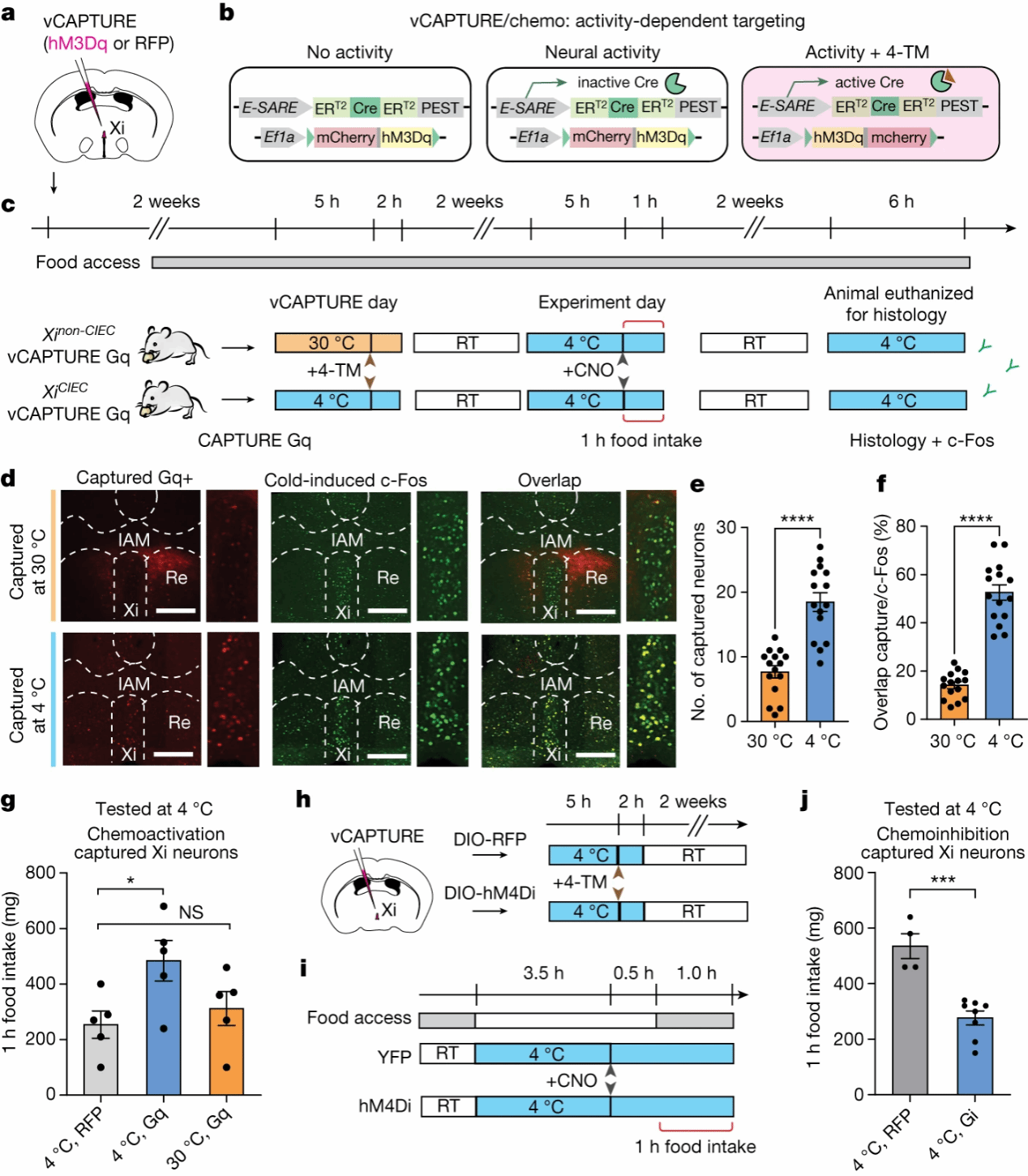
图3
3 XiCIEC神经元调控低温摄食行为的状态
为研究XiCIEC神经元诱导摄食功能中的时间相关性,作者接下来在Xi神经元中选择性表达ChR2进行光遗传调控(图4a, b)。结果发现,对Xi神经元进行光激活导致食物摄入量显著增加、总运动量减少,而对照组则没有显著变化(图4c-f)。此外,视频分析表明,Xi神经元激活可以导致小鼠从状态1到状态2的转变,且状态2的总时间增加(图 4g, i),这些结果结合之前的光纤记录的数据表明,Xi神经元激活促进CIEC诱导的食物摄入,而不影响其他与运动相关的行为变化。
接下来,为了描述Xi神经元如何影响行为状态的转换,作者使用实时位置偏好(RTPP)来评价与Xi激活相关的行为表征。作者首先将表达ChR2的小鼠放置在没有光刺激的两个不同腔室中以确定基线位置偏好,结果发现其没有显著偏好;在RTPP训练期间,小鼠进入竞技场的一侧时,神经元受到激活刺激,当它们越过另一侧时,神经元激活刺激停止;接下来在室温下,Xi激活未表现出位置偏好,然而,当RTPP在低温条件下(4°C)进行时,相同的动物更加倾向于转向光刺激侧(图4 j-m)。这一结果与上述光激活研究的结果相匹配,而且位置偏好仅存在于表达ChR2的小鼠中,而不存在于RFP对照鼠中。RTPP结果表明,在CIEC期间,小鼠觅食状态转变可能由Xi神经元激活所介导。
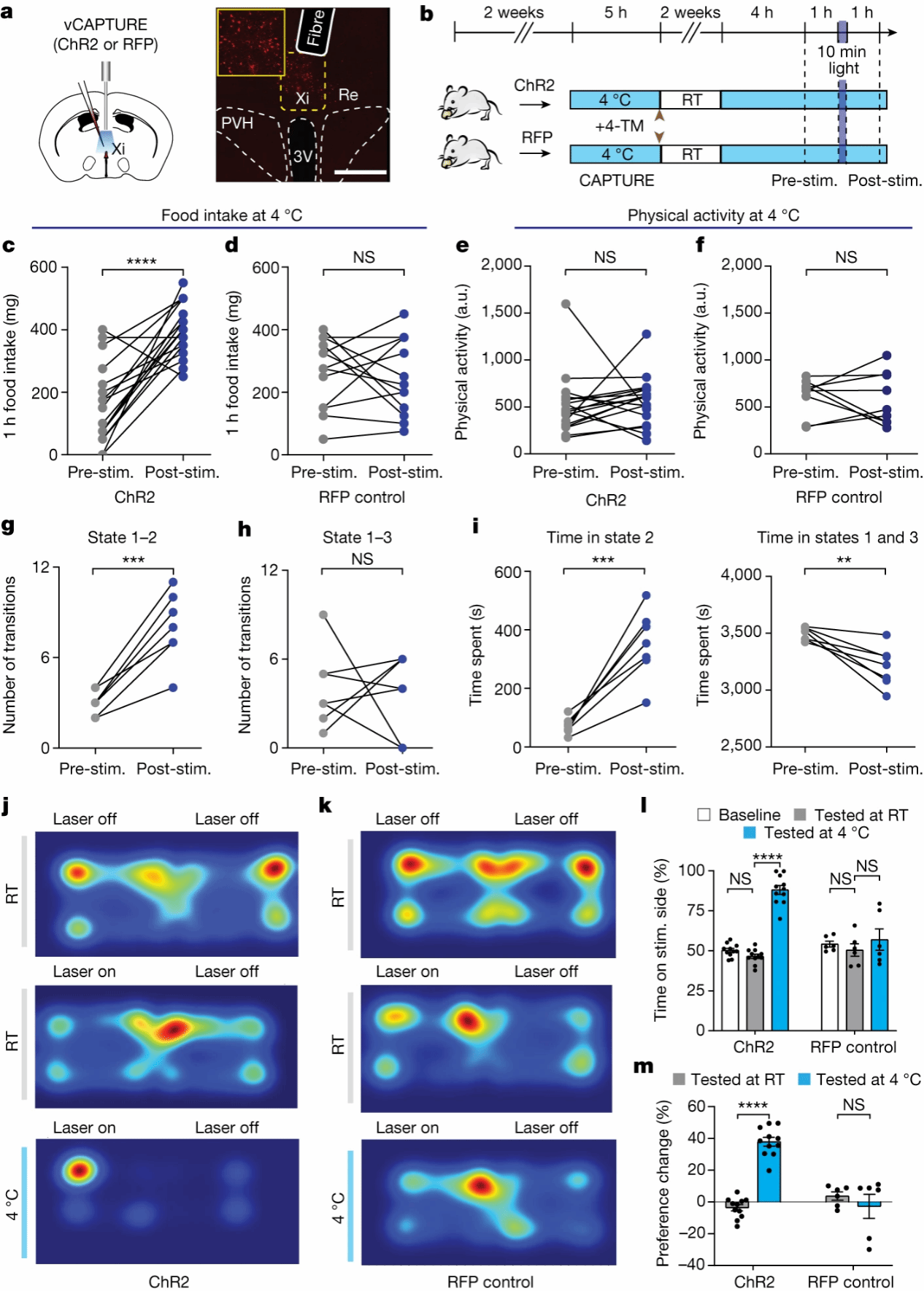
图4
4 Xi-NAc环路调控低温环境下的摄食行为
借助于vGLUT2-Cre和vGAT-Cre小鼠,作者发现Xi调节的觅食行为主要由Xi中的谷氨酸能神经元介导,通过使用表达mCherry的腺相关病毒(AAV)来探究Xi的下游投射脑区,发现Xi可以投射到伏隔核(NAc),基底外侧杏仁核(BLA)和前扣带皮层(ACC)(图 5a, b)。为了进一步确认这些脑区中与Xi相对应的关键核团,作者使用CTB逆行示踪染料分别注射到NAc,BLA和ACC[6]中,发现c-Fos阳性神经元和CTB之间最多的共标是在Xi-NAc投射神经元中(图5d-g)。为检测Xi-NAc投射在低温诱导食物摄入中的作用,作者将表达ChR2的AAV注入Xi,并在NAc,BLA或ACC上方植入光纤, 发现仅Xi-NAc投射的光激活导致了食物摄入量显著增加(图 5i, j)。最后,使用RTPP,发现Xi-NAc投射的激活导致低温依赖性摄食效应,而其他投射的激活则无法做到这一点(图5 k, l)。这些结果表明,Xi-NAc投射环路主要介导低温诱导的觅食行为。
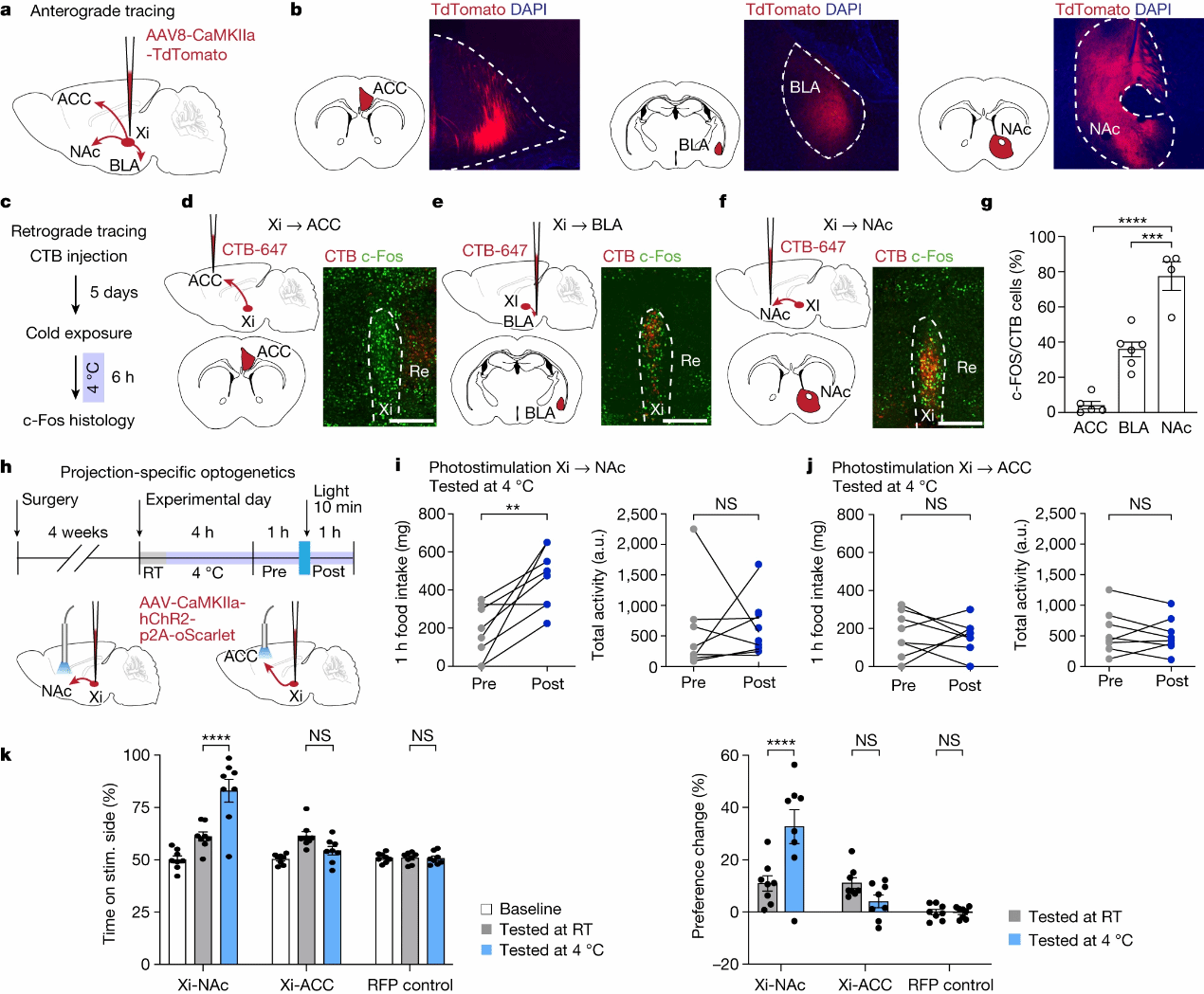
图5
结语
由于暴露在寒冷环境中会导致能量燃烧增强以保持体温,冷水浸泡等方式的“寒冷疗法”已经被探索作为减肥和改善代谢健康的方法。但这种寒冷疗法有一个重要缺点——人类对寒冷进化出来的反应并不是为了减肥,反而这种减肥方式会带来进食量的增加。
在这项研究中,叶立团队希望找到调节这种由寒冷引起的食欲增加的神经环路。他们发现小鼠在寒冷温度中动态地在能量节约状态和觅食状态之间切换,而后者主要是由能量消耗所驱动的。也就是说,寒冷环境下食物摄入增加不是直接由于感受到寒冷或单方面觅食行为引起,而是由于低温条件下热量消耗的增加引起动物在节能和能量补充之间做出转换的动态结果。
叶立教授表示,这些发现表明了阻断由寒冷引发的食欲环路不失为一条可行的减肥方式,具有一定临床意义。团队接下来的主要目标之一是解析食欲增加与能量消耗增加之间是否存在相关性,并进一步探究由寒冷引起的食欲增加机制是否是身体用来补偿额外能量消耗的更广泛机制(例如运动后)的一部分。
参考文献:
[1] Ma, Y. et al. Seasonal variation in food intake, physical activity, and body weight in a predominantly overweight population. Eur. J. Clin. Nutr. 60, 519–528 (2005).
[2] Zorbas, C. et al. The relationship between feasting periods and weight gain: a systematic scoping review. Curr. Obes. Rep. 9, 39–62 (2020).
[3] Lal, N.K., Le, P., Aggarwal, S. et al. Xiphoid nucleus of the midline thalamus controls cold-induced food seeking. Nature 621, 138–145 (2023).
[4] Deem, J. D. et al. Cold-induced hyperphagia requires AgRP neuron activation in mice.eLife 9, e58764 (2020).
[5] Kawashima, T. et al. Functional labeling of neurons and their projections using thesynthetic activity-dependent promoter E-SARE. Nat. Methods 10, 889–895 (2013).
[6] Silva, B. A. et al. A thalamo-amygdalar circuit underlying the extinction of remote fear memories. Nat. Neurosci. 24, 964–974 (2021).
本文作者:马通组吾心悦