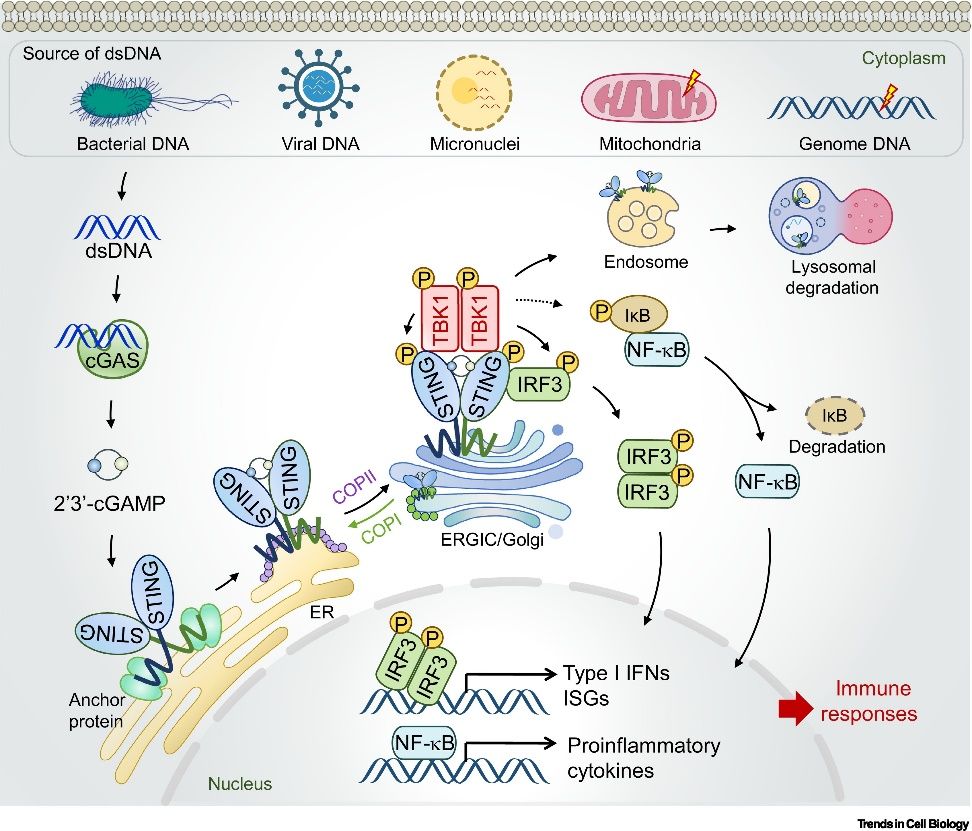
干扰素基因刺激因子 ( STING ) 通路是一种进化保守的 固有免疫 通路,它在应对包括病原体感染、 DNA 损伤、异常细胞复制和衰老在内的许多过程时被激活 。虽然这些过程各不相同,但都被认为是通过产生异常的双链 DNA来启动途径激活 。 这些 双链 DNA被 环GMP-AMP合酶 ( cGAS ) 识别并激活其催化活性, 产生第二信使 环GMP-AMP ( cGAMP ),进而结合位于内质网的接头蛋白STING使其二聚化被激活并转运到反式高尔基体囊泡。 结合后的STING可以磷酸化干扰素调节因子3 ( IRF3 ) ,并激活NF-κB,从而促使细胞合成I型干扰素、肿瘤坏死因子 ( TNF ) 和IL-6。而这里提到的干扰素、TNF、IL-6都是调节免疫的重要分子, 作为 免疫系统的 “ 精力剂 ” , 他们 被细胞 释放 之后就能 促进免疫系统 的功能。
cGAS-STING通路的信号传导和调控[1]
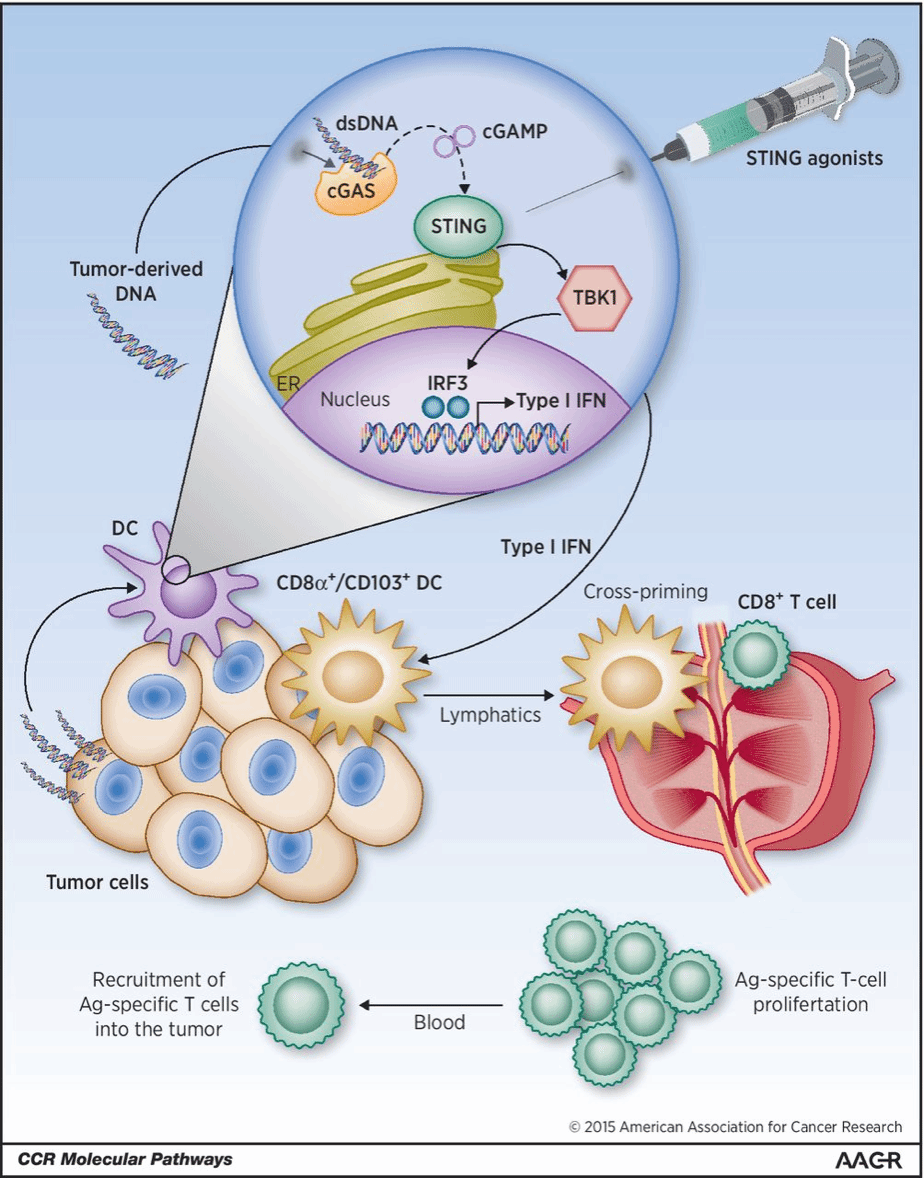
得益于此特点,由于肿瘤细胞常常发生 DNA的损伤和外溢,而这正好能够活化cGAS-STING通路,从而诱发干扰素等免疫因子的表达 ,使得其成为 抗肿瘤 领域的得力助手。最 近的证据表明,肿瘤驻留树突状细胞中STING通路的自发激活导致I型干扰素的产生和抗肿瘤的适应性免疫反应。作为一种 新式 治疗方法,瘤内注射STING激动剂已在多种小鼠肿瘤模型中显示出深远的治疗效果,包括黑色素瘤、结肠、乳腺、前列腺和纤维肉瘤。 因此,如何 更好 在 确定肿瘤 乃至肿瘤微环境中识 别 特异 的 c GAS-STING通路,以及 以此为依据 开发新药 的思路使患者获益, 是 目前针对c GAS-STING 通路抗肿瘤功能 临床转化的重要 方向 。
cGAS-STING通路在抗肿瘤免疫中的作用[2]
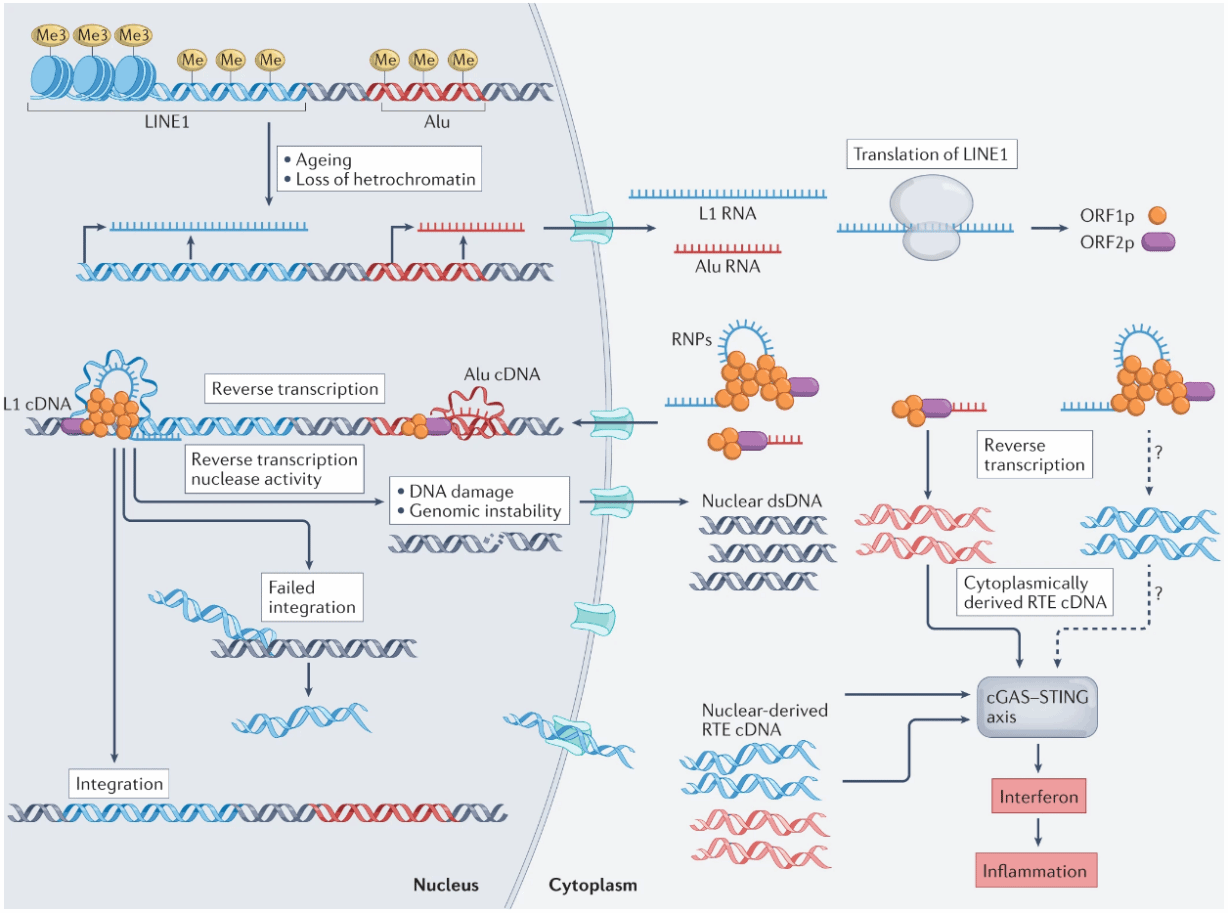
虽然c GAS - STING 在对抗外来感染、损害乃至肿瘤的过程中起到重要作用,但是, 物极必反 , 当 肿瘤 细胞中 也 发生DNA双链断裂时,有一些cGAS 就会 被转移到细胞核里,并阻碍DNA修复酶的形成, 从而发生 染色质不稳定, 进而 促进 肿瘤 生长。同时,cGAS活化后还能激活非典型的NF-κB通路和转录因子ReLB130信号,从而促进肿瘤转移 。如果c GAS-STING 通路在正常细胞中异常激活,也会带来不好的结果,最耳熟能详的就是由c GAS-STING 通路介导的 细胞衰老 ,从而带来各种各样的“老年性”疾病以及过度炎症反应,我们平常说的神经退行性疾病其实是属于这类“老年性”疾病。
cGAS-STING通路参与的细胞过度炎症反应过程[3]
多发性硬化症(MS)是中枢神经系统(CNS)最常见的自身免疫性疾病,其典型特征为炎症诱导的神经退行性变。在MS病程中,持续的炎症持续刺激神经元,导致神经变性和神经功能障碍恶化。虽然免疫抑制药物可以有效调节MS中浸润的免疫细胞,但它们不能干预进行性神经退行性变。因此,临床上需要通过直接作用于神经元的神经保护疗法来阻止MS和其他“老年性”疾病中炎症诱导的神经退行性变。

2024年 6月14日,来自德国汉堡E ppendorf(和大家平常用的移液枪是一个名字) 大学医学中心神经免疫学和多发性硬化症研究所的F riese团队 在《 Cell 》杂志上发表 了一项研究 “STING orchestrates the neuronal inflammatory stress response in multiple sclerosis” ,他们发现作为抗肿瘤药物靶点的明星分子STING竟然是介导MS的“背后黑手”
[4] 。
研究团队通过深入分析在神经炎症发生发展过程中神经元的应激反应,发现在MS病人及其小鼠模型中,谷氨酸的兴奋毒性会使得神经元中的STING从基质相互作用分子1(STIM1)上解离,并进一步激活。STING的解离启动了非经典信号传导途径,导致溶酶体降解谷胱甘肽过氧化物酶4(GPX4),而GPX4又是维持神经元氧化还原平衡的关键酶,其降解触发了铁死亡(ferroptosis)。而通过相应的遗传或药物手段干预神经元中的STING激活,可以有效抵抗炎症引起的MS。
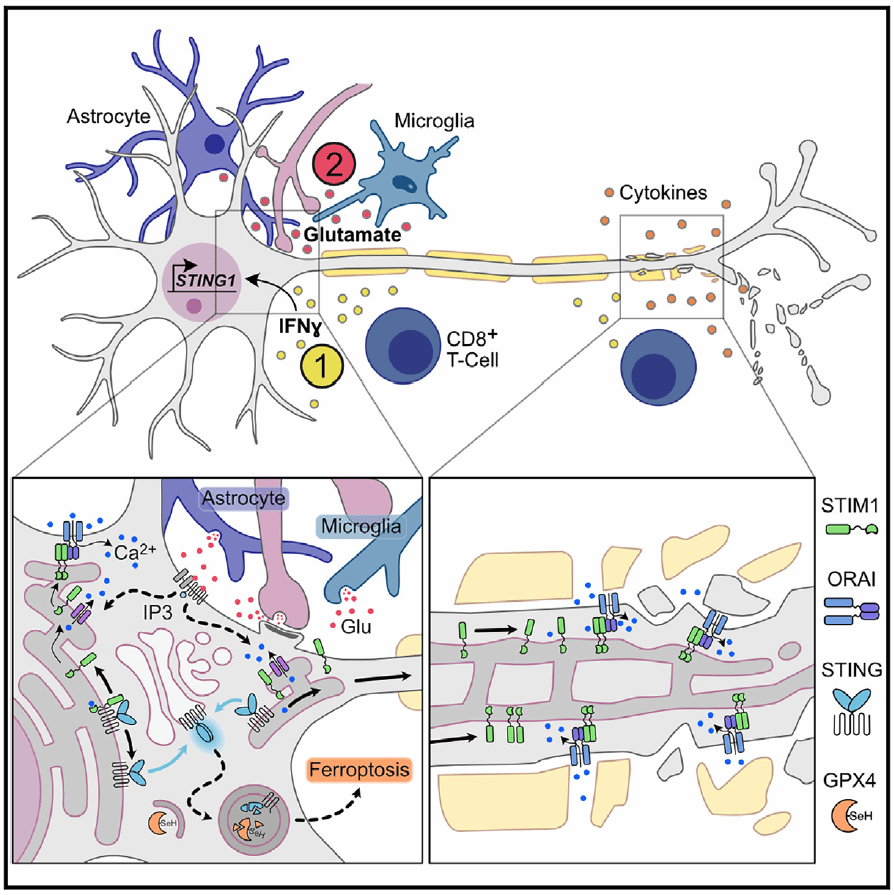
1、STING选择性表达于炎症状态下的神经元中,并通过非典型信号通路发挥作用。

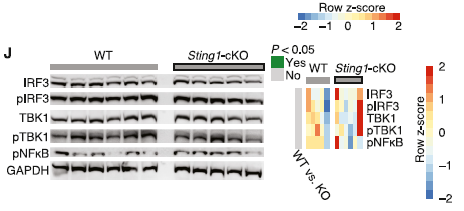
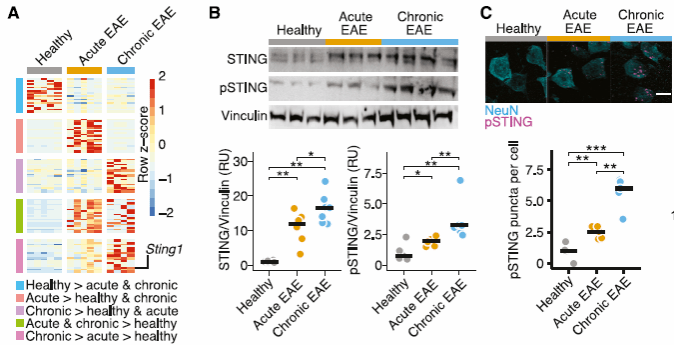
图1
2、炎症条件下神经元中STING的激活通过非经典STIM1-STING信号通路介导细胞自噬。
研究人员进一步发现,当神经元受到谷氨酸兴奋性毒性攻击时会导致ER钙耗竭,STING从与之相连的STIM1上解离,从而转移到高尔基体被磷酸化和激活进而诱导自噬(图2)。
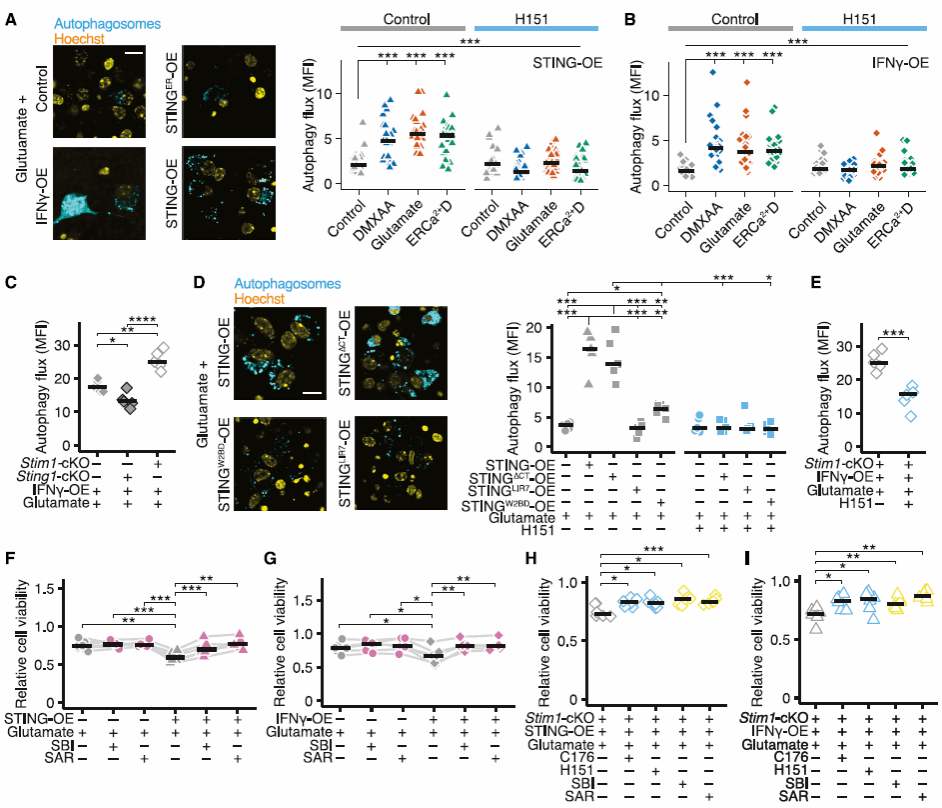
图2
3、非经典STING信号通路介导的自噬促进GPX4降解引发神经元铁死亡
自噬依赖性细胞死亡的两种机制包括:自体死亡(Autosis),即自噬依赖性非凋亡形式的细胞死亡方式, 由过量或不受控制的自噬激活Na+/K+-ATP酶所触发[5];另一种是铁离子依赖性细胞死亡途径——铁死亡,这一途径通过GPX4的自噬降解而被强烈诱导,GPX4可保护细胞免于发生脂质过氧化,并与铁死亡密切有关[6]。这两种机制在肿瘤中已被探索,但在神经元中的作用还未可知。研究发现,神经元中非经典STING-STIM1介导的自噬诱导GPX4的降解,破坏了神经元中的适应性抗氧化反应,导致活性氧(ROS)的积聚和铁丝死亡(图3)。
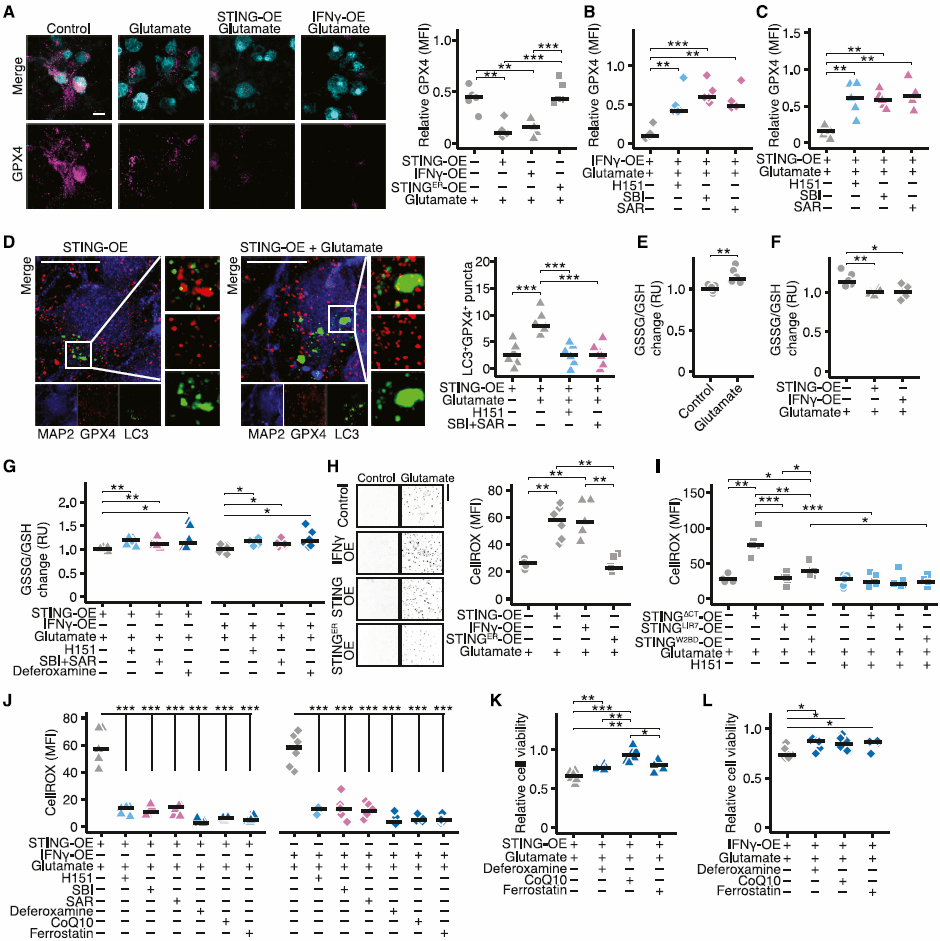
图3
4、靶向神经元STING可以保护免受炎症诱导的神经退行性病变。
最后,作者在MS患者神经元中也发现了STING的广泛上调,表明其为治疗干预MS的潜在靶点。随后作者通过药物干预EAE小鼠模型神经元中的STING或将神经元中的STING特异性敲除后发现,靶向神经元中的STING明显改善了小鼠的临床结果,减少其神经元损失,此外自噬及铁死亡标志物也显著降低(图4)。
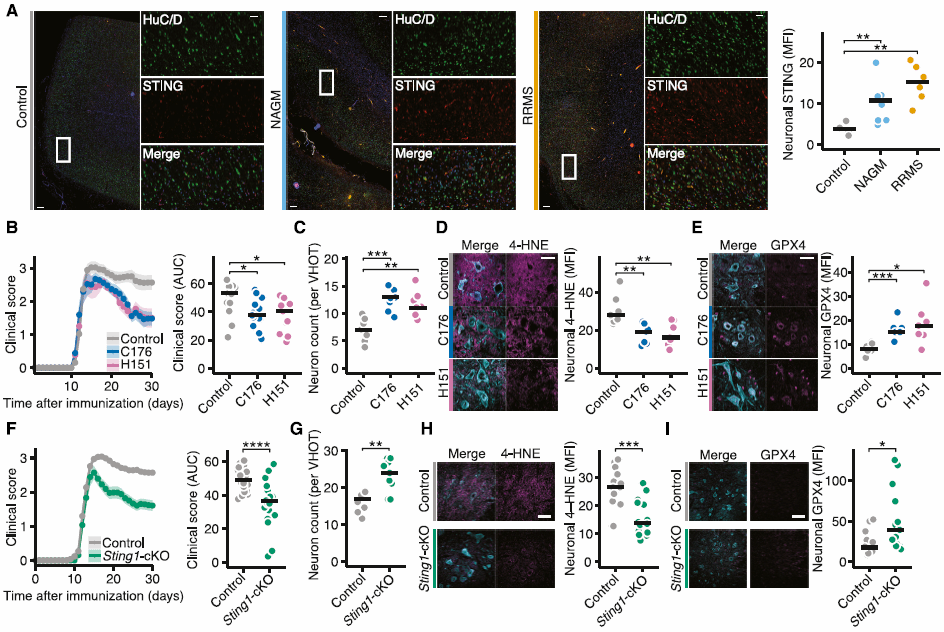
(图4)
本研究的创新之处在于揭示了MS中神经元中活化的STING为有害的神经炎症应激反应关键分子,它将炎症与谷氨酸信号传导整合,触发神经元铁死亡。这一发现不仅增进了我们对MS病理机制的理解,还为开发针对MS的神经退行性病变治疗策略提供有潜力的新靶点。
原文链接:https://doi.org/10.1016/j.cell.2024.05.031
参考文献
[1] Chen, C. and P. Xu, Cellular functions of cGAS-STING signaling[J]. Trends Cell Biol, 2023. 33(8): p. 630-648.
[2] Corrales, L. and T.F. Gajewski, Molecular Pathways: Targeting the Stimulator of Interferon Genes (STING) in the Immunotherapy of Cancer[J]. Clin Cancer Res, 2015. 21(21): p. 4774-9.
[3] Zhao, Y., et al., DNA damage and repair in age-related inflammation[J]. Nat Rev Immunol, 2023. 23(2): p. 75-89.
[4] Woo, M.S., et al., STING orchestrates the neuronal inflammatory stress response in multiple sclerosis[J]. Cell, 2024.
[5] Liu, Y., et al., Autosis is a Na+,K+-ATPase-regulated form of cell death triggered by autophagy-inducing peptides, starvation, and hypoxia-ischemia[J]. Proc Natl Acad Sci U S A, 2013. 110(51): p. 20364-71.
[6] Lee, S., et al., Autophagy mediates an amplification loop during ferroptosis[J]. Cell Death Dis, 2023. 14(7): p. 464.
本文作者:杨辉组刘茶宪