提到人造器官,你的脑海里第一个迸发出来的想法是什么?大部分人应该会立刻想到科幻题材的小说,电影又或者游戏里面,人造器官作为一种“零件”去替换掉我们身体内衰老或者损坏的组织,甚至可以帮助人类突破自身极限。比如,在《战斗天使:阿丽塔》中,除了大脑,其余身体器官都能由人创造。

电影《战斗天使:阿丽塔》
又或者,在《赛博朋克2077》中,人类寿命都是几百岁,甚至连大脑都可以是“替换部件”。

游戏《赛博朋克2077》
这些情节听起来确实非常玄乎,离我们很遥远。但实际上,我们正在一步步迈向人造器官的实现。其实,很早以前就有人提出器官替代的治疗方案,并且已经在替代器官这条路上探究了上百年。从最早的器官移植,再到近十几年来人造器官的逐渐完善,再到近年来通过干细胞培养形成类器官。或者,真的有一天,科幻将变成现实。
自2006年,Shinya Yamanaka利用4种转录因子将人体细胞重组成干细胞(人类诱导多能干细胞)以后,细胞培养领域开启了新纪元1。而在2013年,Lancaster成功培养出具有一定特征的皮层类器官。此后,在这个培养模式上又衍生出了许多不同的大脑类器官2。
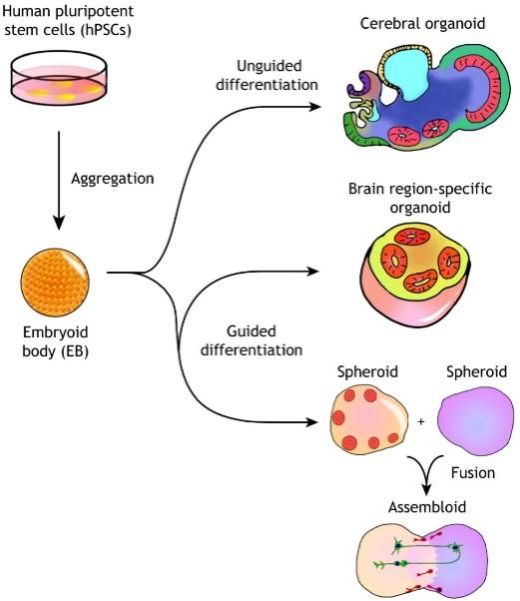
图A 目前诱导类器官的通用途径
尽管神经中枢的类器官发展飞快,但其结果和精细程度依旧无法真正与体内组织类比。而大部分神经中枢系统类器官都关注在大脑皮层上,对脊髓类器官的研究却相对缺乏。目前为止的人源躯干样类器官在形态发生上与体内接近,而偏向神经发育的人源脊髓类器官也在细胞类型和细胞成熟上与脊椎动物胚胎时期相似。但是两者似乎还没有得到一个比较好的结合。倘若源自中胚层的躯干表型与源自外胚层的神经特性相结合,是否能得到更像体内脊髓的组织呢?当然,获得一个与体内脊髓组织相仿的神经管类器官也更加有助于我们了解神经管发育机制以及研究发育疾病。

图B 该文章发表在Nature Biotechnology上
2023年9月14日,法国莫林研究所Stéphane Nedelec研究团队在Nature Biotechnology上发表了题为Self-organizing models of human trunk organogenesis recapitulate spinal cord and spine co-morphogenesis的文章,该文章讲述了他们如何建立了人躯干器官发生的自组织模型,展现了在人体外的脊髓和脊柱共形态发生。
1
要想实现类器官自发形成A-P轴向形态,首先要研究影响类器官A-P轴向形态的因素。之前的研究显示,TGF-β 和 BMP 信号通路的共同抑制可促进体内和体外的神经发生。也就是说,抑制这些通路可能会促使轴向祖细胞的细胞命运走脊髓神经。Nedelec等人尝试不添加这两种抑制剂,球体的类器官第4天就打破了对称性,并随着时间的推移逐渐呈现拉长的形状(Figure.1 a-c)。对比之下,如果同时抑制 BMP 和 TGF-β 途径,以及单独抑制后者,会导致球体在第 8 天时保持球状并形成运动神经元祖细胞的规格。第 4 天对聚集体进行的免疫染色显示,51.3±17% 聚集体的一侧选择性地存在轴向祖细胞样细胞 (CDX2/SOX2/TBXT),同时出现了表达神经祖细胞标记物的细胞 (SOX2/ TBXT−)和中胚层(CDX2/TBXT/SOX2−),包括体节前中胚层(PSM)(TBX6/SOX2−)。
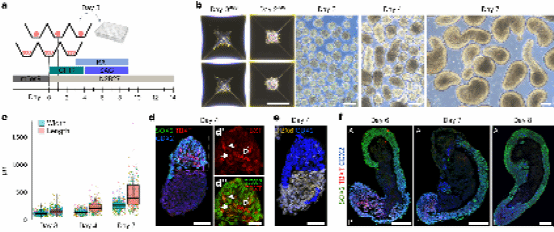
图 1. a-f
当结构继续发育时(第6、7和8天),轴向祖细胞样细胞仍位于一侧,但TBXT水平和阳性细胞数量逐渐减少(图1f)。中胚层和神经谱系在空间上进一步组织,神经祖细胞(SOX2、SOX1/3 或 PAX6)形成有组织的外周假复层神经上皮(图 1g、h),其中细胞获得了顶端-基底极性(图1i)。神经上皮没有形成神经管,而是保留了开放神经板典型的顶端向外组织。
另外,由于在第四天加入了SAG(诱导腹侧特性的因子),绝大多数神经细胞表达 NKX6.1(识别尾神经管的四个最腹侧祖细胞域)和 OLIG2(由该区域内的运动神经元祖细胞表达)(图 1j、k)。神经上皮下方的区域几乎完全由体细胞组成(图 1l-o)。综合来看,除了某些结构中罕见的细胞斑块外,所有细胞都采取了体细胞或神经命运。
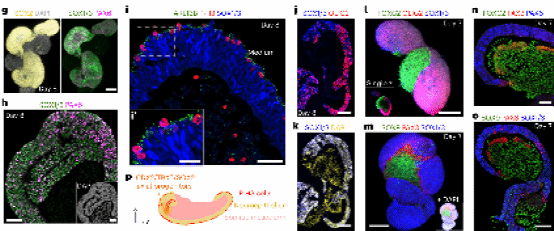
图 1. g-o
所以,研究人员认为WNT激动剂CHIR与内源性TGF-β信号传导配合来控制可控体积细胞聚集体的轴伸长和神经/中胚层分化。与脊椎动物躯干发育过程一样,轴向祖细胞位于生长结构的一极,脊髓神经上皮与体细胞一起逐渐形成。
2
为了控制上皮顶端-基底极性以及神经管和体节形态发生,研究人员将体节和/或脊髓发育的体外模型嵌入基质胶(一种基底膜基质)中,以促进类似体内的组。他们在第3天将单个球体包埋在基质胶滴中,超过 60% 的聚集体在第4天和第7天内开始伸长(图 2a),其最大延伸尺寸从 1,600 µm 到 2,300 µm(图 2b)。在第4天(包埋后第1天),在所有结构中均检测到轴向祖细胞 (SOX2/TBXT),并且在这个早期阶段极少数含有体细胞 (MEOX1)(图2c)。
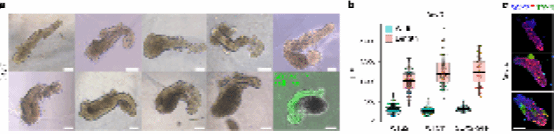
图 2. a-c
研究人员对第4天的细胞聚集体进行实时成像,观察到高度动态的伸长(图2d)。这种延伸过程与脊椎动物胚胎尾部延伸的过程颇为相似。另外,在基质胶中的神经上皮形成具有中央腔的管状形状(图2d)。随后,他们观察到管腔侧发生多次有丝分裂,随后细胞核向外部区域迁移(图 2e),体现神经上皮强烈的动态性,这一现象也在另一种细胞系的伸长动态中得到确认(图 2f)。成像后免疫染色显示所有延长的类器官中都存在神经管,其中 80% 周围有体细胞(图 2f)。
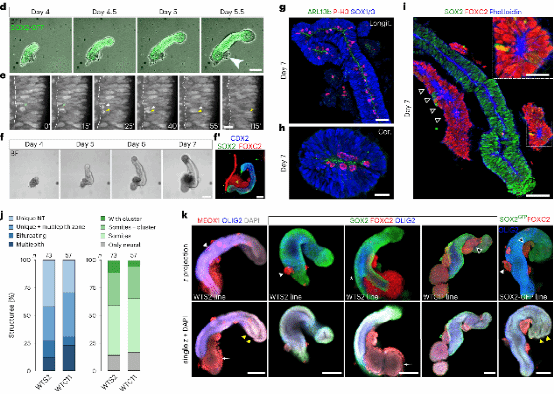
图 2. d-k
通过神经上皮管状组织的纵向和冠状切片,研究人员发现在包裹基质胶的情况下,神经祖细胞总是呈现与体内相似的顶端在里,基底在外的结构(图 2g、h)。并且,体细胞的组织发生了根本性的变化,形成单个分段体节或一串体节分布在神经管周围(MEOX1和FOXC2;图2i-k)。通过对对随机选择的结构(来自三个独立实验的 73 个)进行了整体染色,研究人员发现大部分的类器官中包含神经管结构,该结构有的与一侧的多个上皮细胞相连,有的分成两个明确识别的管(图2k),又或者形成其他形态(图 2j)。另外,在神经管周围还存在不同数量和形状的体节(图 2i-k)。
其实,无论是有基质胶存在抑或是没有的情况,轴向伸长和细胞命运范式是相似的(图1和图2),但在前者情况下,神经和体细胞谱系的形态和顶端-基底极性发生了实质性改变,与体内结构范式更为相似。
3
研究人员对Day7的基质胶嵌入类器官进行了单细胞和空间转录组测序,以进一步确定组织和细胞状态。分析显示在这些延伸类器官中存在轴向祖细胞、神经祖细胞、神经元、神经嵴细胞以及中胚层衍生细胞,包括体细胞、内皮细胞、心脏和肾元祖细胞(图3a、b)。而一些前神经细胞类型、脊索细胞以及内胚层衍生细胞缺失。
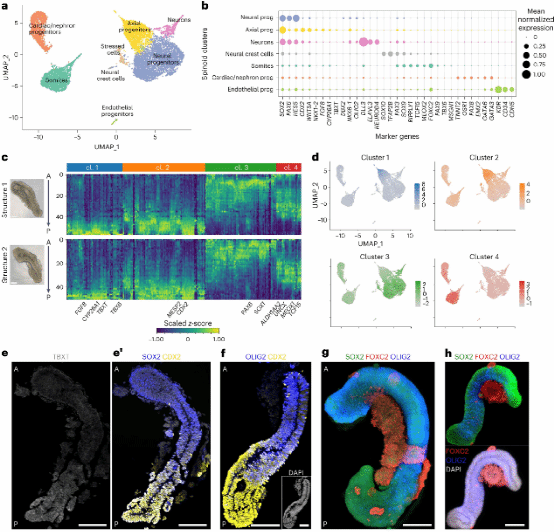
图 3. a-h
随后,研究人员利用RNA断层扫描(tomo-seq)进行了空间转录组学分析这些类器官中细胞的分化轨迹是与脊椎动物胚胎空间组织相似,还是采用体外特异性组织 (图3c)。分析发现大约1000个基因显示出可重复的表达模式(图3c)。这些基因分成四组。在UMAP中,四个簇彼此分离,这表明不同的细胞状态沿着AP轴存在差异(图3d)。
研究人员在后端检测到轴向祖细胞和PSM的相关基因,而在前端的细胞则主要表达与早期前神经管和PSM相关的基因。从空间转录组与单细胞RNA测序(scRNA-seq)联合结果表明,神经/中胚层分化轨迹是沿着A-P轴进行空间组织的,与脊椎动物胚胎的模式相似。免疫染色结果也印证了相似的结论(图3e-h)。
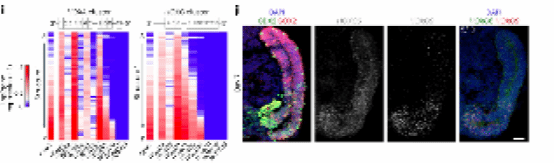
图 3. i-j
在胚胎中,AP轴的延伸与HOX转录因子的模式相结合,HOX转录因子沿着机体分配细胞多样性3,4。HOX基因在基因组中是聚集的,并根据其染色体位置沿延伸的AP轴有差异表达,3 '基因比5 '基因表达更早3。研究人员为了确定这种体外躯干伸长和形态发生是否与AP模式机制相关,使用tomo-seq数据分析了HOX簇的表达谱。他们发现AP表达模式与脊椎动物胚胎相似(图3i)。这些结果表明,不同的类器官在不同程度的轴向延伸到尾胸椎或腰椎水平。
总的来说,类器官在分化过程中形成了一个高度组织和模式化的AP轴,且观察到的发育模式和空间组织与脊椎动物胚胎相似。
4
现阶段发表的模拟躯干形态发生的小鼠和人类模型似乎没有发展到早期神经和躯体前体细胞阶段5,6,7,这可能造成它们在研究躯干器官发生方面的局限性。研究人员对他们的类器官进行测试,研究其中的分化范式是否能得到更优结果。
研究人员将嵌入基质胶以及不嵌入基质胶的躯干结构进行了额外一周的培养,即培养至第14天。在非基质胶条件下,外部神经上皮得以保留,继续发育的结构与第 7 天神经上皮的顶端-基底极性一致。然而,这些非嵌入的类器官容易折叠,使其空间组织的分析复杂化。相比之下,在嵌入基质胶的条件下,所有延伸的类器官中仍可检测到神经管组织(图4)。与第7天相比,神经前体细胞(OLIG2)现在出现在神经管的内侧,而有丝分裂后运动神经元(HB9/ISL1)位于外基底侧,与胚胎发生第四周时在体内观察到的组织颇为相似8(图4a、b)。
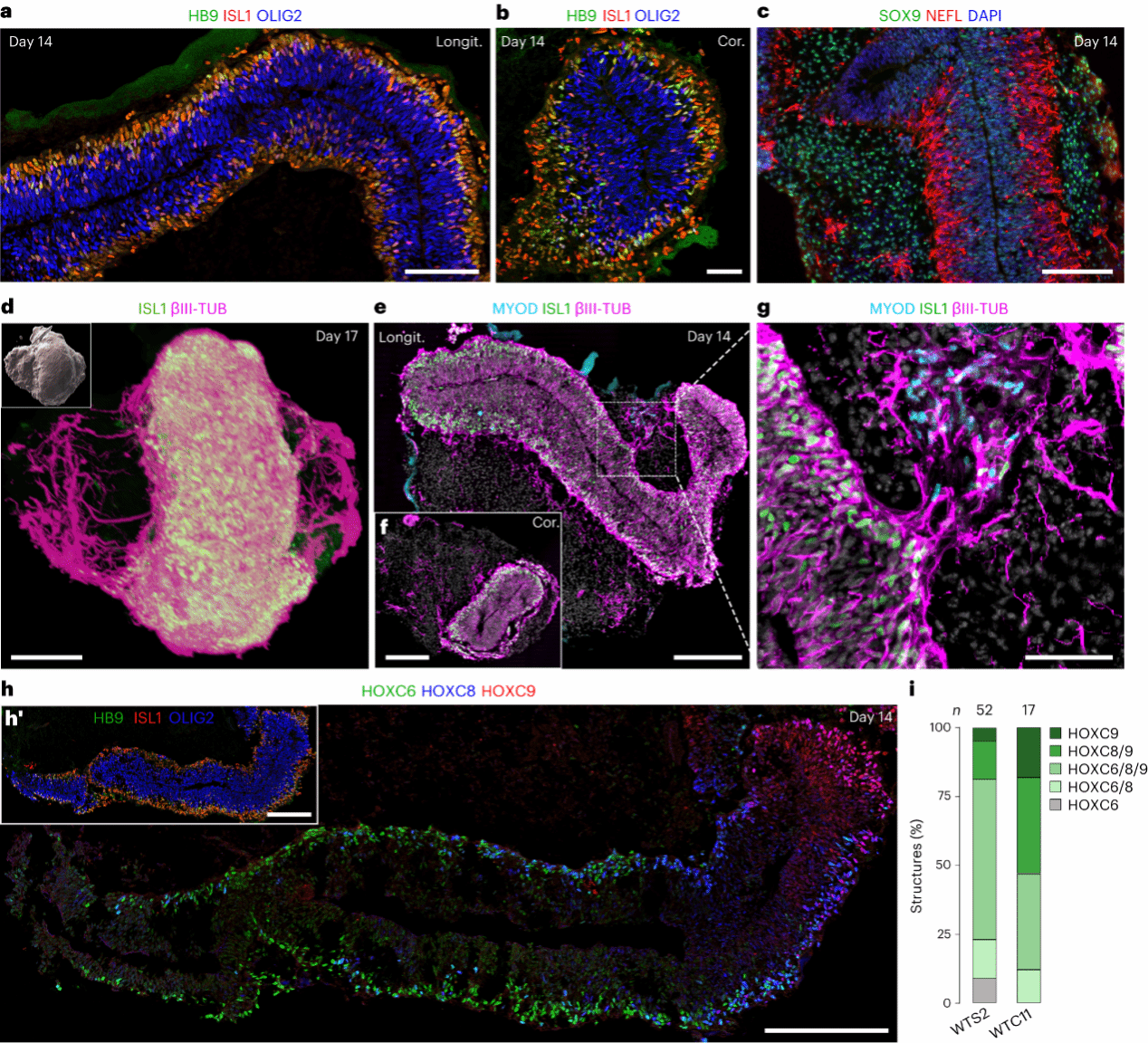
随后,研究人员又进行了低温切片分析以及透明类器官的 3D 重建,发现突出神经管外并侵入周围的神经突(NEFL 和 βIII-微管蛋白)(图 4c-e),这也与神经管周围存在有丝分裂后神经元一致的结果相对应。该外周组织绝大多数由软骨细胞或其祖细胞 (SOX9) 组成(图 4c)。另外,他们还在部分类器官中观察到成肌细胞簇(肌纤维的前体)(MYOD;图 4e、g),这些簇出现的时候总是被神经突包围(图4e、g)。
在发育过程中,HOX mRNA 的空间模式被翻译成 HOX 转录因子的定型表达域,指导细胞沿体轴的身份。之前的研究表明,与小鼠一样,HOXC6/C8/C9/C10 识别沿着人类胚胎脊髓的不同运动神经元亚群9。因此,研究人员在第14天观察 HOXC6、HOXC8 和 HOXC9 的空间分布(图 4h,i)。这些模式始终与 HOX 基因组位置对应。因此,AP模式形成的序列与在体内观察到的完全相同。
以上研究结果表明,神经管和体节的发育可以超过早期的前体细胞阶段,并且系统的自组织能力在主干发育的后期继续发展。2周后,祖细胞和神经元的组织方式与人类胚胎发生第四周时沿AP轴的组织方式相似。
总结
这个研究通过改变培养条件获得hiPSC衍生的自组织、多胚层系统,该系统可作为人类脊柱和脊髓共同发育的研究模型。研究中的类器官并非是传统的球形,而是延伸形成AP轴,与胚胎尾部发育过程相似。体细胞和脊髓神经谱系沿着延伸的轴向前组织,并以 ECM 依赖性方式自组装成被体节包围的模式化神经管。实验模型在两周后与妊娠第四周结束时人类脊髓发育模式较为相似,表明该模型再现了胚胎发育的某些方面。该模型与之前的PSC衍生的3D脊髓和/或体节发育模型不同,它概括了两个谱系的形态共发生和AP轴模式,可以较好地再现直至分化末期的体内样组织和细胞类型组织。这个研究还确定了控制这些过程的几个参数,这有助于合理化先前躯干组织生成模型之间的差异。
尽管没有胚胎外组织、内胚层、脊索或前神经细胞类型,这个类器官模型高度的自组织水平表明这些过程在神经/中胚层谱系内部分是自主的。然而,这个模型的神经管,尤其是体节,在某种程度上并不像体内那样牢固地组织起来。它们的数量和组织因类器官而异(图 2 和图 3)。胚胎的形状以及缺失的胚胎和胚胎外组织提供的机械约束可能参与了与组织结构的稳定性相关10,11。因此,该模型将提供一个系统来研究控制体节和神经管形态发生的机制,以及在正常发育和病理发育(例如神经管缺陷)期间这两个过程的相互依赖性。
总的来说,这篇文章所获得的人类躯干发育的自组织模型应该有助于捕捉脊柱和感觉运动神经回路共同发育和疾病的多系统方面。以前基于自组织的类器官模型,包括脑类器官,很难再现高阶组织形态发生以及末端细胞类型的大尺度结构组织,这是该领域的一个重要限制。他们的工作表明,3D自组织模型可以通过定义控制细胞命运和形态发生的途径来实现这些复杂事件的许多方面,为开发更先进的人类器官发生模型开辟道路。
参考文献:
1.Takahashi K, Yamanaka S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 2006 Aug 25;126(4):663-76. doi: 10.1016/j.cell.2006.07.024. Epub 2006 Aug 10. PMID: 16904174.
2.Lancaster MA, Renner M, Martin CA, Wenzel D, Bicknell LS, Hurles ME, Homfray T, Penninger JM, Jackson AP, Knoblich JA. Cerebral organoids model human brain development and microcephaly. Nature. 2013 Sep 19;501(7467):373-9. doi: 10.1038/nature12517. Epub 2013 Aug 28. PMID: 23995685; PMCID: PMC3817409.
3.Deschamps J, Duboule D. Embryonic timing, axial stem cells, chromatin dynamics, and the Hox clock. Genes Dev. 2017 Jul 15;31(14):1406-1416. doi: 10.1101/gad.303123.117. PMID: 28860158; PMCID: PMC5588924.
4.Philippidou P, Dasen JS. Hox genes: choreographers in neural development, architects of circuit organization. Neuron. 2013 Oct 2;80(1):12-34. doi: 10.1016/j.neuron.2013.09.020. Epub 2013 Oct 2. PMID: 24094100; PMCID: PMC3835187.
5.Miao Y, Djeffal Y, De Simone A, Zhu K, Lee JG, Lu Z, Silberfeld A, Rao J, Tarazona OA, Mongera A, Rigoni P, Diaz-Cuadros M, Song LMS, Di Talia S, Pourquié O. Reconstruction and deconstruction of human somitogenesis in vitro. Nature. 2023 Feb;614(7948):500-508. doi: 10.1038/s41586-022-05655-4. Epub 2022 Dec 21. PMID: 36543321; PMCID: PMC10018515.
6.Sanaki-Matsumiya M, Matsuda M, Gritti N, Nakaki F, Sharpe J, Trivedi V, Ebisuya M. Periodic formation of epithelial somites from human pluripotent stem cells. Nat Commun. 2022 Apr 28;13(1):2325. doi: 10.1038/s41467-022-29967-1. PMID: 35484123; PMCID: PMC9050736.
7.Veenvliet JV, Bolondi A, Kretzmer H, Haut L, Scholze-Wittler M, Schifferl D, Koch F, Guignard L, Kumar AS, Pustet M, Heimann S, Buschow R, Wittler L, Timmermann B, Meissner A, Herrmann BG. Mouse embryonic stem cells self-organize into trunk-like structures with neural tube and somites. Science. 2020 Dec 11;370(6522):eaba4937. doi: 10.1126/science.aba4937. PMID: 33303587.
8.Rayon T, Stamataki D, Perez-Carrasco R, Garcia-Perez L, Barrington C, Melchionda M, Exelby K, Lazaro J, Tybulewicz VLJ, Fisher EMC, Briscoe J. Species-specific pace of development is associated with differences in protein stability. Science. 2020 Sep 18;369(6510):eaba7667. doi: 10.1126/science.aba7667. PMID: 32943498; PMCID: PMC7116327.
9.Mouilleau V, Vaslin C, Robert R, Gribaudo S, Nicolas N, Jarrige M, Terray A, Lesueur L, Mathis MW, Croft G, Daynac M, Rouiller-Fabre V, Wichterle H, Ribes V, Martinat C, Nedelec S. Dynamic extrinsic pacing of the HOX clock in human axial progenitors controls motor neuron subtype specification. Development. 2021 Mar 29;148(6):dev194514. doi: 10.1242/dev.194514. PMID: 33782043; PMCID: PMC8034877.
10.Rifes P, Carvalho L, Lopes C, Andrade RP, Rodrigues G, Palmeirim I, Thorsteinsdóttir S. Redefining the role of ectoderm in somitogenesis: a player in the formation of the fibronectin matrix of presomitic mesoderm. Development. 2007 Sep;134(17):3155-65. doi: 10.1242/dev.003665. Epub 2007 Aug 1. PMID: 17670788.
11.Nikolopoulou E, Galea GL, Rolo A, Greene ND, Copp AJ. Neural tube closure: cellular, molecular and biomechanical mechanisms. Development. 2017 Feb 15;144(4):552-566. doi: 10.1242/dev.145904. PMID: 28196803; PMCID: PMC5325323.
本文作者:邵志成组杜嘉程