蒹葭苍苍,白露为霜。所谓伊人,在水一方。溯洄从之,道阻且长。
——《诗经▪国风》
帕金森病(Parkinson disease, PD)是第二大神经退行性疾病。1817年,英国病理学家James Parkinson首次报道了这种疾病,该病以主动运动功能障碍、运动迟缓、自发性静息震颤、佝偻和步态异常为典型特征。流行病学调查显示,我国65岁以上人群患病率为1.7%,全国约有270~300万患者,而到2030年预计将增加到500万人,是一个不容忽视的公众健康问题。最近,一项来自中国科学院深圳先进技术研究院路中华/戴辑/鲍进团队的研究开创了一种全新的“溯洄从之”的环路特异性化学遗传干预手段,沿轴突逆行标记并特异性操控一类神经元,成功在小鼠和食蟹猴上缓解PD症状,为PD的治疗带来了一缕新的曙光。

自PD发现后的两百多年来,众多杰出的科学家投身于PD的病理和临床研究,使得我们对于这种疾病的认识逐渐完善,到上世纪九十年代初,基底神经节(basal ganglia,BG)中运动控制的环路模型逐渐清晰。在这个经典模型中,纹状体存在两种分别表达D1和D2型多巴胺受体(Drd1/2)的中型多棘神经元(medium spiny neurons,MSN)。D1-MSNs介导了促进运动的直接通路,而D2-MSNs介导了抑制运动的间接通路。直接和间接通路分别扮演了“油门”和“刹车”的角色,二者互相协调控制运动功能。PD患者的间接通路往往被过度激活,而直接通路被过度抑制,这种失衡导致患者的运动一直被“踩住刹车”,因而出现各种运动障碍。既然如此,一个直接的干预手段就是特异性地激活直接通路,给患者的运动控制“踩下油门”。
事实上,如外科手术般精准的特异性干预手段也是从事神经疾病和环路功能研究的科学家们的共同追求。在啮齿动物模型中,我们可以通过遗传改造转入细胞特异性重组酶系统实现靶向干预,然而这种方法在人类身上行不通。幸运的是,控制不同功能的神经环路往往有着不同的连接结构,这种环路本身的结构差异也可能成为靶向干预的基础。直接通路D1-MSNs的轴突特异性地投射到内侧苍白球(internal globus pallidus,GPi)和黑质网状部(substantia nigra pars reticulata,SNr);而间接通路的D2-MSNs则特异性地投射到外侧苍白球(external globus pallidus,GPe)。理论上我们可以利用这种轴突投射的差异,从SNr接收的轴突末梢“逆流而上”,靶向地“抓住”纹状体中的D1-MSNs,而不影响D2-MSNs。
在这一思路的指导下,研究团队基于定向进化的策略开发了一套高效AAV逆向标记系统,可以高效地从SNr沿着轴突逆向标记纹状体D1-MSNs,由于D2-MSNs的轴突末梢远在GPe,D2-MSNs将不会被标记。随后在改造的全新MSN强启动子G88P2/3/7的帮助下,被标记的D1-MSNs可以稳健表达化学遗传元件hM3Dq。通过静脉注射氯氮平-N-氧化物(CNO),就可以诱导表达了hM3Dq的D1-MSNs特异性激活,而D2-MSNs不受影响(原文图2),从而靶向激活直接通路,改善运动症状。
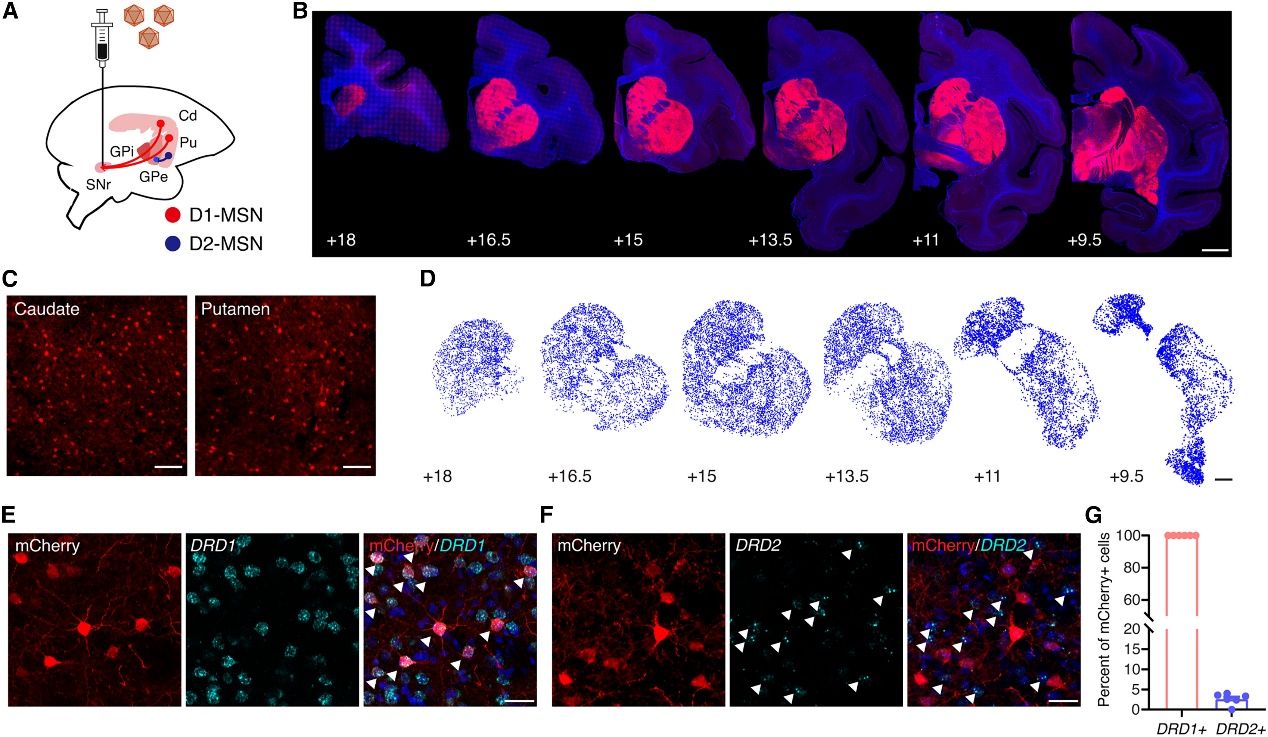
原文图2食蟹猴黑质注射AAV8R12后D1-MSNs的稳健标记
实验结果表明,在小鼠SNr单侧注射经改造的AAV8R12-G88P3-HA-hM3Dq病毒后,大部分被标记的神经元位于纹状体中,且所有被标记的神经元均为Drd1阳性。离体脑片电生理记录显示,给予CNO后,AAV8R12-G88P3-HA-hM3Dq- 2A-EYFP转导的MSNs的兴奋性增强,而不影响基础放电率或静息膜电位,表明该策略可以特异性地兴奋纹状体D1-MSNs。然而,出乎意料的是,在行为学上并没有观察到给药后预期的对侧旋转增加,反而出现了对侧旋转减少,这表明直接通路被抑制或者间接通路被激活。研究团队发现这是病毒注射位点SNr的神经元被顺带标记导致的。SNr是基底神经节主要的抑制性输出核团,在生理条件下,SNr持续向下游的丘脑和运动皮层输出紧张性抑制信号,同时它也接受来自纹状体MSN的抑制性输入,当直接通路的D1-MSNs激活时,会增加对SNr的抑制,从而解除SNr对下游丘脑和运动皮层的抑制。如果被顺带标记的SNr被化学遗传激活,显然会增加运动抑制,这与我们的目的完全相悖。为了解决这个问题,我们必须避免SNr被顺带激活,这样我们又回到了那个棘手的问题面前——如何特异性地操控神经元。
幸运的是,研究团队找到了一个精妙的解决办法。化学遗传操控元件普遍是改造的GPCR,依赖于不同的G蛋白激活不同的第二信使来发挥改变神经元活动的功能。hM3Dq使用钙离子作为第二信使,而钙信号可以改变绝大多数神经元的活性,包括SNr神经元。另一种化学遗传元件rM3Ds像Drd1一样使用cAMP作为第二信使,在表达Drd1受体的MSN中可以有效激活神经元,但是在SNr中难以发挥功能。这样一来,就可以避免SNr被顺带激活。随后的实验结果表明,AAV8R12- G88P7-rM3Ds-2A-EYFP表达后确实可以通过小鼠全身注射CNO特异性地操控D1-MSNs神经元而不影响SNr,并且在行为学上可以产生稳定的预期效果(原文图3)。

原文图3化学遗传激活D1-MSNs影响小鼠运动
难能可贵的是,研究团队没有止步于小鼠实验,他们还在灵长类动物食蟹猴上检测了这套环路特异性化学遗传操控系统的效果。将AAV8R12-G88P7-rM3Ds-2A-EYFP单侧注射到食蟹猴的SNr后,大部分被标记的神经元位于纹状体,且所有被标记的纹状体神经元均为Drd1阳性;麻醉状态下的在体电生理记录表明D1-MSNs可以在局部或全身给予CNO的情况下被激活;行为学实验也出现了强烈的对侧旋转增加现象,与预期相符。这些结果表明这套操控系统确实可以达到特异性干预直接通路D1-MSNs,影响运动的功能(原文图4)。

原文图4 化学遗传激活D1-MSNs影响灵长类动物运动
随后,为了研究该方法应用于PD治疗的有效性和安全性,研究人员首先通过双侧纹状体注射6-羟基多巴胺(6-OHDA)的方式,消除成年小鼠黑质多巴胺能神经元,诱导帕金森模型。然后注射AAV8R12-G88P7-rM3Ds-2A-EYFP到小鼠SNr,通过给予CNO激活rM3Ds,特异性地激活直接通路,成功实现了PD小鼠症状的有效缓解,包括运动迟缓表型的缓解(原文图 5D–5F),转棒实验中的运动能力改善(原文图5G)等。脑片全细胞膜片钳记录显示,注射AAV8R12-G88P7-rM3Ds-2A-EYFP的小鼠D1-MSNs兴奋性增高,而对照组注射AAV8R12-G88P7-EYFP的小鼠D1-MSNs兴奋性不变,帕金森病表型也未能得到缓解 (原文图 5H–5K)。 这些结果表明,靶向激活BG直接通路与逆行AAV介导的化学遗传干预可以有效地改善帕金森病啮齿动物模型的症状。

原文图5 化学遗传激活D1-MSN逆转小鼠帕金森病症状
尽管许多潜在的干预措施在啮齿动物模型上都被证实有效,但是它们中的大部分都未能通过临床试验。因此,研究人员在灵长类PD模型中评估了该方法的临床潜力。首先在成年食蟹猴上通过MPP+注射的方式,构建典型的灵长类PD模型。造模后的食蟹猴表现出运动迟缓、震颤、僵硬和姿态异常等症状。在SNr注射并表达AAV8R12-G88P7-rM3Ds-2A-EYFP后,使用地氯氮平(deschloroclozapine,DCZ)激活食蟹猴脑中的rM3Ds(DCZ是一种有效的跨血脑屏障rM3DS激动剂,与CNO相比,脱靶结合更少),发现DCZ可以诱导MPP+造模的食蟹猴神经元活性增加(原文图 6D–6H)。系统性给予DCZ能逆转受试猴的典型PD症状 (原文图 6I–6S),并且使得自发活动能力增加至注射MPP+之前的水平(原文图 6K–6O)。另外,DCZ明显减轻或消除震颤行为(原文图 6J, 6P–6R),使得食蟹猴的运动能力显著恢复(原文图 6J,6S)。非常重要的是,该研究证实此方法能在长达8个月的时间里稳定维持运动改善的疗效(原文图 6T–6X)。这些数据有力地证实了该方法在逆转灵长类帕金森病模型的核心疾病表型中的安全性和有效性。
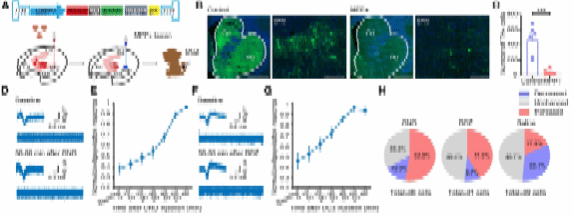
原文图6 D1-MSNs的化学遗传学激活逆转了食蟹猴的帕金森症状
考虑到服用左旋多巴(Levodopa, L-Dopa)是目前PD临床治疗的首选,该研究还比较了靶向激活BG直接通路与左旋多巴的治疗效果。结果显示,虽然两种方法对帕金森症状的逆转效果相似(原文图 7A),但在给药的初始阶段,DCZ介导的靶向激活显示出更快的治疗效果(原文图 7B)。在药物达到稳定疗效后,DCZ延长了单位剂量治疗后的疗效窗口,在给药后至少24小时都能持续缓解运动症状(原文图 7C),远长于临床观察到的左旋多巴治疗窗口。在药物注射后24小时采集脑脊液样本,没有在脑脊液中检测到DCZ (原文图 7D),这表明靶向干预后的神经网络动态发生了变化或残留在受体上的DCZ显著延长了治疗效果。此外,与长期服用左旋多巴不同,该方法没有引起类似异动症的行为 (原文图 7E)。关键的是,延长服用左旋多巴的时间(4个月)并不影响DCZ的疗效 (原文图 7F-7L)。这些结果证实了靶向激活BG直接通路与逆行AAV介导的化学遗传学方法在灵长类 PD模型中的有效性,并支持其用于治疗人类PD的潜力。
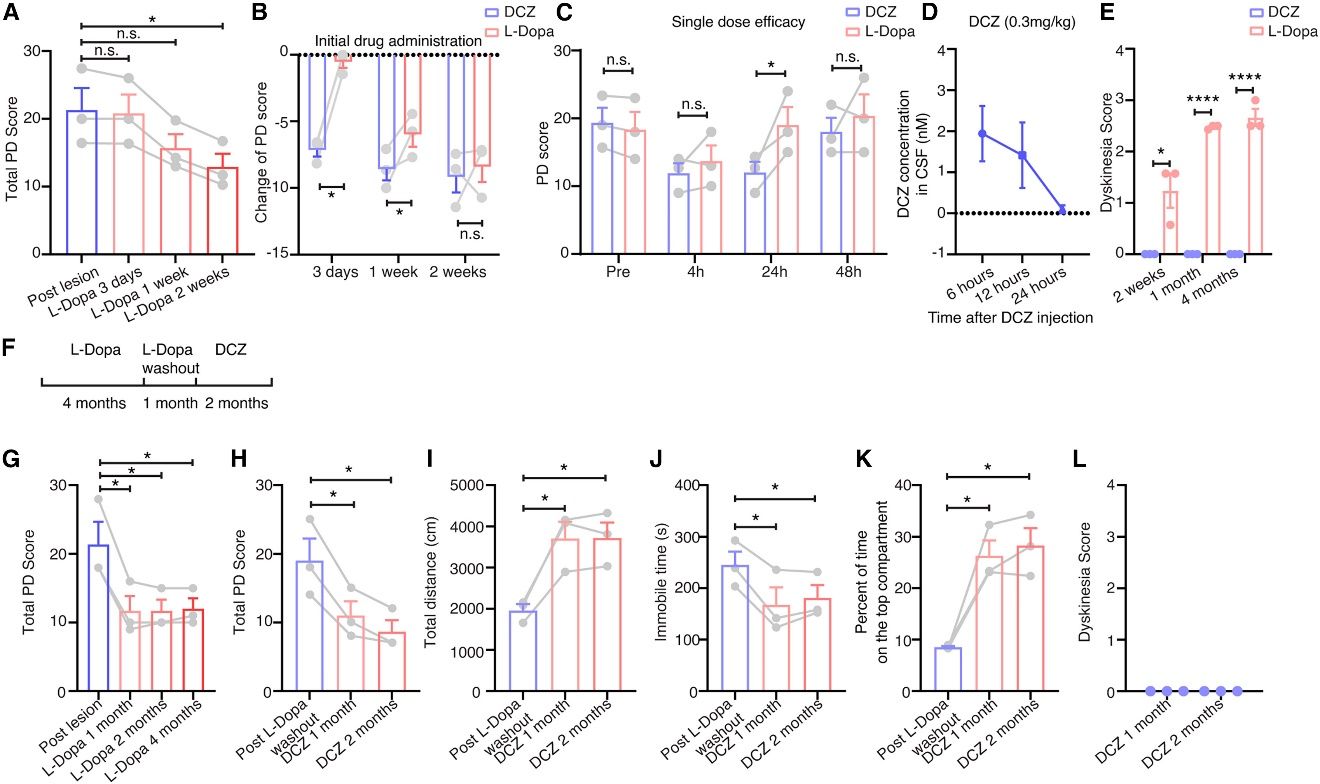
原文图7 在灵长类动物中的安全性和有效性
结语:
干预的特异性不足是目前PD治疗面临的重要问题,作为PD治疗首选的左旋多巴对中枢非BG多巴胺系统和外周多巴胺系统的影响导致了许多副作用。本研究提出的靶向 D1-MSN 的环路特异性化学遗传方法可以精准调节BG直接通路,而不影响体内其他多巴胺途径,从而避免左旋多巴引起的副作用。除此之外,这种操纵神经环路的方法不仅效果显著,而且起效更快、持续时间更长,具备良好的临床应用潜力。
在设计上,本研究提出的基于环路结构特异性靶向操纵神经元和环路的手段简明且富有逻辑美感。众所周知,结构是功能的基础,对于环路而言亦是如此,功能的差异往往与环路连接结构的区分相偶联。如果我们“溯洄从之”,从下游的投射末梢“顺藤摸瓜”找到上游特定类群的神经元,就有可能实现特异性地干预。这种开创性的策略有可能改变PD治疗的格局,并为开发针对其他重大脑疾病的特异性的、基于环路的治疗策略提供新的启发。但是我们也应该注意到,这种新干预手段距离真正的临床应用还有相当长的路要走,AAV载体的安全性以及更长久时间内的疗效维持都还是悬而未决的问题,正所谓“溯洄从之,道阻且长”。科学探究的道路正是这样曲折而漫长,在坎坷之中坚定地向前进展。路漫漫其修远兮,吾将上下而求索。
参考文献
1.Chen, Yefei et al. “Circuit-specific gene therapy reverses core symptoms in a primate Parkinson's disease model.” Cell vol. 186,24 (2023): 5394-5410.e18. doi:10.1016/j.cell.2023.10.004
2.DeLong, Mahlon R, and Thomas Wichmann. “Basal Ganglia Circuits as Targets for Neuromodulation in Parkinson Disease.” JAMA neurology vol. 72,11 (2015): 1354-60. doi:10.1001/jamaneurol.2015.2397
3.Przedborski, Serge. “The two-century journey of Parkinson disease research.” Nature reviews. Neuroscience vol. 18,4 (2017): 251-259. doi:10.1038/nrn.2017.25
4.韩济生等 《神经科学 第四版》 北京大学医学出版社ISBN 978-7-5659-2725-6