引言
碱基编辑器(base editor)如同一把“基因手术剪”,使得人们可以精确地修改DNA链中的特定碱基,以达到修改或增强目标基因的效果,对于研究基因功能和治疗遗传性疾病具有重要意义。
这把“手术剪”的型号可谓是多种多样,并在研究中不断更新迭代。其中,胞嘧啶碱基编辑器(Cytosine base editor, CBE)和腺嘌呤碱基编辑器(Adenine base editor, ABE)是两个重要的分支,分别能够实现由胞嘧啶(C)到胸腺嘧啶(T)、腺嘌呤(A)到鸟嘌呤(G)的精确编辑。而这一过程的实现,依赖于DNA碱基脱氨基后的复杂修复机制。除此之外,研究者们又设计出CGBE、AYBE和gGBE等“手术剪”,分别能够产生C-to-G、A-to-Y (Y=C or T)及G-to-Y的碱基转换。虽然已经开发出了许多不同型号的“手术剪”,但其仍存在一些局限。例如,目前大多数碱基编辑器使用脱氨酶会引发非Cas9依赖性脱靶效应。为了规避这一风险,已有团队开发了不依赖脱氨酶的新型碱基编辑器。
2024年1月2日,中国科学院天津工业生物技术研究所毕昌昊团队和张学礼团队合作,在 Nature Biotechnology 期刊发表了题为:Glycosylase-based base editors for efficient T-to-G and C-to-G editing in mammalian cells 的研究论文。
该研究通过定向进化改造人源尿嘧啶糖基化酶(UNG),开发了不依赖脱氨酶(deaminase-free,DAF)的新型碱基编辑器——DAF-CBE和DAF-TBE,分别在大肠杆菌中实现C-to-A、T-to-A的碱基颠换,在哺乳动物细胞中实现C-to-G、T-to-G的碱基颠换编辑。

糖基酶接力脱氨酶
现开发出的CGBE是利用脱氨酶产生的尿嘧啶(U),从而形成一个启动DNA修复过程的嘌呤/嘧啶(AP)位点,引起C-to-G的编辑。比起从脱氨酶去氨基的角度切入,研究团队另辟蹊径,希望通过对核糖的五碳糖核心下手实现编辑。他们试图寻找合适的胞嘧啶 DNA 糖基化酶(CDG),通过将CDG与nCas9 (nicking Cas9)融合实现 C 到 G 的编辑而无需脱氨。由于自然界中尚无CDG,他们将改造细胞中存在的尿嘧啶糖基化酶(UNG)作为研究的起点,并通过点突变的方式获得了低活性的CDG和胸腺嘧啶 DNA 糖基化酶(TDG)。
尽管理想很美好,但初步获得的CDG1-nCas9和TDG1-nCas9系统其碱基编辑效率微乎其微,这很有可能是因为CDG与TDG的活性太低导致。因此他们采用David Liu团队的蛋白进化方法对初始版本的CDG与TDG进行改造。通过在色氨酸合成酶(TrpB)的β-亚基中引入一个终止突变,如此以来,只有成功编辑的细胞(即终止突变被逆转)才能在简单M9培养基中生长。CDG-nCas9/TDG-nCas9基因有益突变逐渐累积,其活性在进化过程中不断增强(Fig.1b)。
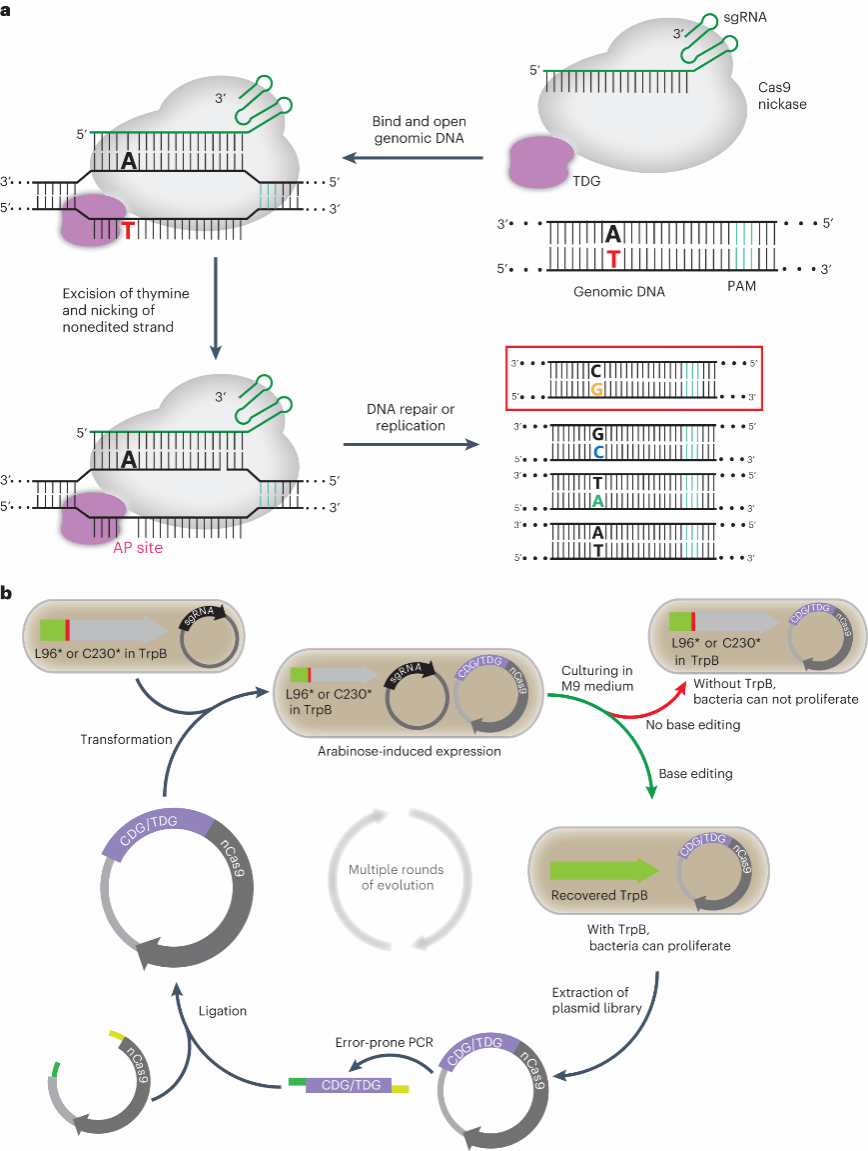
Fig. 1: Design and evolution of CDG-nCas9/TDG-nCas9 in E. coli.
随后,他们通过易错PCR编辑CDG1/TDG1,并分别与nCas9融合形成CDG1/TDG1-nCas9突变库。在大肠杆菌中经过25轮进化实验后,选择约100株含有CDG-nCas9/TDG-nCas9的突变体在富集培养基中进行碱基编辑测试,对可编辑4-6个碱基位点的CDG-nCas9s/TDG-nCas9s进行进一步评价,最终获得了最高效的两个突变体——CDG4-Cas9与TDG3-Cas9,其在大肠杆菌中的编辑效率分别高达58.7%和54.3% (Fig.2)。

Fig. 2: Evaluation of the most efficient CDG-nCas9s/TDG-nCas9s in E. coli.
研究团队将上述获得的两种高效的碱基编辑器命名为DAF-CBE和DAF-TBE,并将这两个体系引入人源细胞中。他们分别运用DAF-CBE/DAF-TBE对HEK293T染色体上70个/127个基因位点进行编辑。研究人员成功观测到了不同种类的C/T碱基编辑。进一步分析表明,DAF-CBE 对C-to-G的编辑更倾向于在NCT模体中发生,DAF-TBE对T-to-G的编辑更倾向于在ATN和NTT模体中发生(Fig.3a,b)。
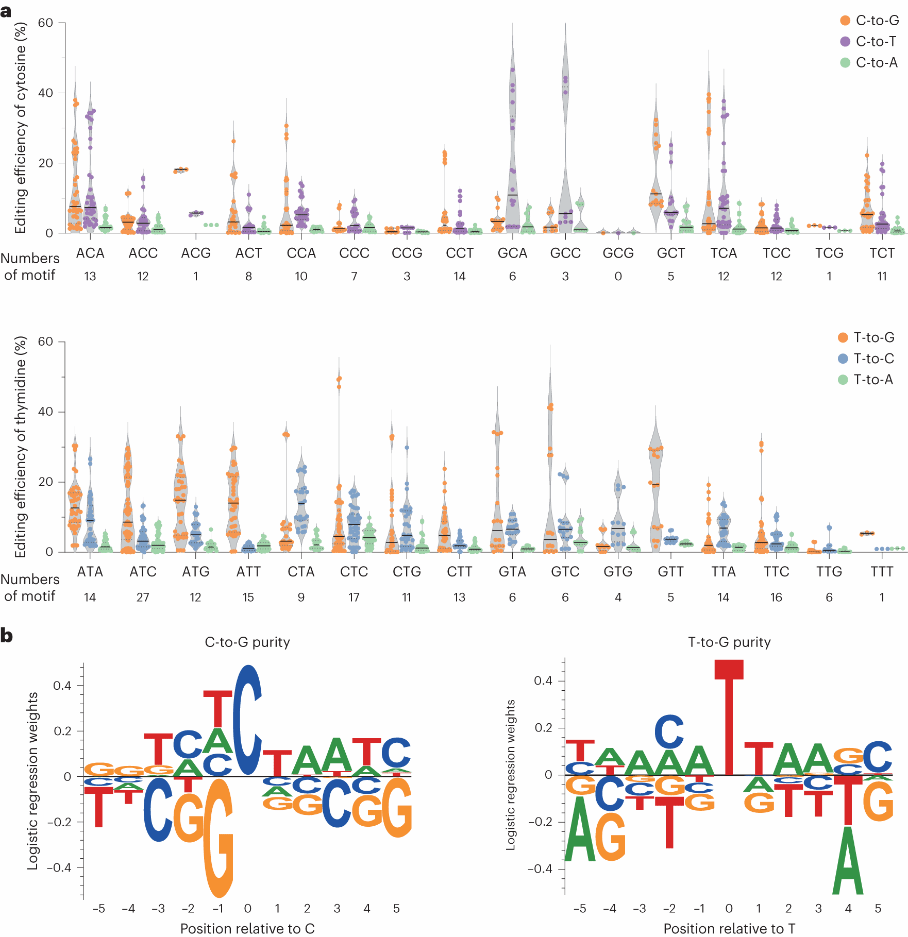
Fig. 3: Characterization of DAF-CBE and TBE editing activities in HEK293T cells.
更安全的碱基编辑器
在证明了DAF-BE的可行性后,研究人员将其与其他碱基编辑工具进行了对比。此前,CGBE与PE(先导编辑,Prime Editor)均被报道能实现特定的编辑,后者理论上可以编辑全部四种碱基。通过比较HEK293T基因组上6个位点的C-to-G编辑效率,结果表明,DAF-CBE与CGBEs在不同位点上的编辑效率及纯度各具优势,不过DAF-CBE在特定位点的编辑效率显著更高(Fig.4a)。PE与CGBEs比较结果相似(Fig.4b)。
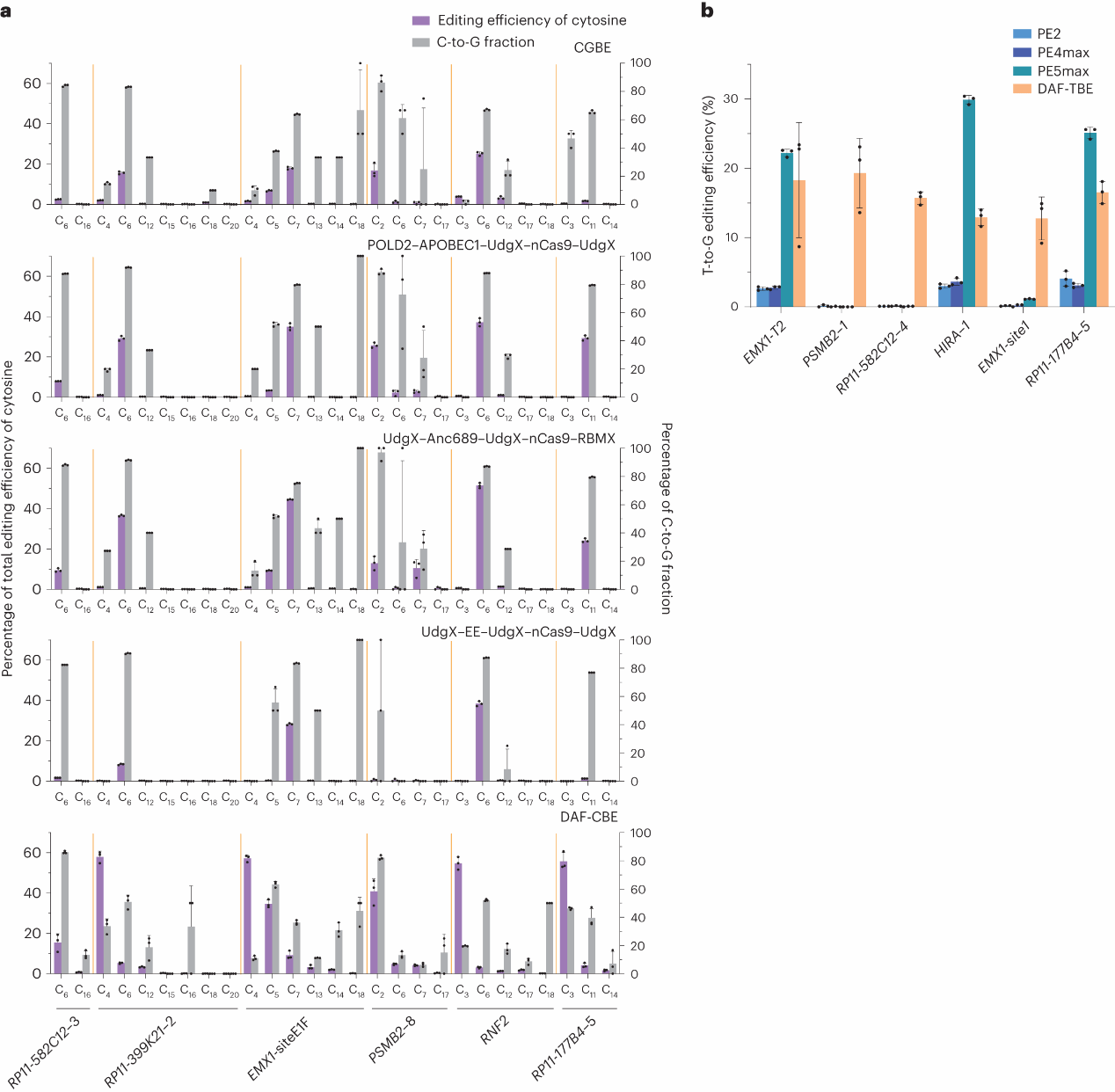
Fig. 4: Comparison of DAF-CBE with CGBEs and DAF-TBE with PEs.
独立于Cas9的脱靶编辑效应(CIOE)是碱基编辑器的风险指标之一,其会导致细胞中出现意外的突变。在脱靶率方面,DAF-CBE在与另外两款CBE (BE4max23和CGBE)的对比中表现出了明显的优势,且DAF-TBE的脱靶率与对照组相比并没有显著的增加。此外,RNA的脱靶结果显示,DAF-BEs与空白对照相比并没有显著的脱靶编辑。上述结果表明,DAF-BEs具有较低的CIOE效率,可以开发为更安全的碱基编辑工具。
潜力巨大的“手术剪”
为了验证DAF-BE的临床应用潜力,研究人员构建了疾病相关且源自非癌细胞系的人类诱导多能干细胞(hiPSCs)的单核苷酸变异(SNVs)模型。他们首先从ClinVar数据库中为DAF-CBE和DAF-ABE分别选择了3个与疾病相关的SNVs,并将DAF-CBE/DAF-TBE及与之匹配的sgRNAs共同引入hiPSCs,成功在特定位点产生致病性SNVs (Fig.5)。
进一步探究DAF-BEs校正致病SNVs的能力,研究人员构建了含致病性变异的稳定细胞系,同时将DAF-BEs中的Cas9 nickases替换成SpRY nickases (SpRY-DAF-BEs)。结果显示,SpRY-DAF-CBE在特定疾病突变的纠正效率甚至高达36.4%。
由于SpRY这种PAM扩展的Cas9突变体存在潜在的脱靶风险,研究人员比较了DAF-CBE/TBE和SpRY-DAF-CBE/TBE的Cas9依赖型脱靶效率。结果表明,在三个特定位点上,SpRY-DAF-CBE的脱靶效率显著超越DAF-CBE。而对于SpRY-DAF-TBE和DAF-TBE,两者在脱靶效率上各有一个位点表现更优,其余位点则未观察到显著差异。
综上,DAF-BEs在SNVs的校正方面展现出了高效且准确的能力,有潜力应用于生物医学和基因治疗。

Fig. 5: Construction of pathogenic SNVs by DAF-BEs in hiPSCs.
DAF-BE的2.0版本
鉴于DAF-BEs在编辑效率和产物纯度方面存在的不足,以及其编辑窗口的局限性,作者推测,通过改良糖基化酶与nCas9的融合方式,有望提升DAF-BEs的编辑性能。该团队设计两种方法:其一,通过采用不同长度的连接子,将CDG4/TDG3与Cas9的N端/C端进行融合;其二,则是将糖基化酶融合到不同的环状重排Cas9 (CP-Cas9) nickases上。事实证明,两种方法均能有效调整编辑窗口并显著提升编辑效率(Fig. 6a,b)。
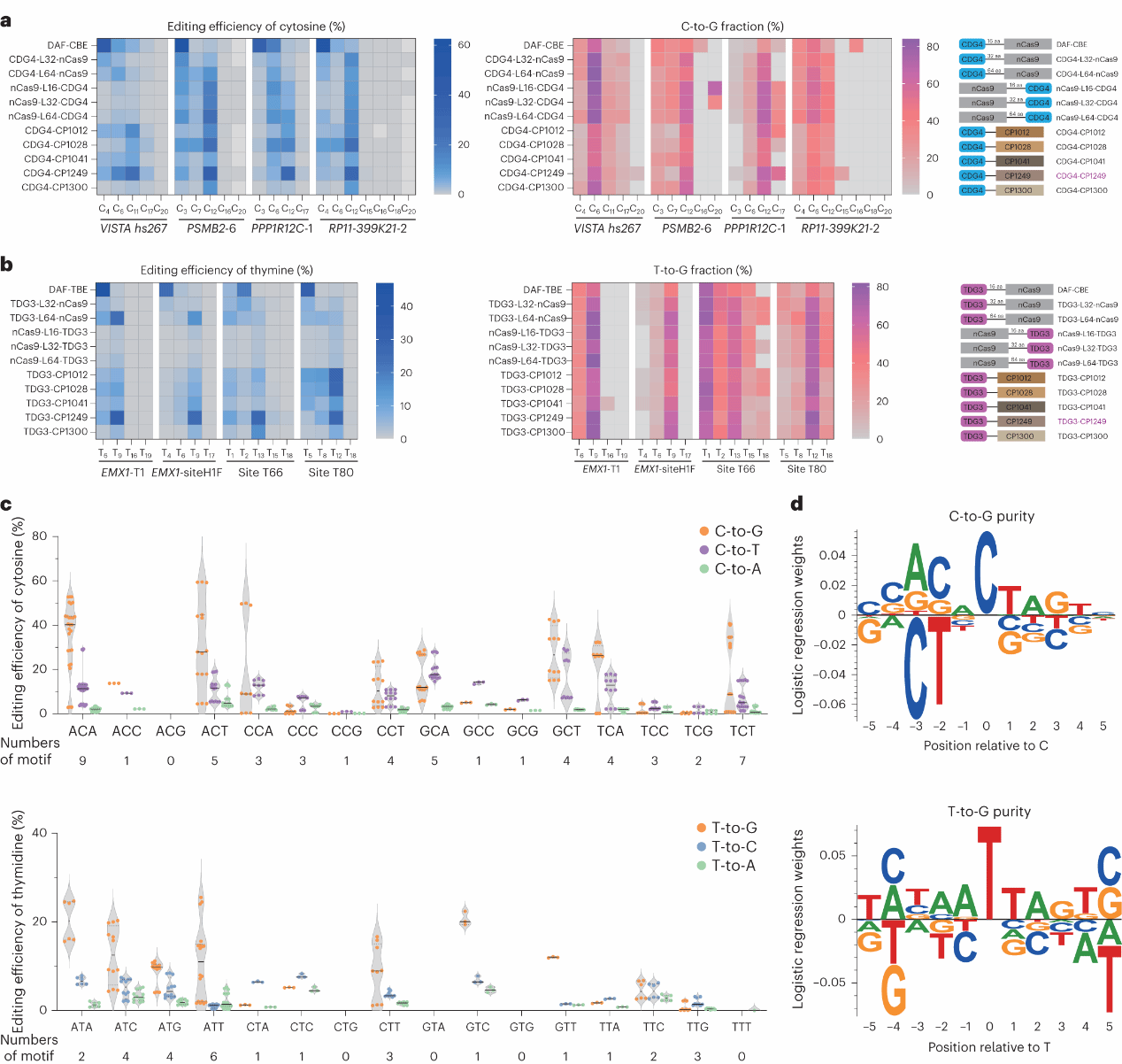
Fig. 6: Engineering DAF-BEs by redesigning the fusion of glycosylase variants and nCas9.
对HEK293T细胞转染10个DAF-CBEs突变体,不同变体表现出了差异化的编辑纯度与编辑窗口。在4个内源性位点上,CDG4-CP1249 (主要编辑C3或C4)的编辑窗口与DAF-CBE (主要编辑C9或C12)明显不同,且在各自的主要编辑位点中,CDG4-CP1249的C-to-G纯度明显提高(Fig.6a)。DAF-TBE主要编辑T2至T5,而TDG3-CP1249主要编辑T9、T12和T13,且在效率最高的位点上提高了T-to-G纯度(Fig.6b)。CDG4-CP1249更倾向于发生在NCT模体中,而TDG3-CP1249更倾向于发生在ATN和NTT模体中(Fig.6c,d)。
因此,作者将CDG4-CP1249命名为DAF-CBE2,将TDG3-CP1249命名为DAF-TBE2 。
总结与展望
在这项研究中,研究团队构建了不含脱氨酶的胞嘧啶碱基编辑器(DAF-CBE)和胸腺嘧啶碱基编辑器(DAF-TBE),分别包含只与Cas9 nickase相结合的胞嘧啶-DNA或胸腺嘧啶-DNA脱氧核糖核酸酶(CDG/TDG)变体。DAF-BEs能实现大肠杆菌中C-to-A和T-to-A的碱基编辑以及哺乳动物细胞中C-to-G/T-to-G编辑。与CGBE和PE相比,DAF-BE具有类似的效率、更小的尺寸和更低的脱靶效应。
值得注意的是,今年2月份,西湖大学常兴团队利用计算机蛋白语言模型(PLM)的预测,优化了一种对胸腺嘧啶 (eTDG) 具有特异性的增强型 UNG 变体,并用该UNG变体创建不依赖于脱氨酶的正交颠换 BE(CGBE 和 TSBE)。与DAF-BE相比,这两种碱基编辑器虽然都可以实现脱氨酶非依赖型编辑,实现C-to-G/T-to-G的编辑,但是其针对UNG1和UNG2的突变位点不同,实现的方法也不同。常兴团队所采用的PLM仅通过算法而无需大量数据训练便能优化蛋白质功能,相较于本文研究团队采用的蛋白质定向进化工程更加省时省力。PLM优化和定向进化改造糖基酶各有优劣,未来,将 PLM 与其他机器学习模型和蛋白质工程等实验方法相结合将成为碱基编辑器开发研究的重要内容。
总的来说,在研究人员的不懈努力下,碱基颠换编辑的接力棒从脱氨酶手中传递给糖基酶,开发出新型的DAF-BE。这扩展了碱基编辑器的碱基编辑类型,填补了以往碱基编辑工具方面的不足,为碱基编辑技术的应用和改进提供了有力的支持,为治疗人类遗传疾病和生物医学研究提供了新的可能性。
参考文献
[1] Ye L, Zhao D, Li J, et al. Glycosylase-based base editors for efficient T-to-G and C-to-G editing in mammalian cells. Nat Biotechnol. Published online January 2, 2024. doi:10.1038/s41587-023-02050-w
[2] He Y, Zhou X, Chang C, et al. Protein language models-assisted optimization of a uracil-N-glycosylase variant enables programmable T-to-G and T-to-C base editing. Mol Cell. 2024;84(7):1257-1270.e6.
本文作者:程田林组张心怡