背景
痛觉是一种与我们日常生活密切相关的感觉。从古至今,人类对于痛觉一直有着研究,亚里士多德的“痛觉是灵魂的情感波动”、“医学之父”希波克拉底提出的“当人体内血液、黏液、黄胆汁和黑胆汁4种液体中任何一种异常时人就会感到痛觉的体液说”、罗马学者Celsus阐述的“痛觉与炎症关系”、罗马时代的Galen描述的中枢神经系统与痛觉的关系以及祖国医学的瑰宝——《黄帝内经》对痛觉症状的描述等都在各自的年代对痛觉的研究产生了巨大的影响。直到16世纪文艺复兴以来,关于痛觉的产生机制和传导通路的各种学说应运而生,著名的“脊髓闸门学说”等均相继诞生,并且随着科技技术的发达,分子生物学和基因组学、功能核磁共振(fMXI)和正电子发射断层扫描(PET)等技术的产生又在一定程度上大大促进了痛觉的研究。
图1. 闸门假说示意图
尽管该理论已经提出了超过半个世纪,但周围神经损伤导致脊髓背角中环路可塑性的分子和细胞机制尚不清楚。近日,斯坦福大学吴蔡神经科学研究所的陈露团队在Neuron杂志上发表了题名为Spinal cord retinoic acid receptor signaling gates mechanical hypersensitivity in neuropathic pain的文章。研究者探讨了背角突触可塑性驱动神经病理性疼痛的机制,证明坐骨神经损伤显著降低了背角中抑制性小清蛋白阳性(PV+)中间神经元对初级传入神经元和局部兴奋性中间神经元的突触输出,导致了痛觉超敏,这一过程需要视黄酸受体RARα的参与。该研究不仅丰富了疼痛闸门学说,也为疼痛的治疗提供了新的可能靶点,具有重要的科学意义和临床价值。
结果
首先,研究者采用坐骨神经损伤(SNI)模型,研究了PV+神经元中RARα的缺失是否会影响神经病理性疼痛的发展。作者发现,SNI手术后野生型(WT)小鼠的同侧后肢出现明显的痛觉超敏。而在PV-RARα-cKO(PV-RARα条件敲除小鼠)小鼠中,没有出现机械性超敏反应。以上实验说明,PV+神经元中RARα的缺失阻碍了神经病理性疼痛的发展过程,提示SNI诱导的机械超敏反应需要PV+神经元中RARα的参与。
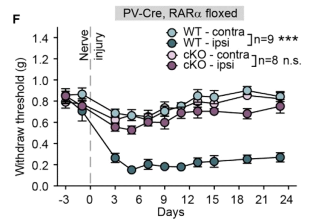
图2. WT和PVRARa cKO小鼠在SNI手术前和术后3周内,同侧和对侧的von Frey试验结果。WT-contra:野生型小鼠SNI手术对侧 von Frey 试验结果;WT-ipsi:野生型小鼠SNI手术同侧 von Frey 试验结果;cKO-contra:PV-RARα 基因敲除小鼠SNI手术对侧 von Frey 试验结果;cKO-ipsi:PV-RARα 基因敲除小鼠SNI手术同侧 von Frey 试验结果)
为了进一步了解RARα在神经病理性疼痛回路中的作用,研究者对SNI诱导的中枢伤害性通路(从脊髓到皮层)区域的神经元激活程度进行了分析。研究者发现在PV+神经元中,RARα的缺失抑制了整个CNS内伤害性通路神经元的过度激活。在所检查的大脑区域中,PV+神经元中的RARα缺失将其基础活动降低到假损伤水平以下(虚线),这表明PV-RARα cKO不仅阻止了局部回路中过度活动的发展,而且抑制了这些区域内的基础网络活动。提示,RARα在神经病理性疼痛诱发疼痛网络过渡激活中发挥重要作用。
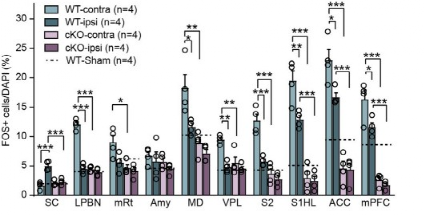
图3. 伤害性通路区域神经元激活的定量分析。假损伤WT小鼠每个区域的激活水平用虚线表示。SC:脊髓;mRt:中脑网状结构;Amy:杏仁核;MD:丘脑背内侧;VPL:丘脑中央后外侧核;S2:次级躯体感觉皮层;mPFC:内侧前额叶皮层。
由于背角iPV+神经元被认为通过对初级感觉传入神经元的突触前抑制和对兴奋性中间神经元的突触后抑制这两种形式的突触抑制来控制机械性疼痛感受。因此,研究者认为减少iPV+抑制性突触输出(Fig.4 A)可能是机械超敏反应的基础。在WT小鼠中,与对侧对照组相比,SNI使同侧PKC-γ+和vGluT3+神经元的抑制性突触后电流(oIPSC)幅度显著降低,这表明PV+神经元的突触后抑制作用减弱(Fig.4 B, C)。而PV-RARα-cKO小鼠并没有出现这种现象(Fig.4 B, C)。这说明PV+神经元介导的突触后抑制在一定程度上抑制了脊柱伤害性回路的过度活动,而这种SNI诱导的突触变化需要RARα的表达。
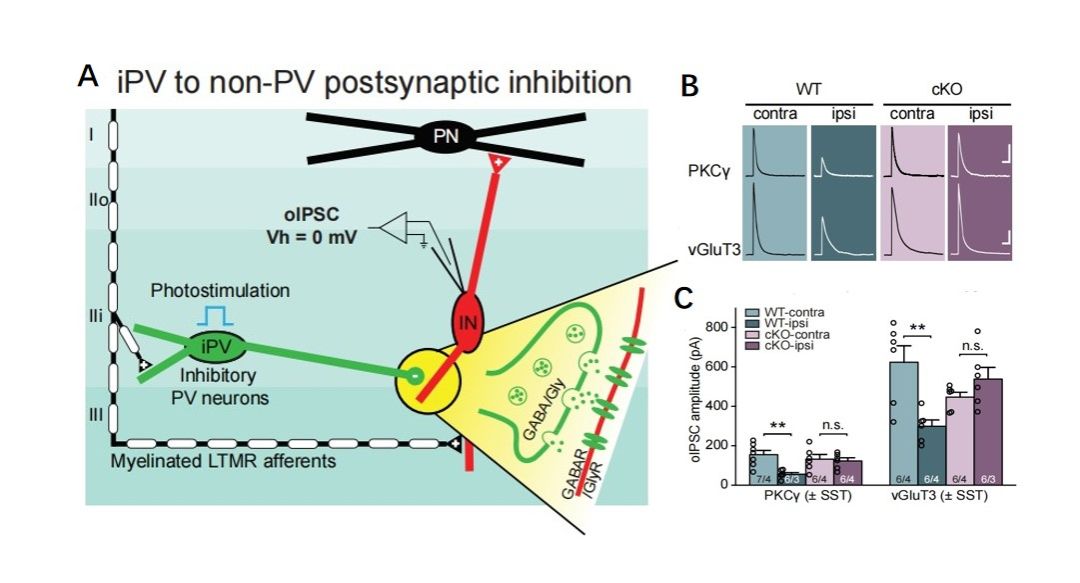
图4 PV+神经元介导的突触后抑制在一定程度上抑制了脊柱伤害性回路的过度活动。(A)iPV+神经元对兴奋性中间神经元的突触后抑制的局部脊髓背角回路示意图。(B)在进行了SNI的WT和cKO小鼠中,双侧PKCg+和vGluT3+神经元的oIPSC样本痕迹。(C)双侧PKCg+和vGluT3+神经元的oIPSC振幅。
为了进一步测试RARα拮抗剂对超敏反应的影响,研究者在鞘内注射Ro41-5253后进行SNI手术后并持续观察。他们发现,大鼠在药物注射时间范围内,慢性疼痛得到了有效缓解。但是,停药后,疼痛阈值又有了降低,到第三周出现神了经性疼痛,说明短期的Ro41-5253注射并不能缓解神经病理性疼痛的发展。作者在第四周时,进行了第二次Ro41-5253注射,发现重新注入Ro41-5253也无法消除神经性疼痛。证明在神经损伤前短期输注Ro41-5253只能暂时阻断机械超敏反应的发展,不能阻断神经病理性疼痛的发展。在病理性疼痛建立后阻断RARα也不能逆转现有的超敏反应。
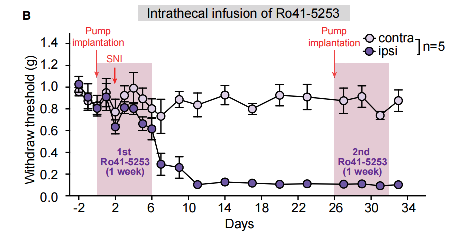
5.短期注射RARα拮抗剂只能暂时阻断机械超敏反应的发展且无法逆转已有的超敏反应
由于短期输注RARα拮抗剂只能暂时阻断机械超敏反应的发展,研究者进一步探索长期输注Ro41-5253是否能够持久阻断机械性超敏反应的发生,研究者尝试在SNI术前1天植入渗透泵,并持续输注4周,之后停止药物输注,发现药物注射后,大鼠没有明显的机械超敏反应,该现象在给药结束后持续存在。这一结果说明,在一定的时间窗内,脊髓突触可塑性可能参与了驱动中枢敏化,在该时间窗内的干预可以持续性阻断机械性超敏反应的发生,具有重大的治疗意义。
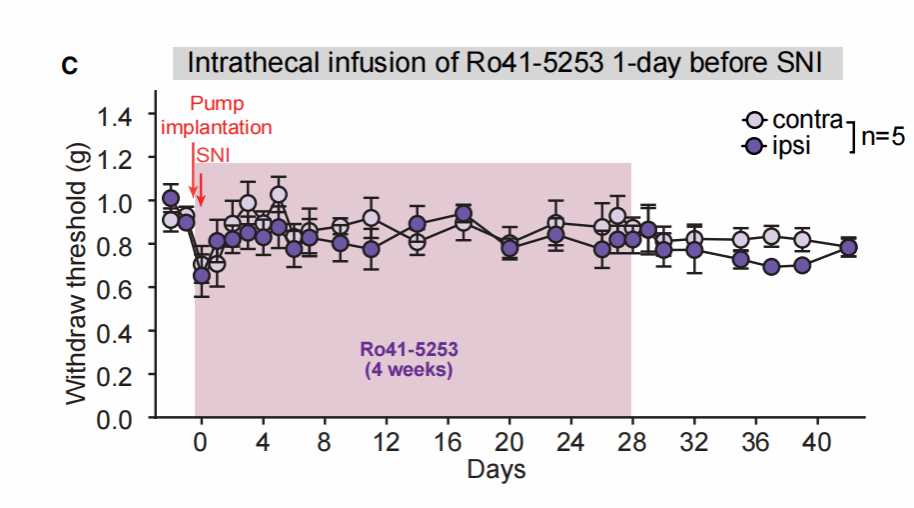
6.长期注射RARα拮抗剂可以持续性阻断机械性超敏反应的发生
总结
在这项研究中,研究者发现RARα在PV+的抑制性中间神经元中表达,在病理性疼痛发展过程中,RARα能够降低PV神经元对初级传入轴突终末(突触前抑制)和突触后兴奋性中继中间神经元(突触后抑制)的突触抑制。这些结果丰富了闸门学说,进一步完善了脊髓背角中调控异常性疼痛起的分子和细胞机制。更重要的是,该研究证明了敲除RARα或使用RARα拮抗剂可以防止SNI对突触抑制的减少和机械超敏反应的发展。并且,只有长期注射RARα拮抗剂,才可以持续性阻断机械性超敏反应的发生。这些结果表明稳态突触可塑性可能是痛觉超敏的重要机制。在一定的时间窗内,脊髓突触可塑性参与了中枢敏化过程,在该时间窗内的干预具有重大的治疗意义。
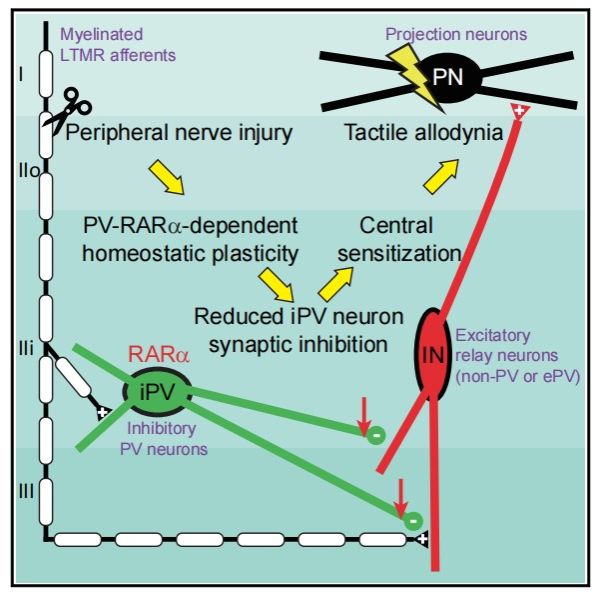
7.PV-RARα在机械超敏反应中的作用机制
参考文献
[1]Cao B, Scherrer G, Chen L. Spinal cord retinoic acid receptor signaling gates mechanical hypersensitivity in neuropathic pain. Neuron. 2022 Dec 21;110(24):4108-4124.
[2]Duan B, Cheng L, Bourane S, Britz O, Padilla C, Garcia-Campmany L, Krashes M, Knowlton W, Velasquez T, Ren X, Ross S, Lowell BB, Wang Y, Goulding M, Ma Q. Identification of spinal circuits transmitting and gating mechanical pain. Cell. 2014 Dec 4;159(6):1417-1432.
[3]Liu Y, Latremoliere A, Li X, Zhang Z, Chen M, Wang X, Fang C, Zhu J, Alexandre C, Gao Z, Chen B, Ding X, Zhou JY, Zhang Y, Chen C, Wang KH, Woolf CJ, He Z. Touch and tactile neuropathic pain sensitivity are set by corticospinal projections. Nature. 2018 Sep;561(7724):547-550.
[4]Peirs C, Williams SG, Zhao X, Arokiaraj CM, Ferreira DW, Noh MC, Smith KM, Halder P, Corrigan KA, Gedeon JY, Lee SJ, Gatto G, Chi D, Ross SE, Goulding M, Seal RP. Mechanical Allodynia Circuitry in the Dorsal Horn Is Defined by the Nature of the Injury. Neuron. 2021 Jan 6;109(1):73-90.
[5]Keller AF, Beggs S, Salter MW, De Koninck Y. Transformation of the output of spinal lamina I neurons after nerve injury and microglia stimulation underlying neuropathic pain. Mol Pain. 2007 Sep 27;3:27.
[6]Peirs C, Dallel R, Todd AJ. Recent advances in our understanding of the organization of dorsal horn neuron populations and their contribution to cutaneous mechanical allodynia. J Neural Transm (Vienna). 2020 Apr;127(4):505-525. doi: 10.1007/s00702-020-02159-1. Epub 2020 Apr 2. Erratum in: J Neural Transm (Vienna). 2021 Jun;128(6):867.
[7]Torsney C, MacDermott AB. Disinhibition opens the gate to pathological pain signaling in superficial neurokinin 1 receptor-expressing neurons in rat spinal cord. J Neurosci. 2006 Feb 8;26(6):1833-43.