小乐曾是个开朗活泼、充满阳光的孩子,他喜欢结识新朋友,喜欢参加各种社交活动,是小学里班级活动的领头人。
然而,当小乐升入中学后,一切都变了。在新的环境中,他遭受了同龄人的欺凌。一开始,只是受到侮辱性的言辞和孤立,后来文具书籍也被破坏,甚至遭到殴打。小乐的校园生活都被无助和孤独笼罩,渐渐的,他的笑容开始消失,取而代之的是沉默和忧虑。他不再参加任何活动,常常躲在角落里,逃避与他人的交往,只是沉浸在于自己的世界中。再到后来,即使是面对人群,他都会心跳加快,手心冒汗,甚至连简单的交流都变得十分困难。

小乐患上了社交恐惧症,也就是我们常说的“社恐”。现在,越来越多的年轻人给自己贴上了“社恐”的标签。其中,部分人是天生性格内向,害怕社交,但也有不少人是由于后天各种经历导致的,正如小乐所遭遇的校园暴力(创伤性的社交经历)。
那么,创伤性的社交经历是如何影响我们的大脑从而影响社交行为的呢?
2023年1月,美国西奈山伊坎医学院的Scott J. Russo教授研究团队在Nature上发表了题为Social trauma engages lateral septum circuitry to occlude social reward的文章,利用小鼠慢性社交挫败应激(CSDS)模型对这一问题作出了初步探索,证明了CSDS模型中社交逃避的出现是因为社交奖赏功能受损,并在神经环路水平上揭示了创伤性社会经历影响社交奖赏的神经机制。

过往的社交压力,尤其是创伤性社交经历,会导致抑郁症、自闭症、创伤性应激障碍等一系列精神疾病[1]。患者在参与社交的过程中无法得到积极的情绪反馈,甚至会产生负面情绪,进而逐渐丧失社交兴趣,因此回避社交,逐渐变得“社恐”。有研究表明社交创伤会损害大脑中负责奖赏的脑区功能,进而导致严重的社交回避行为[2,3]。尽管临床对社会创伤及其对社会行为的影响有了深入的认知和研究,但相关的潜在神经机制却知之甚少。在啮齿类动物中,社会创伤模型,如CSDS模型,已被广泛用于研究和理解控制情绪行为的神经环路机制(Fig 1)[4–6]:CSDS模型小鼠会表现为探索行为的减少和对蔗糖的偏好降低,并伴随有严重的社交回避行为[5,6]。

Fig 1 慢性社交挫败应激(CSDS)模型示意图
CSDS易感小鼠表现出社交奖赏缺陷
CSDS是如何影响小鼠社交行为的呢?作者首先对小鼠进行标准的CSDS模型构建,根据其与CD-1或者ERα-Cre F1小鼠的社会交互测试评分(SI ratio),将小鼠划分为易感(SUS)、抗性(RES)和对照(Ctrl)组(Fig 2a,b,g)。随后借助同性别C57BL/6J幼年鼠(4-6周龄)进行常驻入侵者(RI)和社交条件位置偏好(sCPP)测试,比较三组小鼠的社交能力差异[6,7]。
在RI测试中,Ctrl和RES小鼠与幼年鼠展开积极互动行为(接近、密切跟随以及嗅闻等),而SUS小鼠则表现出明显的社交回避行为(Fig 2c,d,h,i)。同样,在sCPP测试中,Ctrl和RES小鼠更喜欢与幼年鼠进行互动并对幼年鼠存在的环境表现出偏好性,而SUS小鼠则丧失了这种偏好性(Fig 2e,j)。基于上述结果,作者大胆地提出以下猜想:CSDS诱导了SUS小鼠的社交奖赏缺陷,SUS小鼠可能将幼年鼠视作危险性因素而产生社交回避行为。

Fig 2 SUS小鼠表现出社交奖赏缺陷
CSDS易感小鼠中外侧隔核的神经降压素神经元(NTLS)过度激活
为了探究SUS小鼠的社交奖赏缺陷的潜在环路机制,作者采用iDISCO+[8]绘制了全脑cFos染色图谱,通过比较三组小鼠与幼年鼠交互过程中不同脑区调节的差异性来筛选与社交奖赏缺陷相关的脑区(Fig 3a,b,c)。在众多差异调节脑区中,作者发现与RES小鼠相比,SUS小鼠外侧隔核(LS)中的cFos信号显著增加。
LS与遍布大脑的奖赏性中枢存在密切联系[9,10],因此被称为情绪[11–14]、动机行为[15,16]和空间信息处理的调节枢纽[17]。作者便将目光聚焦于LS。值得注意的是,作者发现SUS小鼠中大部分cFos+特异性分布在LS的腹外侧,结合Allen脑图谱原位杂交(ISH)数据库[18]筛选出多个LS腹外侧特异性表达基因,包括神经降压素(Nt)、促肾上腺皮质激素释放激素受体2(Crhr2)(Fig 3e)。为了进一步确定与幼年鼠交互过程中特异性激活的神经元类型,作者对RI测试后CSDS造模小鼠的脑片进行多重ISH染色(Fig 3f)。令人惊讶的是,SUS小鼠中超过94%的Nt阳性神经元表达cFos,而Nt阴性神经元几乎不表达cFos(Fig 3g,h)。同样,脑片电生理记录结果显示SUS小鼠中Nt阳性神经元的兴奋性显著高于RES小鼠(Fig 3k,n)。上述结果表明,外侧隔核的神经降压素神经元(NTLS)过度激活可能参与了社交奖赏缺陷的形成,并在其中起到关键性的调节作用。
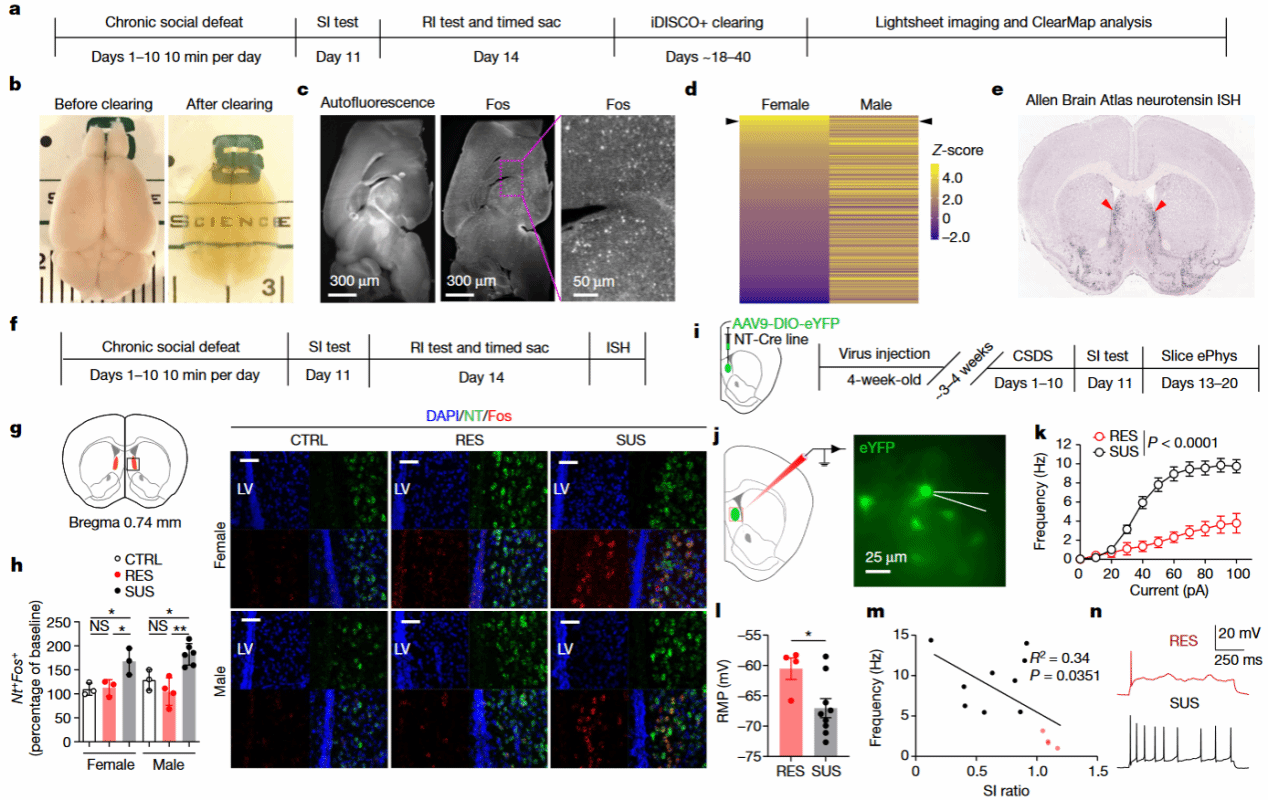
Fig 3 NTLS神经元的活性与SUS小鼠回避行为密切相关
为了研究与幼年鼠社交期间NTLS神经元的活动,作者利用光纤记录的方法,在Nt-Cre小鼠的LS脑区注射AAV-DIO-GCaMP6s(Fig 4a),观察在引入幼年鼠进行社交期间不同组小鼠的NTLS神经元钙活动(Fig 4b),结果显示Ctrl小鼠(Fig 4c,d)和RES小鼠(Fig 4e,f)的NTLS神经元钙活动没有显著变化,而SUS小鼠的NTLS神经元则在与幼年鼠社交过程中活性显著增加(Fig 4g,h),并且神经元活动增加的幅度(约5-10% ΔF/F)与Ctrl小鼠面对厌恶刺激(如遭受小鼠攻击(Fig 4i,j)或夹尾(Fig 4k,l))时的NTLS神经元钙活动上升类似。这些结果表明NTLS神经元对厌恶刺激而非奖赏刺激有反应。由此可见,CSDS后的SUS小鼠可能将幼年鼠视为具有攻击性的危险对象导致社交互动减少。
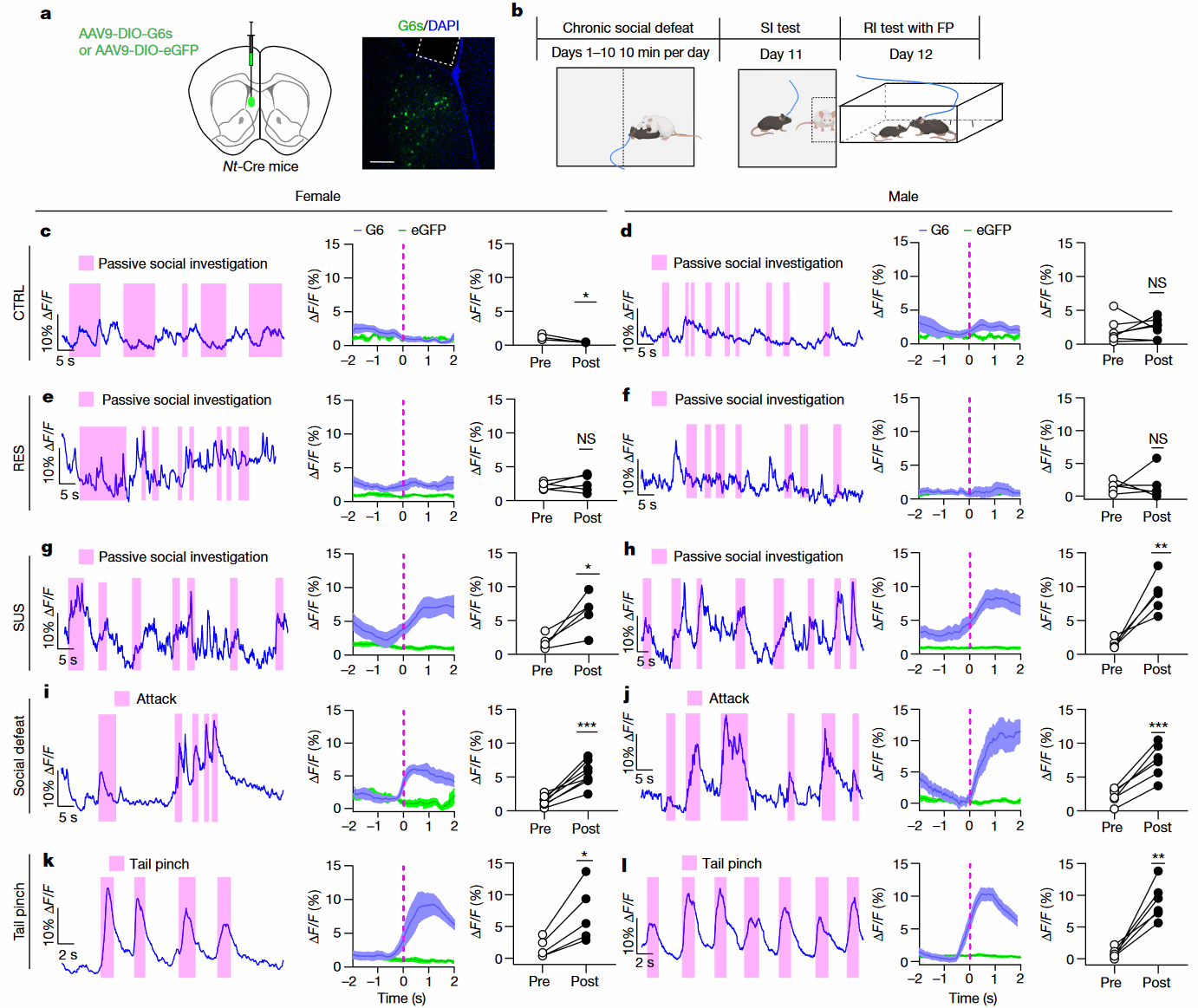
Fig 4 不同社交和压力环境下体内NTLS神经元的活性
NTLS神经元调节社交行为
为了评估NTLS神经元是否可以调节CSDS后的社交行为,作者利用化学遗传学操纵NTLS神经元的活动(Fig 5a)。作者发现,激活NTLS神经元降低了RES小鼠与CD-1小鼠的SI ratio,而抑制其活动则增强了SUS小鼠的SI ratio (Fig 5b,i)。在与幼年鼠社交期间,抑制SUS小鼠的NTLS神经元能增加其社交互动的持续时间(Fig 5c,j),并减少其社交回避次数(Fig 5d,k)。
在sCPP中,抑制NTLS神经元可以恢复SUS小鼠对幼年鼠的社交偏好性 (Fig 5e,f,l,m),而激活NTLS神经元导致RES小鼠的社交偏好消失(Fig 5g,h,n,o)。由此,作者认为,CSDS后NTLS神经元的过度激活介导了SUS小鼠社交奖赏缺陷。
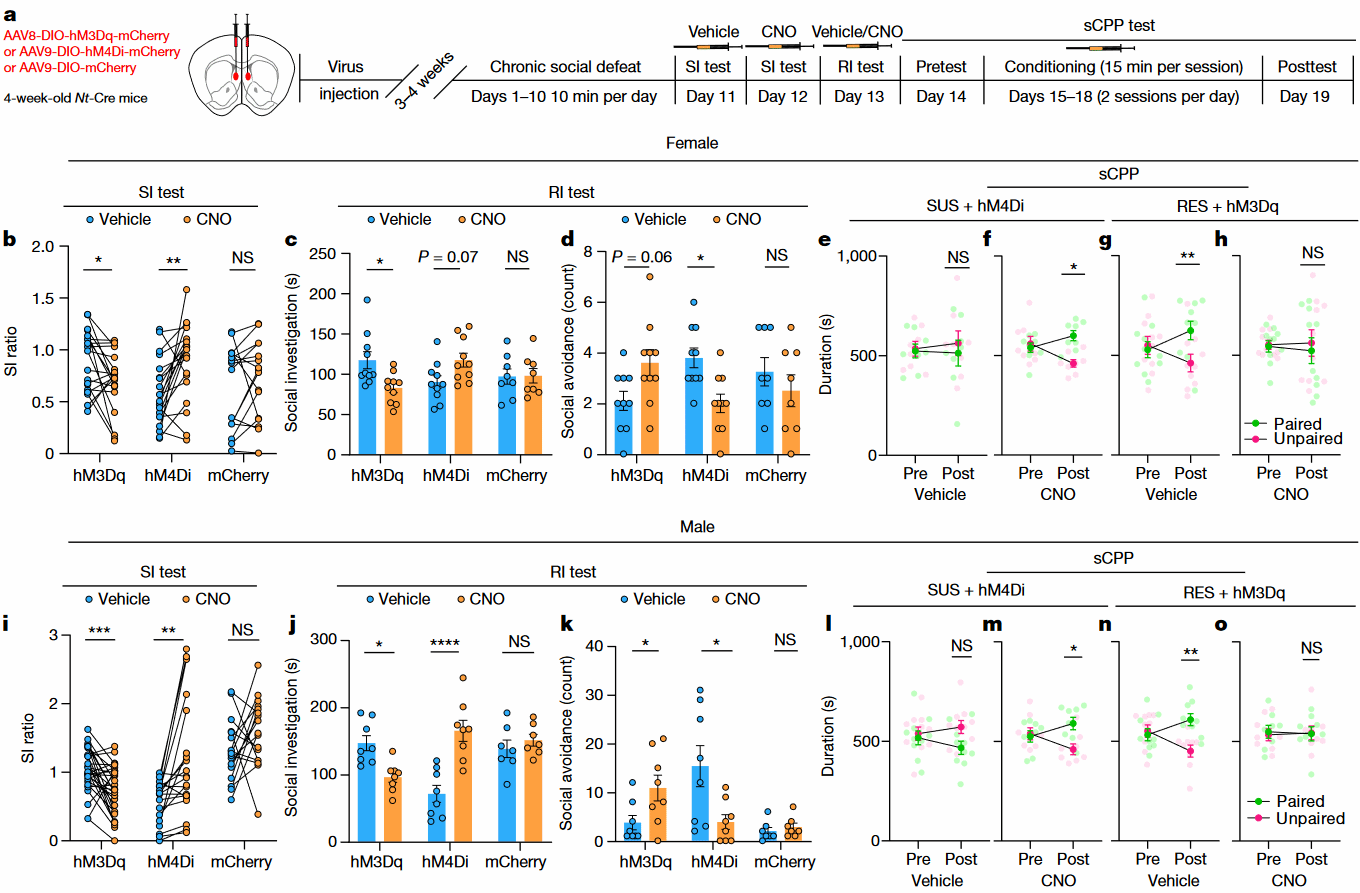
Fig 5 化学遗传学操纵NTLS神经元影响CSDS后的小鼠社交行为
以往研究表明,LS接受广泛的上游输入并投射到下游多个脑区[19]。为了进一步研究NTLS神经元参与调节社交行为的神经环路,作者通过病毒示踪绘制了NT神经元的投射图谱(Fig 6a,b)。NTLS神经元的许多下游脑区都与社交相关,其中伏隔核(NAc)参与社交奖赏和压力应激,下丘脑前部(AHN)参与防御和养育行为,导水管灰质(PAG)参与攻击、防御和逃避行为[20–22]。作者利用光遗传技术探究了NTLS→NAc、NTLS→AHN、NTLS→PAG三条环路的功能,发现激活NTLS→NAc或NTLS→AHN减少了主动社交的持续时间,而不影响社交回避行为(Fig 6d-i)。然而,激活NTLS→PAG对社交时间或社会逃避行为都没有影响(Fig 6j-l)。因此,NTLS至NAc和AHN两条神经环路参与了CSDS后小鼠的社交行为调控。

Fig 6 光遗传学操纵NTLS投射神经元影响CSDS后的小鼠社交行为
总结
综上,该研究揭示了创伤性社交挫败经历通过阻断社交奖赏来影响社交行为。首先,作者巧妙地利用幼年鼠作为社交对象开展一系列社交行为测试(避免恐惧或顺从行为对实验的干扰),发现了CSDS后的SUS小鼠存在社交奖赏缺陷现象;随后,通过全脑cFos和多重ISH染色并结合电生理记录发现了NTLS神经元的过度激活介导了SUS小鼠社交奖赏缺陷的形成;最终通过病毒示踪手段将目光聚焦于LS下游与社交奖赏和压力应激密切相关的脑区——NAc以及与防御行为密切相关的脑区——AHN,结合化学遗传学和光遗传学手段从环路水平上揭示了社交挫败阻断社交奖赏的神经机制。
人生路漫漫,“i”人的社恐可能与后天的经历有着密切关系。这篇文章的结果为我们理解创伤应激后社交奖赏改变的神经环路机制,以及相关精神疾病治疗提供了理论基础,希望我们都能从质疑“i”到理解“i”~
参考文献
[1] Feder A, Nestler E J, Charney D S. Psychobiology and molecular genetics of resilience[J]. Nature Reviews. Neuroscience, 2009, 10(6): 446–457. DOI:10.1038/nrn2649.
[2] Rappaport B I, Hennefield L, Kujawa A, et al. Peer victimization and dysfunctional reward processing: erp and behavioral responses to social and monetary rewards[J]. Frontiers in Behavioral Neuroscience, 2019, 13: 120. DOI:10.3389/fnbeh.2019.00120.
[3] Ethridge P, Sandre A, Dirks M A, et al. Past-year relational victimization is associated with a blunted neural response to rewards in emerging adults[J]. Social Cognitive and Affective Neuroscience, 2018, 13(12): 1259–1267. DOI:10.1093/scan/nsy091.
[4] Berton O, McClung C A, Dileone R J, et al. Essential role of bdnf in the mesolimbic dopamine pathway in social defeat stress[J]. Science (New York, N.Y.), 2006, 311(5762): 864–868. DOI:10.1126/science.1120972.
[5] Krishnan V, Han M-H, Graham D L, et al. Molecular adaptations underlying susceptibility and resistance to social defeat in brain reward regions[J]. Cell, 2007, 131(2): 391–404. DOI:10.1016/j.cell.2007.09.018.
[6] Golden S A, Covington H E, Berton O, et al. A standardized protocol for repeated social defeat stress in mice[J]. Nature Protocols, 2011, 6(8): 1183–1191. DOI:10.1038/nprot.2011.361.
[7] Takahashi A, Chung J-R, Zhang S, et al. Establishment of a repeated social defeat stress model in female mice[J]. Scientific Reports, 2017, 7(1): 12838. DOI:10.1038/s41598-017-12811-8.
[8] Renier N, Adams E L, Kirst C, et al. Mapping of brain activity by automated volume analysis of immediate early genes[J]. Cell, 2016, 165(7): 1789–1802. DOI:10.1016/j.cell.2016.05.007.
[9] Sheehan T, Numan M. The septal region and social behavior[M/OL]. Numan R, ed.//The Behavioral Neuroscience of the Septal Region. New York, NY: Springer, 2000: 175–209[2023–06–12]. https://doi.org/10.1007/978-1-4612-1302-4_8. DOI:10.1007/978-1-4612-1302-4_8.
[10] Sheehan T P, Chambers R A, Russell D S. Regulation of affect by the lateral septum: implications for neuropsychiatry[J]. Brain Research Reviews, 2004, 46(1): 71–117. DOI:10.1016/j.brainresrev.2004.04.009.
[11] Borie A M, Dromard Y, Guillon G, et al. Correction of vasopressin deficit in the lateral septum ameliorates social deficits of mouse autism model[J]. The Journal of Clinical Investigation, 2021, 131(2): e144450, 144450. DOI:10.1172/JCI144450.
[12] Wong L C, Wang L, D’Amour J A, et al. Effective modulation of male aggression through lateral septum to medial hypothalamus projection[J]. Current biology: CB, 2016, 26(5): 593–604. DOI:10.1016/j.cub.2015.12.065.
[13] Leroy F, Park J, Asok A, et al. A circuit from hippocampal ca2 to lateral septum disinhibits social aggression: 7735[J]. Nature, 2018, 564(7735): 213–218. DOI:10.1038/s41586-018-0772-0.
[14] Menon R, Süß T, Oliveira V E De M, et al. Neurobiology of the lateral septum: regulation of social behavior[J]. Trends in Neurosciences, 2022, 45(1): 27–40. DOI:10.1016/j.tins.2021.10.010.
[15] Vega-Quiroga I, Yarur H E, Gysling K. Lateral septum stimulation disinhibits dopaminergic neurons in the antero-ventral region of the ventral tegmental area: role of gaba-a alpha 1 receptors[J]. Neuropharmacology, 2018, 128: 76–85. DOI:10.1016/j.neuropharm.2017.09.034.
[16] Besnard A, Leroy F. Top-down regulation of motivated behaviors via lateral septum sub-circuits[J]. Molecular Psychiatry, 2022, 27(8): 3119–3128. DOI:10.1038/s41380-022-01599-3.
[17] Wirtshafter H S, Wilson M A. Lateral septum as a nexus for mood, motivation, and movement[J]. Neuroscience & Biobehavioral Reviews, 2021, 126: 544–559. DOI:10.1016/j.neubiorev.2021.03.029.
[18] Lein E S, Hawrylycz M J, Ao N, et al. Genome-wide atlas of gene expression in the adult mouse brain[J]. Nature, 2007, 445(7124): 168–176. DOI:10.1038/nature05453.
[19] Wang D, Wang W, Jiang S, et al. Regulation of depression-related behaviors by gabaergic neurons in the lateral septum through periaqueductal gray neuronal projections[J]. Journal of Psychiatric Research, 2021, 137: 202–214. DOI:10.1016/j.jpsychires.2021.02.043.
[20] Russo S J, Nestler E J. The brain reward circuitry in mood disorders[J]. Nature Reviews. Neuroscience, 2013, 14(9): 609–625. DOI:10.1038/nrn3381.
[21] Lefler Y, Campagner D, Branco T. The role of the periaqueductal gray in escape behavior[J]. Current Opinion in Neurobiology, 2020, 60: 115–121. DOI:10.1016/j.conb.2019.11.014.
[22] Stolzenberg D S, Mayer H S. Experience-dependent mechanisms in the regulation of parental care[J]. Frontiers in Neuroendocrinology, 2019, 54: 100745. DOI:10.1016/j.yfrne.2019.04.002.
本文作者:舒友生组王坤/王卓一