人类在地球上的生活状态可大致分为两种:清醒和非清醒状态。而依据经验而谈,人类大部分的创造行为都是在清醒状态完成,我们借助躯体及感官,在清醒状态接受并处理各种不同的感受、情绪和体验信息(无论其来自外部还是内部),并给出与之相对应的有效的行为或非行为反馈,同时再整合相关信息以再次响应。而在非清醒状态,人类的活动轨迹似乎被暂停了。在这其中,以进化中高度保守的睡眠作为非清醒状态的典型代表,竟然可以占人类一生的1/3之多。当人类处于睡眠状态,清醒时向外界伸出的多个“触角”通通回归小小空间之中,此时,内部空间的信息交流远大于我们与外部世界的联系。[1]
由于处于睡眠状态的人类的意识“下线”使得“自我”缺乏对于此过程的知觉,无法形成有效反馈,因此大多数人对睡眠行为缺乏足够的认识和了解,甚至存在很多错误认知,例如“睡眠不重要”“补觉就好了”“训练减少睡眠需求”等等。实际上,睡眠对人类健康至关重要。特别是睡眠在记忆的形成和巩固中发挥着不可替代的作用。[2,3]记忆是塑造一个人“自我”的重要基础,人类通常通过反复的训练和环境暴露来实现记忆的巩固。已有不少研究表明睡眠状态下的大脑活动对于记忆的形成和巩固至关重要。[4–7]牛津大学David Dupret教授团队于2024年11月发表在《Neuron》上的工作《Offline hippocampal reactivation during dentate spikes supports flexible memory》,解析了大脑离线状态下大脑海马齿状回(DG)神经活动形成的一种特殊神经群体事件齿状回尖波dentate spike (DS),在支持灵活记忆形成中的关键作用。[8]
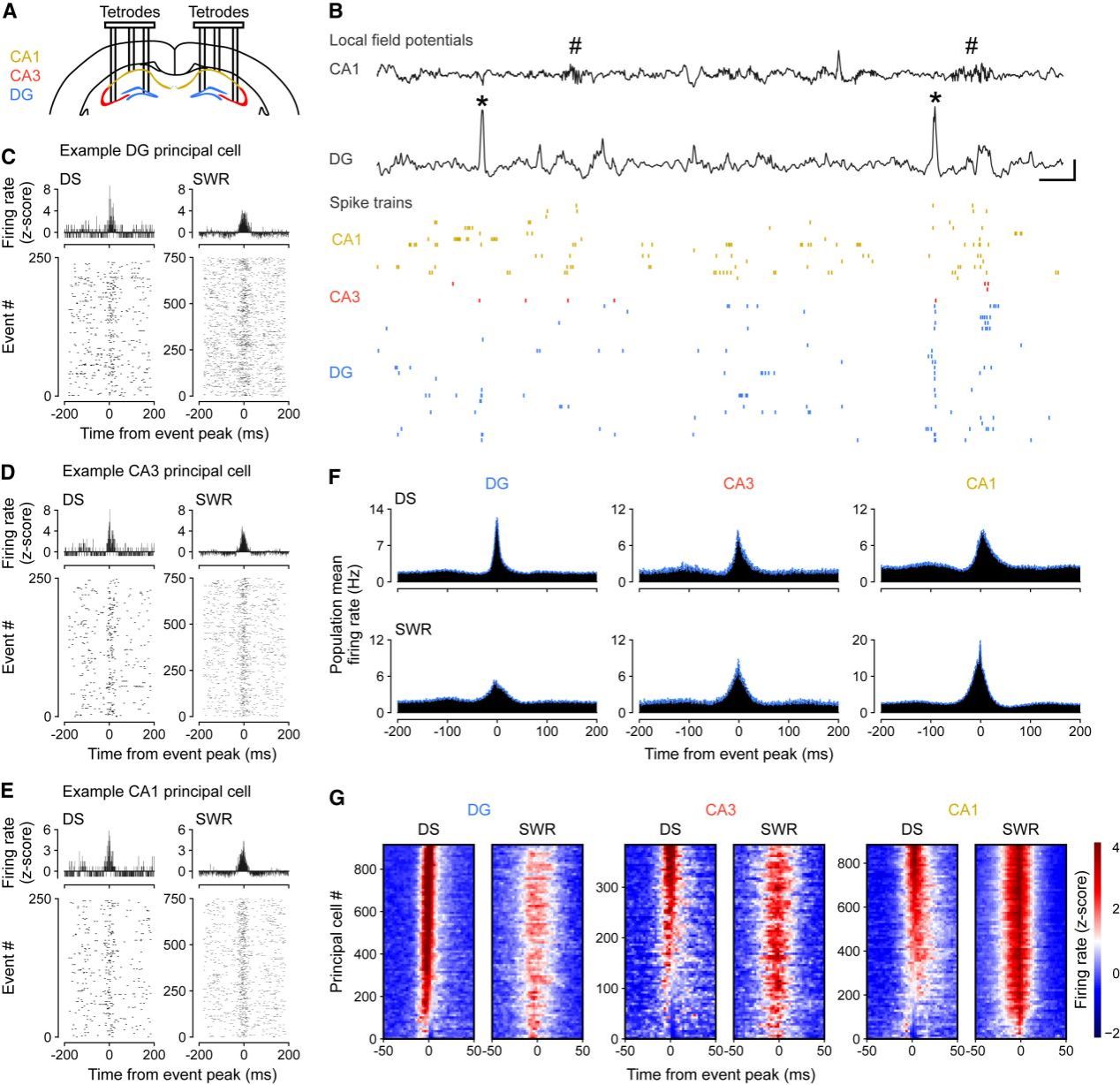
Fig.1 DS招募海马DG、CA3和CA1的主神经元放电
作者利用可同时记录三个脑区信号的tetrode,在大脑离线状态下记录了海马CA1、CA3和DG区域的LFP及PC spike信号,并识别了CA1中的Sharp wave ripple (SWR) [0] 事件和DG中的DS事件 [1] 。将DS和SWR事件与主细胞放电(principal cell/PC spike)对齐分析后发现,DG PC在DS和SWR期间的活动均显著增强,而CA1和CA3不仅在SWR期间活动增加,在DS期间也表现出类似趋势。这一结果与此前报道的CA PC在DS期间活动被抑制的结论相反[10,11]。
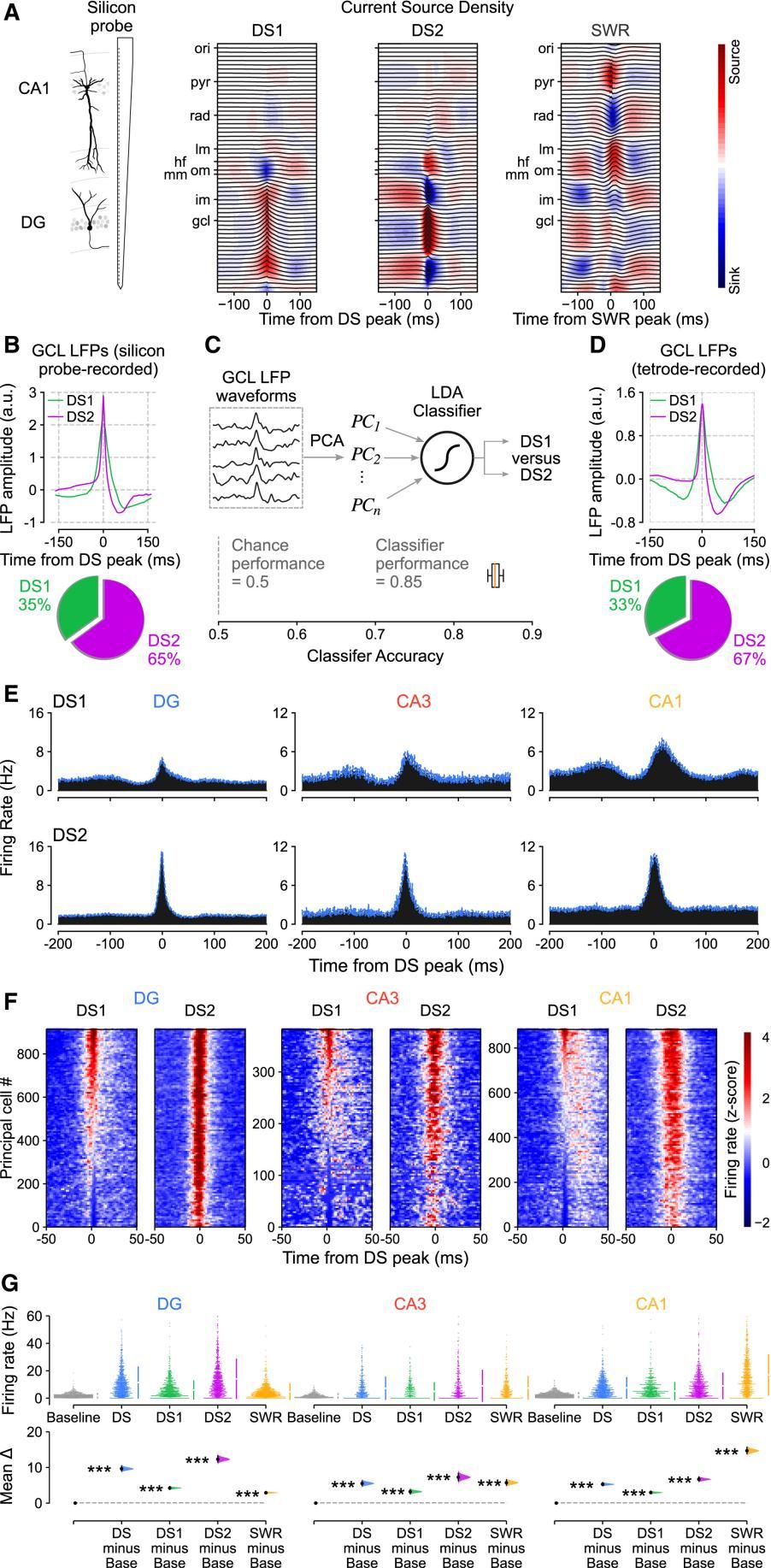
Fig.2 DS2事件中海马主细胞放电高于DS1事件
为了进一步探究PC是否会对不同类型的DS事件产生不同的反应,作者利用硅探针采集不同层级的DG神经元活动,并通过Current Source Density (CSD)分析识别出两类DS�事件,DS1和DS2。 [2] 同时,作者还训练了一个线性分类器对采集到的DS信号进行识别,确认了训练器具有较高的准确率,并验证了分类结果与tetrode和硅探针数据基本一致。分类后发现DS事件当中DS2占2/3,是主导事件。且DG和CA1 PC对于DS2的响应要高于DS1,而有相当一部分CA PC对于DS1是不响应甚至是抑制的。(这可以解释之前报道中CA在DS期间被抑制的结果。)�尽管如此,DS1/2事件活动仍显著高于DS SWR事件之外的baseline水平。这些结果表明,DS事件(包括DS1和DS2)构成了大脑离线状态下的一种瞬时网络状态,其特征是海马区域主细胞尖峰活动的能力显著增加,这与离线状态下的其他活动有本质区别。研究提示,DS事件可能主导了离线期间海马网络的高频同步活动。
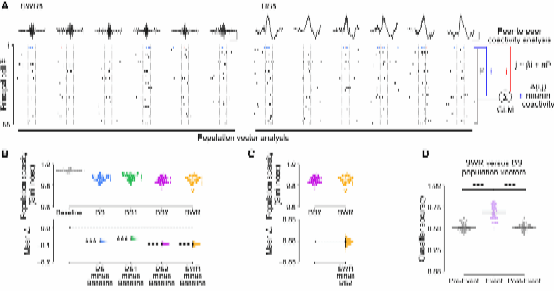
Fig.3 DS和SWR群体放电共活动结构不同
在发现DS事件尤其是DS2事件对于海马PC活动的主导作用后,作者进一步研究了海马如何组织其主细胞在单个DS事件和跨事件中的群体活动的,并与SWR中的模式进行了比较。首先,作者通过群体向量分析,将SWRs和DSs期间发生的神经元PC spike表示为矢量。计算Gini指数[3] 后发现,DS和SWR 包含的放电矢量的平均群体稀疏性(反映神经元活动的集中程度)显著降低,而DS2和SWR的群体稀疏性水平相当。随后,作者构建逻辑回归分类器,对不同事件的群体放电向量进行分类。分类器能够有效区分DS和SWR事件,但无法区分事件发生前后的活动,表明PC在DS和SWR事件中具有独特的活动模式。
为了进一步分析事件内部的神经元活动模式,作者比较了SWR和DS嵌合的群体放电向量相似性,发现DS事件中神经元放电模式更加多样,DS1的相似性低于DS2。这表明,DS事件中瞬时活动的神经元模块可能与SWR不同。
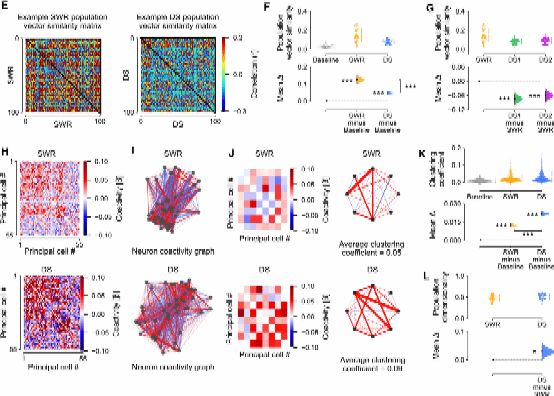
Fig.3 DS和SWR群体放电共活动结构不同
通过线性模型预测神经元对的放电相关性,作者利用PPCA构建了回归权重矩阵和神经元共活动图(节点表示神经元,边表示神经元之间的放电关联)。比较DS和SWR事件的共活动图后发现,DS事件中更倾向于形成三元组(triads),即更密集的活动网络。这表明,DS事件期间,多个神经元更容易共同放电,形成更强的网络结构。接着作者通过主成分分析量化并比较了DS1、DS2和SWR中的活动模式方差。结果显示,DS事件中群体向量的维度更高,说明DS事件的神经元活动模式包含更多独立信息或变化。这些结果表明,尽管DS和SWR事件都能同步海马主细胞活动,但DS事件的共活动响应更加多样,展现出更丰富的网络特性。
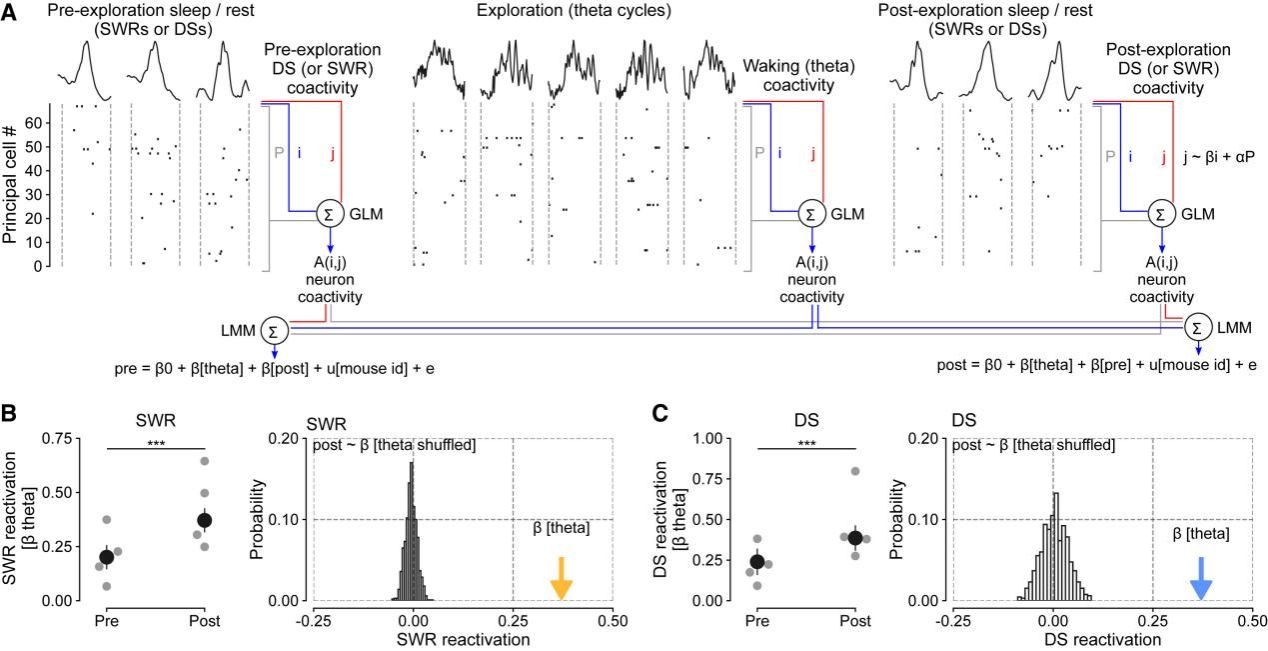
Fig.4海马共活动的觉醒模式在离线DSs中再激活
经过对DS与SWR及其内部活动模式的解码分析,作者提出,DS中的神经元放电联系模块可能与支持记忆主导行为的离线重激活模式相关。为验证这一假设,作者借鉴了研究SWR与记忆相关行为的方法。作者首先采用点对点共活动分析,将探索行为前后离线状态下DS和SWR事件的活动,与探索期间theta循环中群体共活动的清醒模式进行比较,并通过线性混合模型进行分析。结果显示,与前人研究一致,探索后离线状态中的SWR共活动模式显著更接近探索期间的theta振荡模式。类似地,探索后的DS也表现出更高的theta振荡水平,表明离线状态中的DS同样存在再激活现象。前文研究表明,DS事件的神经元共活动模式比SWR更高维、更多样。而离线状态下类似清醒的群体模式再激活提出了一个新问题:这些模式对记忆引导行为的网络贡献如何?为此,作者设计了闭环光遗传学结合记忆行为任务的实验范式以进一步验证。
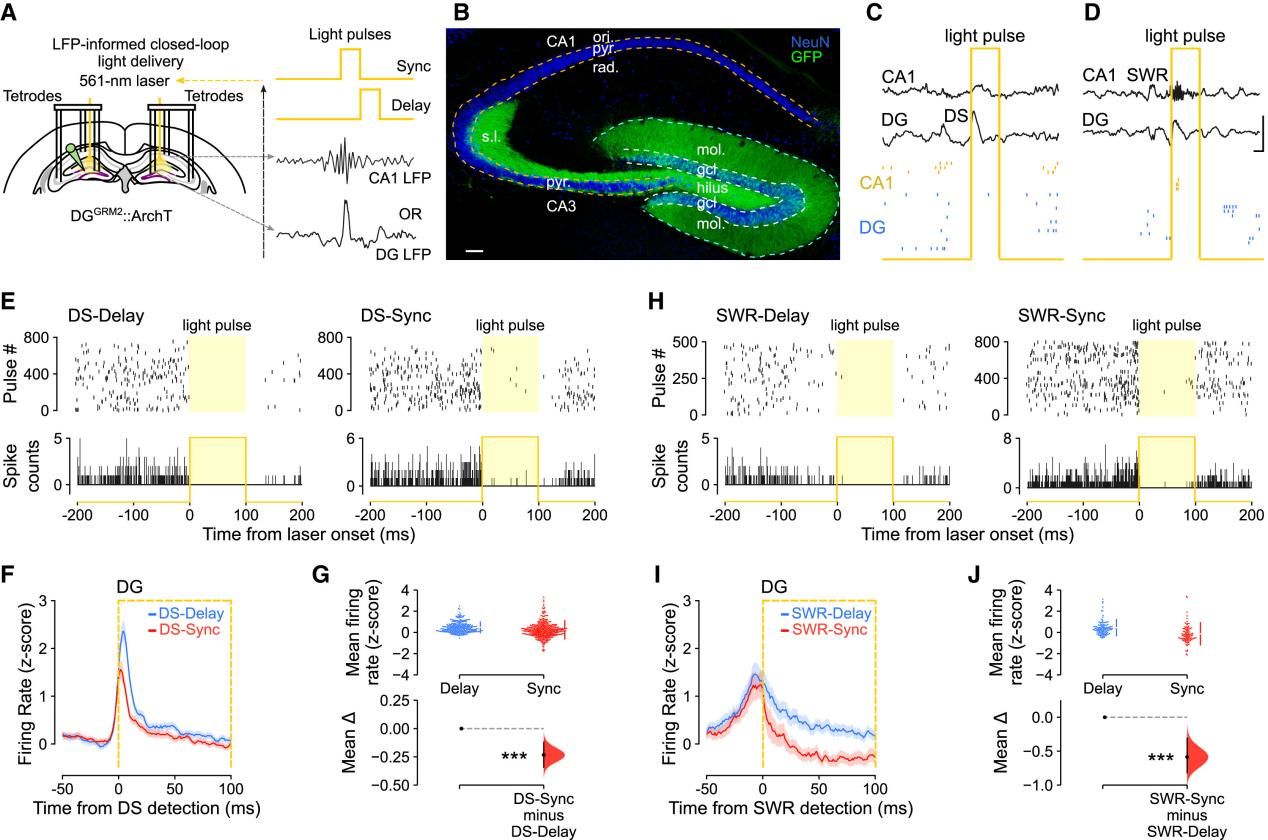
Fig.5 DG颗粒细胞的DS和SWR事件下的离线抑制作用
作者首先验证了闭环光遗传抑制方法的有效性。相比于DS延迟光抑制条件,DS同步光抑制显著降低了DG神经元和CA主细胞的尖峰放电。此外,SWR同步光抑制同样明显减少了DG神经元的放电活动。
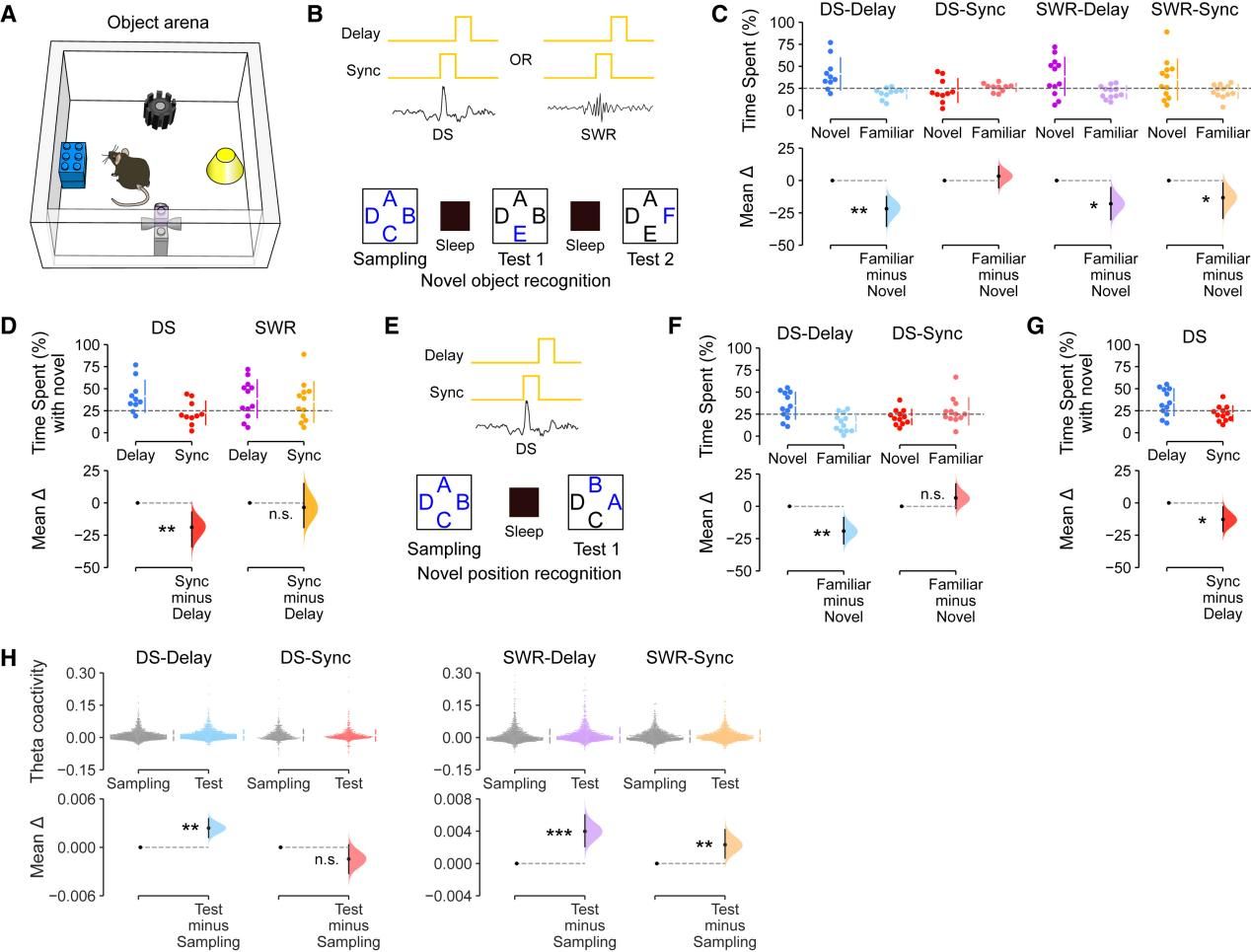
Fig.6 DS活动的离线抑制损害了灵活的认知记忆
接下来,作者将该方法与新物体识别行为测试结合,探究DS同步光抑制对记忆任务的影响。结果显示,在DS同步抑制条件下,小鼠对新物体的偏好消失;而在DS延迟、SWR延迟或SWR同步抑制条件下,小鼠对新物体的偏好均强于对熟悉物体的偏好。进一步在新位置识别任务中也发现,DS同步抑制消除了小鼠优先探索新位置物体的倾向。此外,作者还发现在 DS-延迟、SWR-延迟和 SWR-同步抑制条件下,offline状态下DG 细胞活动对于观察到的物体识别记忆的保留伴随着更强的 Theta 振荡。而 DS 同步抑制后的情况并非如此,表明DS事件的沉默破坏了新近经验信息的整合。综上,这些结果表明,海马群体对offline DS事件的反应是灵活的、基于记忆的识别先前遇到的物体和相关网络θ共振增益所必需的。
总结
齿状回离线尖波(DSs)能够激活DG和CA区域的神经元。是另一种重要的海马网络事件。DS承载着短时间尺度的共激活,形成群体层面的神经活动模式,类似于已经确立的尖波涟漪(SWRs)。然而与SWR相比,DSs具有独特的活动模式和神经元组成。在本文的研究中,作者发现DSs中嵌套了更强的共激活神经元模式,导致其群体模式相比SWRs具有更高的多样性和维度。与SWRs类似,DSs会重新激活在之前清醒经历中表达的海马群体模式。而这种离线再激活在行为上具有重要意义:在离线DS事件期间对DG颗粒细胞放电进行闭环光抑制,能够干扰下游CA主细胞的活动,并损害基于先前经验的灵活识别记忆,以及与之相关的theta嵌套神经共活动的网络增益。总的来讲,这些结果揭示了DSs在海马群体活动模式和记忆指导行为中的关键作用,并为睡眠对于记忆整合的重要性提供了新的证据。
现代社会中,许多人因工作或生活压力选择牺牲睡眠以延长清醒时间。然而研究表明,睡眠剥夺削弱及改变了海马神经元的再激活和放电活动,损害记忆整合功能,并可能导致不可逆的记忆力损伤。即使后续恢复正常睡眠,损伤也难以完全修复。[7]此外,长期睡眠剥夺还增加情绪失调、免疫力下降和神经退行性疾病的风险。[12–15]规律且充足的睡眠是身心健康的基础,过度压缩睡眠以迎合需求并不可取。合理安排作息,是应对现代社会压力的有效方式。
事实上,睡眠不仅是一种看似静止的休息时间,也是大脑进行重要修复和整理的阶段。记忆、情绪调节以及认知功能的维护,都在睡眠中悄然进行。正是这种重要性,使得睡眠成为我们生存和健康的基础。或许我们可以将睡眠看作是以脱离自我意识为特征的另一种存在方式。在这个过程中,身体指令先行于意识。尽管人们普遍认为清醒时的意识才是人类生命的核心,但离线状态下的睡眠的价值急切地需要被重新审视和尊重。从某种意义上说,自我意识构建了我们个体经验的微观宇宙,而睡眠与清醒地交替就是我们宇宙的呼吸。
参考文献:
1. Lewis LD. The interconnected causes and consequences of sleep in the brain. Science. 2021 Oct 29;374(6567):564–8.
2. Mason GM, Lokhandwala S, Riggins T, Spencer RMC. Sleep and human cognitive development. Sleep Med Rev. 2021 Jun;57:101472.
3. Rasch B, Born J. About Sleep’s Role in Memory. Physiol Rev. 2013 Apr;93(2):681–766.
4. Boyce R, Glasgow SD, Williams S, Adamantidis A. Causal evidence for the role of REM sleep theta rhythm in contextual memory consolidation.
5. Zaki Y, Pennington ZT, Morales-Rodriguez D, Bacon ME, Ko B, Francisco TR, et al. Offline ensemble co-reactivation links memories across days. Nature. 2025 Jan 2;637(8044):145–55.
6. Van De Ven GM, Trouche S, McNamara CG, Allen K, Dupret D. Hippocampal Offline Reactivation Consolidates Recently Formed Cell Assembly Patterns during Sharp Wave-Ripples. Neuron. 2016 Dec;92(5):968–74.
7. Giri B, Kinsky N, Kaya U, Maboudi K, Abel T, Diba K. Sleep loss diminishes hippocampal reactivation and replay. Nature. 2024 Jun 27;630(8018):935–42.
8. McHugh SB, Lopes-dos-Santos V, Castelli M, Gava GP, Thompson SE, Tam SKE, et al. Offline hippocampal reactivation during dentate spikes supports flexible memory. Neuron. 2024 Sep;S0896627324006469.
9. Yang W, Sun C, Huszár R, Hainmueller T, Kiselev K, Buzsáki G. Selection of experience for memory by hippocampal sharp wave ripples. Science. 2024 Mar 29;383(6690):1478–83.
10. Penttonen M, Kamondi A, Sik A, Acsády L, Buzsáki G. Feed-forward and feed-back activation of the dentate gyrus in vivo during dentate spikes and sharp wave bursts. Hippocampus. 1998 Dec 7;7(4):437–50.
11. Bragin A, Jando G, Nadasdy Z, Van Landeghem M, Buzsaki G. Dentate EEG spikes and associated interneuronal population bursts in the hippocampal hilar region of the rat. J Neurophysiol. 1995 Apr 1;73(4):1691–705.
12. Schiller M, Ben-Shaanan TL, Rolls A. Neuronal regulation of immunity: why, how and where? Nat Rev Immunol. 2021 Jan;21(1):20–36.
13. Irwin MR. Sleep and inflammation: partners in sickness and in health. Nat Rev Immunol. 2019 Nov;19(11):702–15.
14. Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, et al. Sleep Drives Metabolite Clearance from the Adult Brain. Science. 2013 Oct 18;342(6156):373–7.
15. Besedovsky L, Lange T, Haack M. The Sleep-Immune Crosstalk in Health and Disease. Physiol Rev. 2019 Jul 1;99(3):1325–80.
[0] Sharp wave ripple (SWR), 是一种海马自发产生顺势的高频振荡活动,称为尖波涟漪,广泛存在于哺乳动物的大脑中。研究表明,SWR表征早期习得记忆的神经元的再活动并且参与记忆的巩固。[9]
[1] Dentate Spike (DS), 是DG区域神经元所发生的快速且高幅的瞬时放电。
[2] DS的分类,是根据DS的产生依赖于内嗅皮层对齿状回的输入,根据其来源可识别出两种类型的DS——即它们是否源自外侧(LEC)或内侧内嗅皮层(MEC)的放电。DS类型1(DS1)的CSD在外分子层(OML)中显示出一个汇,接收来自LEC的投射;而DS类型2(DS2)的CSD在中分子层(MML)中显示出一个汇,接收来自MEC的投射。[11]
[3] Gini指数,是判断不平等程度的一种常用指标,尤其常用来衡量收入或财富分配的不均衡程度。它由意大利统计学家 Corrado Gini 在1912年提出。
本文作者:李世斌组郭嘉慧