肿瘤的转移是导致肿瘤患者死亡的主要原因,也是肿瘤治疗上的一个重要挑战。癌细胞要实现转移并不容易,首先需要脱离原位瘤,然后通过血液、淋巴系统或腹膜扩散到身体的其他器官。在这个过程中,肿瘤细胞需要承受血管壁的压力,还要克服到达远端器官后环境的严苛,同时还需要避开机体免疫系统的监视和攻击。基于以上,具有高转移能力的癌细胞通常需要具备独特的代谢特征。
脂类是细胞基本营养物质之一,对生物体的生长繁殖必不可少。脂类的常见功能包括能量储存和细胞膜的构成等。其中有一类特殊的脂类,不饱和脂肪酸,这是一类化学结构中含有一个或多个双键的脂肪酸。它们根据双键的数量可以分为单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)。不饱和脂肪酸对人体健康至关重要。它们不仅是细胞膜的主要组成部分,还能调节体内的炎症反应、血脂水平和免疫功能。
PUFA在之前关于肿瘤的研究中,它是细胞发生铁死亡的一个重要前提,在通过诱导肿瘤发生铁死亡改善肿瘤治疗策略的研究中立过不少大功,但它在肿瘤转移中发挥的作用目前了解得还不太清楚。近期,西湖大学/西湖实验室邹贻龙和王曦团队系统性地解析了支持卵巢癌细胞远端转移的脂类代谢基础,并揭示了PUFA在肿瘤转移不同阶段发挥的多方面作用,并将这一成果以《ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization》为题发表在国际期刊Cell上。
1.泛癌转移潜能:铁死亡敏感性关联性分析
为了识别具有高转移潜能的肿瘤细胞系的潜在弱点,研究人员通过整合泛癌数据库MetMap(Cancer Metastasis Map)和药物响应数据库CTRP(Cancer Therapeutics Response Portal)进行分析,发现肿瘤远端转移能力可能与多种化合物的敏感性密切相关(图1A-B)。特别地,铁死亡诱导剂与多种高转移潜能的癌症谱系之间存在显著关联,且这种关联在多个器官中均得到体现(图1C-E)。进一步的脂质组学分析表明,与原位肿瘤相比,转移性肿瘤显示出更高水平的多不饱和脂肪酸(PUFA)和较低水平的MUFA。其中,细胞膜中的PUFA被认为是细胞发生铁死亡的关键驱动因子(图1F-J)。这些代谢物分析结果与数据库中的发现一致,表明高转移潜能的肿瘤细胞具有较高的PUFA水平,并对铁死亡诱导剂表现出更高的敏感性。

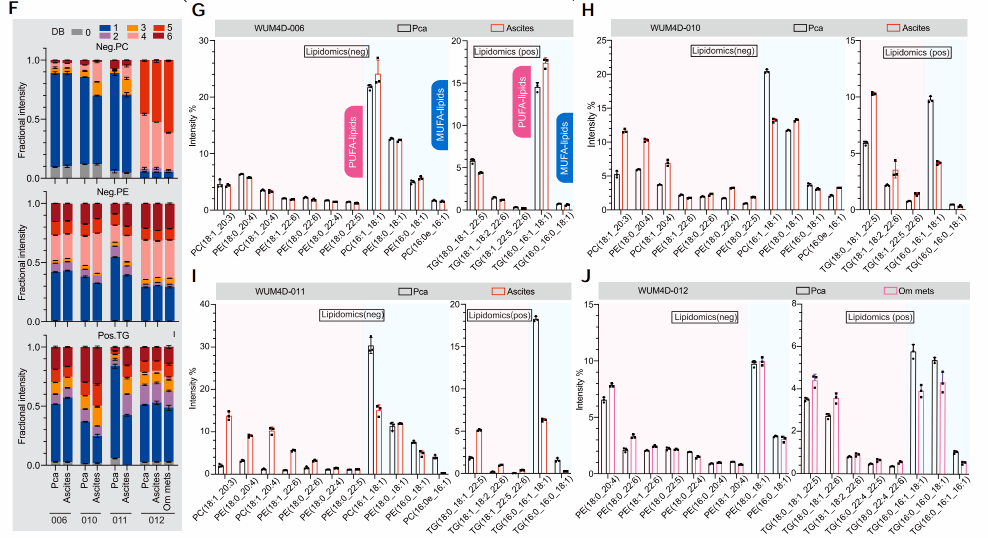
图1 泛癌表型数据分析联合化合物分析揭示在特定谱系中转移能力和铁死亡敏感性之间的相关性
2.建立新的卵巢癌内脏转移模型并在体内筛选促转移的基因
为了构建合适的研究模型,研究者在体内对已知具有较强转移能力的ES-2细胞系进行了多轮筛选,成功筛选出具有多途径转移潜能的肿瘤细胞克隆,并最终获得了具有不同转移能力的亚细胞系ES-2-MC1-Hep和ES-2-MC2-Lung(图2A-H)。在这两种亚细胞系中,研究者根据其转移能力和腹腔定植能力,重点对ES-2-MC1-Hep进行了与代谢相关的基因筛选,特别关注了ACSL4这一不饱和脂肪酸代谢相关基因。结合数据库数据和单细胞数据分析,发现ACSL4在该模型的转移能力中发挥了重要作用(图2I-J)。
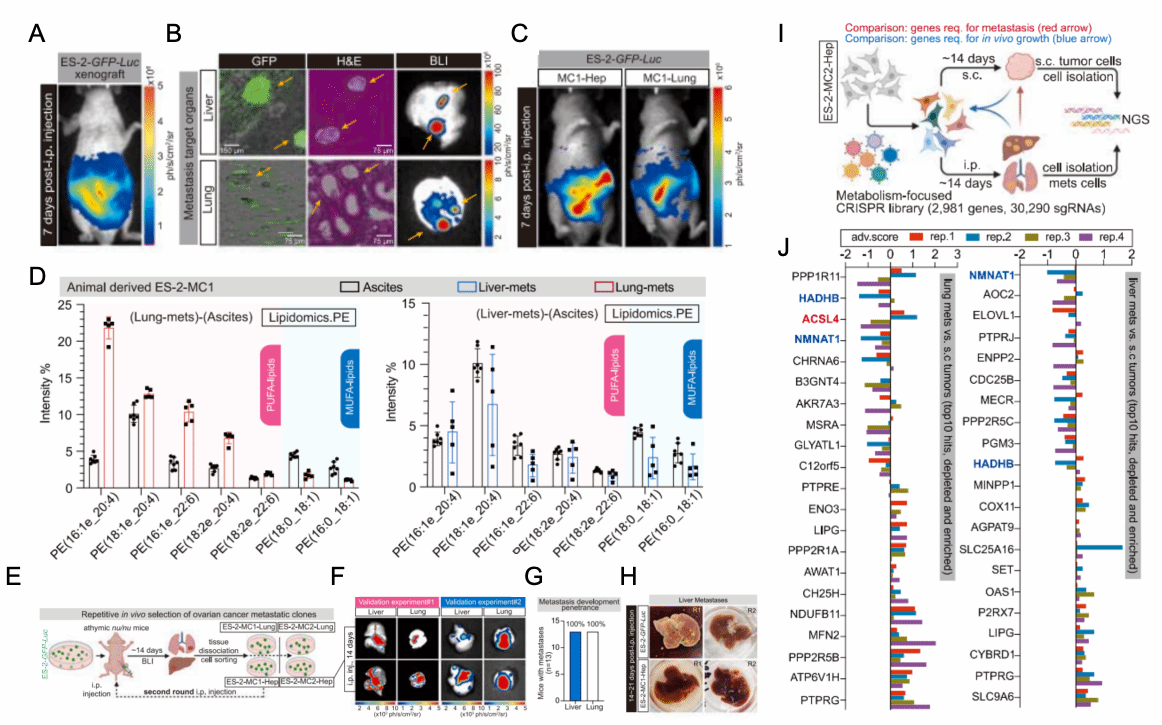
图2 建立小鼠卵巢癌远端转移模型并进行体内遗传筛选
3.ACSL4在血行转移中促进肿瘤细胞外渗
敲低ACSL4的ES-2-MC2-Hep相比于野生型,侵袭,定植能力受损,并且在ACSL4的抑制剂处理下有同样的表现,提示ACSL4对肿瘤的转移能力的重要性(图3A-F)。由于ACSL4的底物是PUFA,是细胞膜的主要成分,本研究中发现ACSL4的抑制会损害具有转移能力的肿瘤细胞系的细胞膜流动性和侵袭性(图3G-H)。同时,用花生四烯酸对转移能力相对较弱的细胞进行PUFA的外源补充后,这些细胞的转移能力明显增加。以上结果提示ACSL4和PUFA有促进肿瘤转移的能力(图3I-J)。

图3 ACSL4通过合成PUFA增加细胞膜流动性和细胞侵袭性促进肿瘤的转移
4.富含不饱和之类的肿瘤细胞在体内的生长依赖ECI1/ECH1
尽管ACSL4的敲除显著抑制了肿瘤的转移能力,但由于肿瘤细胞系本身具有较高的侵袭性,随着时间的推移,少量定植的肿瘤转移灶在后期可能变得难以控制。这个现象可能的解释是,随着转移灶的进一步生长,其对ACSL4的依赖性逐渐降低。通过重新分析之前CRISPR筛选结果中的移植前后肿瘤的sgRNA丰度变化,研究发现并揭示了转移灶生长阶段对以ECI1和ECH1为主导的不饱和脂肪酸β-氧化的依赖性(图4)。
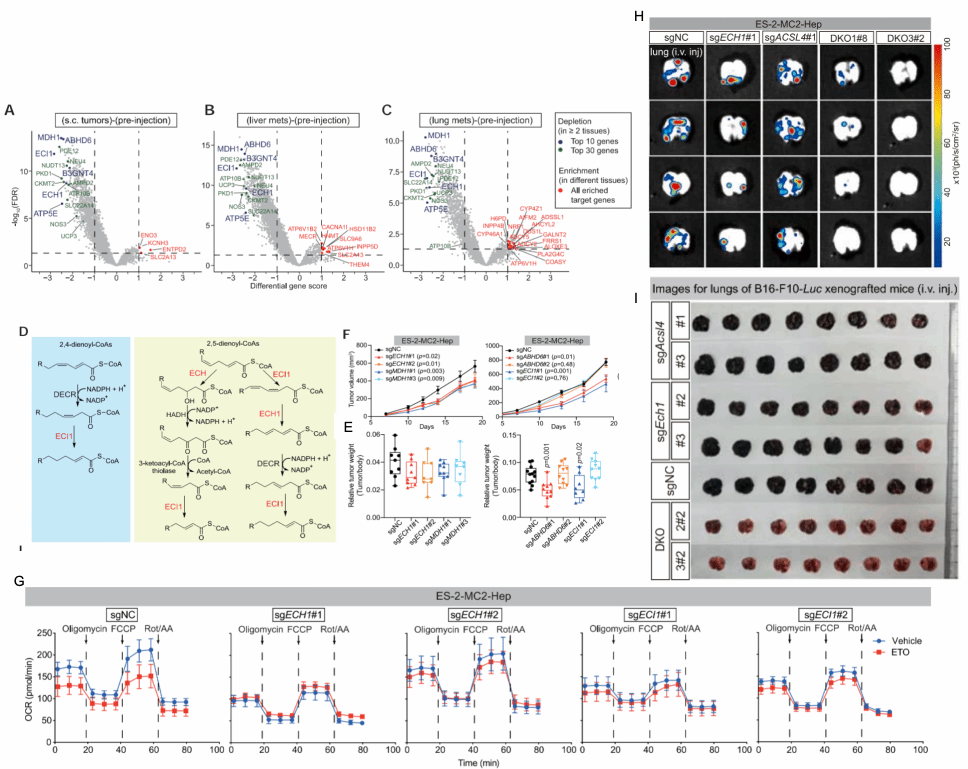
图4富含不饱和脂肪酸的肿瘤细胞在体内的生长依赖ECI1/ECH1介导的不饱和脂肪酸的β-氧化
总结
肿瘤转移到远端器官需要癌细胞具备高度的形态和代谢适应能力。然而,细胞脂质在肿瘤转移中的作用仍不完全明确。
在这项研究中发现肿瘤的转移潜力与铁死亡的易感性之间存在一定关联。来自卵巢癌转移灶的癌细胞比来自原发肿瘤的癌细胞更容易发生铁死亡,并且它们含有更多的PUFA。
在小鼠卵巢癌转移模型中,经过两轮体内筛选,研究者通过代谢相关的基因筛选发现,ACSL4(一种合成长链脂肪酰辅酶A的酶)是促进血源性转移的关键因素。ACSL4通过增强细胞膜的流动性和细胞的侵袭性,促进了转移灶的形成。
此外,高PUFA脂质状态还使得癌细胞在代谢上依赖于一些关键酶,如ABHD6、ECI1和ECH1,这些酶参与准备不饱和脂肪酸进行β-氧化。通过同时抑制ACSL4和ECH1,可以有效抑制肿瘤转移。本研究揭示了PUFA脂质在肿瘤进展和转移中的双重作用,这一发现可能为未来的治疗策略提供新的思路。
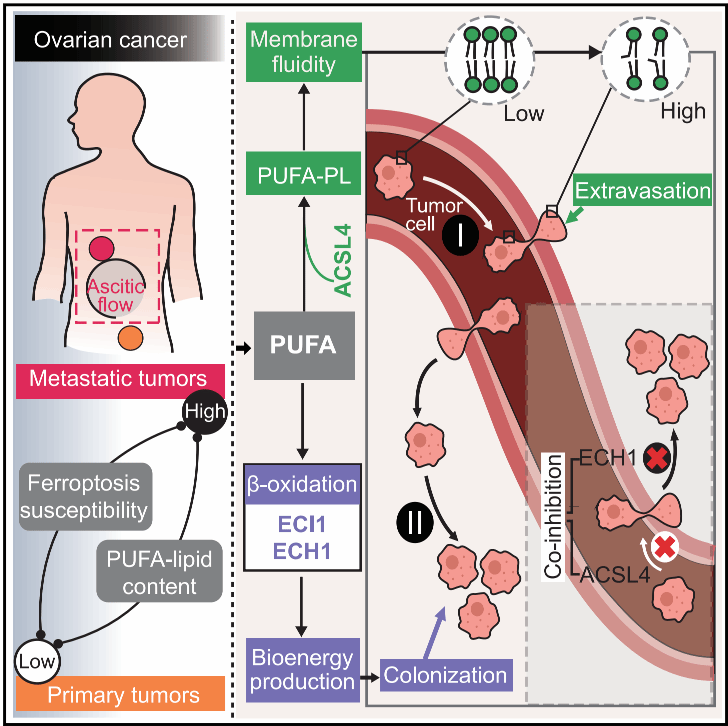
图5
参考文献
1. Ganesh, K., and Massague´ , J. (2021). Targeting metastatic cancer. Nat.Med. 27, 34–44.
2. Boire, A., Burke, K., Cox, T.R., Guise, T., Jamal-Hanjani, M., Janowitz, T., Kaplan, R., Lee, R., Swanton, C., Vander Heiden, M.G., et al. (2024). Why do patients with cancer die? Nat. Rev. Cancer 24, 578–589.
3.Wang Y, Hu M, Cao J, et al. ACSL4 and polyunsaturated lipids support metastatic extravasation and colonization [J]. Cell, 2024.
4.Stockwell B R, Friedmann Angeli J P, Bayir H, et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease [J]. Cell, 2017, 171(2): 273-85.
本文作者:邱志欣组张胜楠