你是否想过,为什么人类婴儿需要数十年才能完全成熟,而同样的过程在小鼠体内却只需几周?这背后不仅关乎体型差异,更与不同物种间大脑发育的独特节奏密切相关。相比于小鼠,人类大脑皮层神经元需要数年才能发育成熟,这种“慢工出细活”的模式,这被认为是人类高级认知能力的生物学基础。一项发表于《Science》的研究揭示了这一现象背后的关键机制——线粒体代谢的“生物钟”。
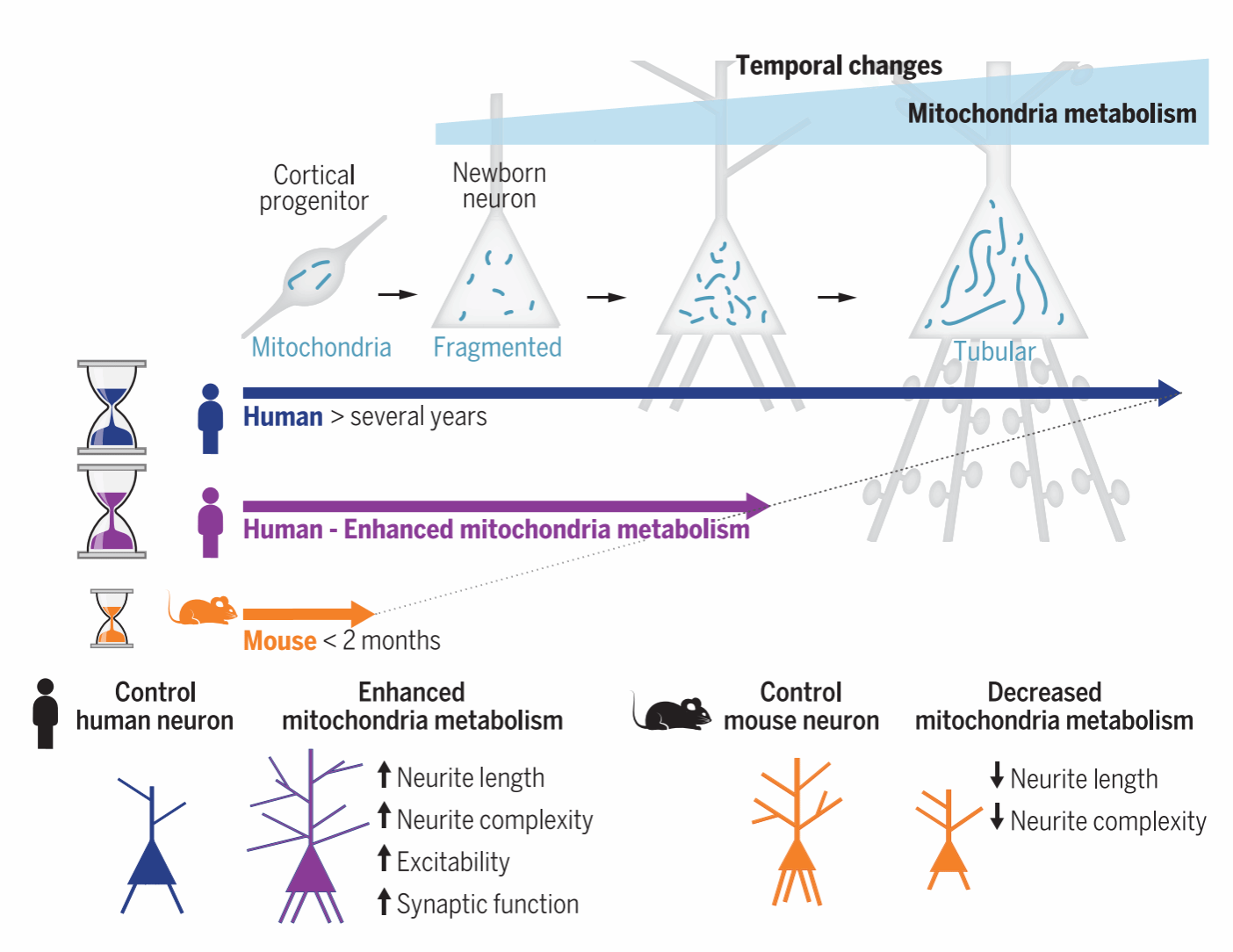
来自比利时的布鲁塞尔自由大学的研究人员通过对比人类与小鼠皮层神经元的发育过程,发现:
1.线粒体发育的“物种时钟”:人类新生神经元的线粒体数量少、代谢活性低,需数月逐渐成熟;而小鼠仅需3-4周。
2.代谢活性差异显著:人类神经元氧化磷酸化活性明显低于小鼠,有更低的线粒体代谢水平。
3.调控代谢可“加速发育”:通过抑制乳酸脱氢酶(LDHA)或添加游离脂肪酸,人类神经元成熟速度显著提升,突触形成和电活动提前数周出现。
研究者分别使用了人源和鼠源的多能干细胞(PSC),在体外培养为皮质椎体神经元,来研究神经元的发育。
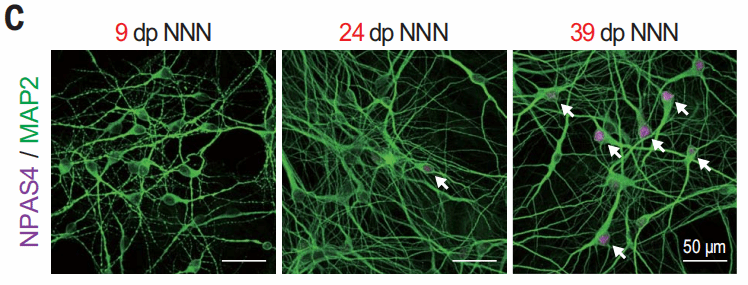
为了提高研究的时间分辨率,他们开发了NNN标记法,相当于一个改造过的CreERT系统,其前端加了一个NeuroD1启动子,它只有在细胞分化为神经元时生效启动;后面的CreERT2包含了雌激素受体的配体结合区突变体,在有他莫昔芬诱导的情况下,它可以与ERT结合,使Cre-ERT2进核发挥Cre重组酶活性,让细胞带上荧光marker-eGFP,这样就能判断某个时间点有哪些细胞已经趋于成熟。而且这个eGFP还融合了CD8,方便后续的鉴定和纯化。
通过这种方法,可以很直观地看到神经元随着时间的成熟进程。
通过MACS,用结合了磁珠的抗体去标记CD8+细胞,也成功地分离出了纯化的细胞,这些神经元的模式相似,且其基因表达随着时间趋于成熟。
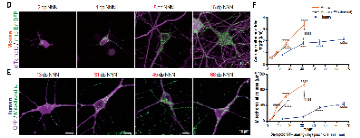
接下来,为了研究皮质神经元发育过程中线粒体的变化,作者们将NNN标记应用在线粒体中,将绿色荧光蛋白融合到线粒体靶向序列上,也就是EmGFP。
可以看出,在小鼠中,新生的神经元里线粒体很小而且数量不多,在之后的三周内,线粒体的大小和数量都在逐渐增长;在人皮质神经元中,神经元线粒体的发育耗时更久,但发育趋势相同。

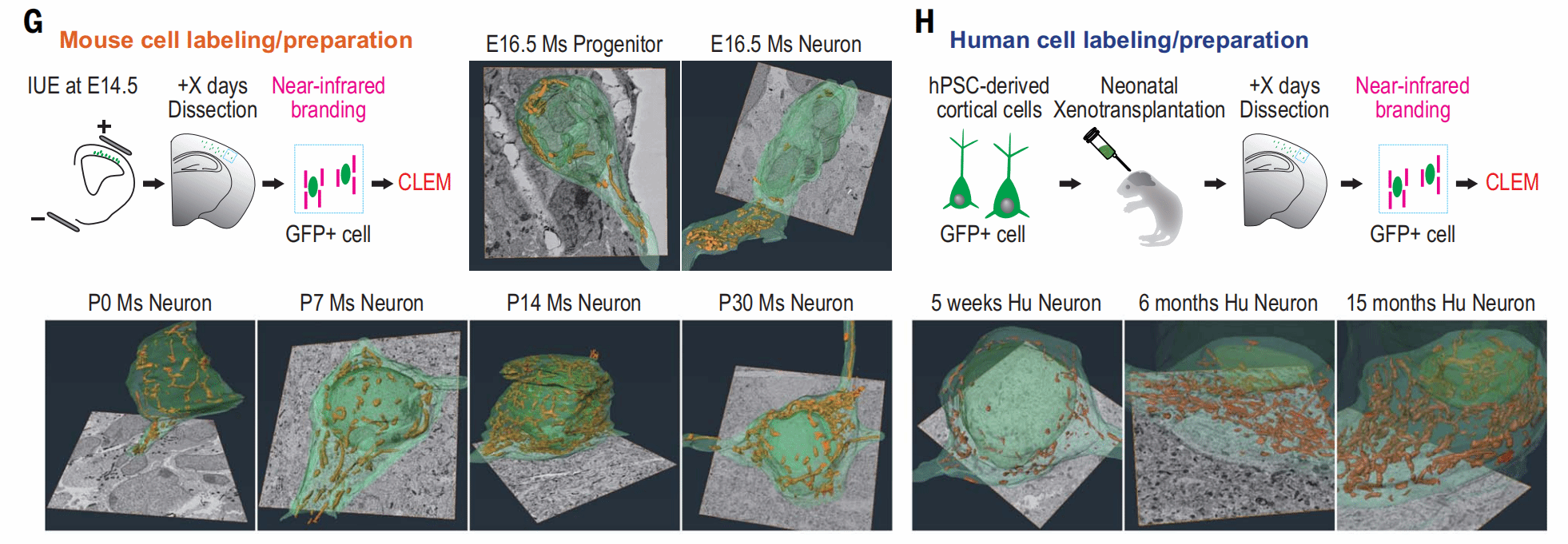
至此,体外的现象已经明确了,接下来作者们又在体内监测了小鼠胚胎的皮质神经元线粒体。
在小鼠胚胎发育第14.5天,通过体内电穿孔用eGFP标记小鼠胚胎的皮质神经元,随后进行CLEM分析,在荧光显微镜结果中叠加电镜照片,获得了高分辨率的细胞结构信息,其中黄色代表线粒体结构。在小鼠体内,线粒体的大小和丰度在出生后第三周达到最大水平。
此外,作者还将诱导而来的人皮质神经元移植到了小鼠脑内,移植后的神经元成熟过程耗时数月,明显慢于小鼠,这与之前的结果也是类似的。这提示,神经元线粒体的发育与神经元成熟程度相关,并且存在物种差异。
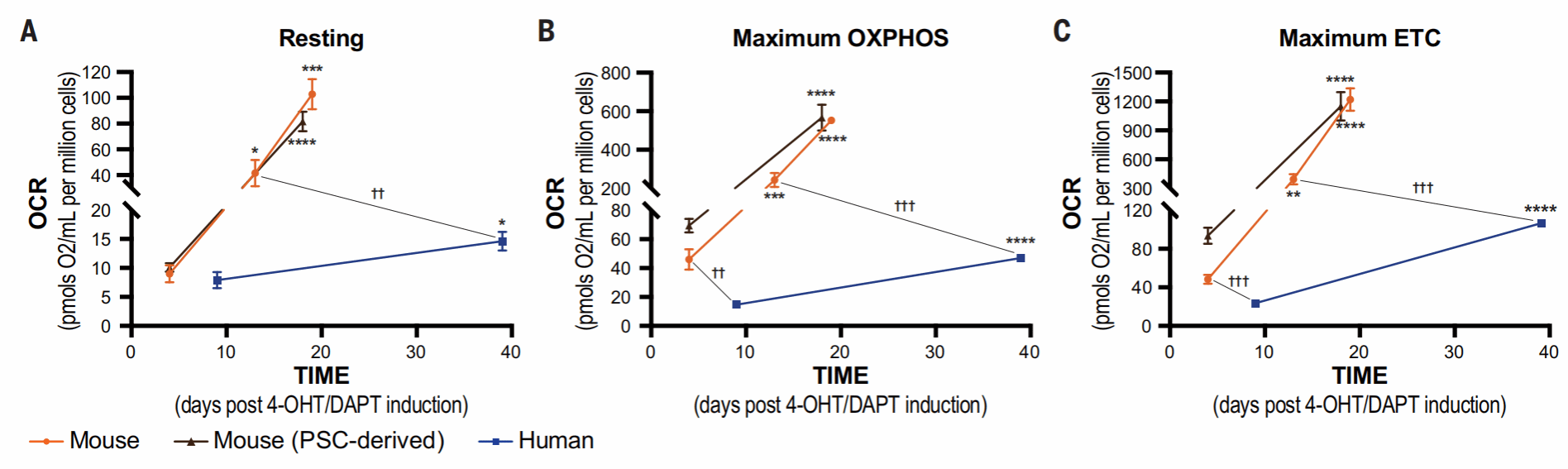
接下来,作者们研究了线粒体在神经元发育过程中的功能特性,包括氧化磷酸化(OXPHOS)和电子传递链(ETC)的功能
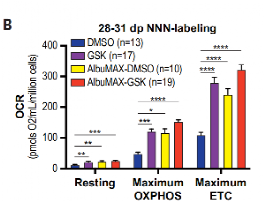
用Oxygraph液相氧电极法,测量了小鼠和人皮质神经元的线粒体耗氧率OCR,可以看出,在早期阶段,小鼠线粒体OCR高于人类且增加速率更快,这也与之前形态学的结果一致。
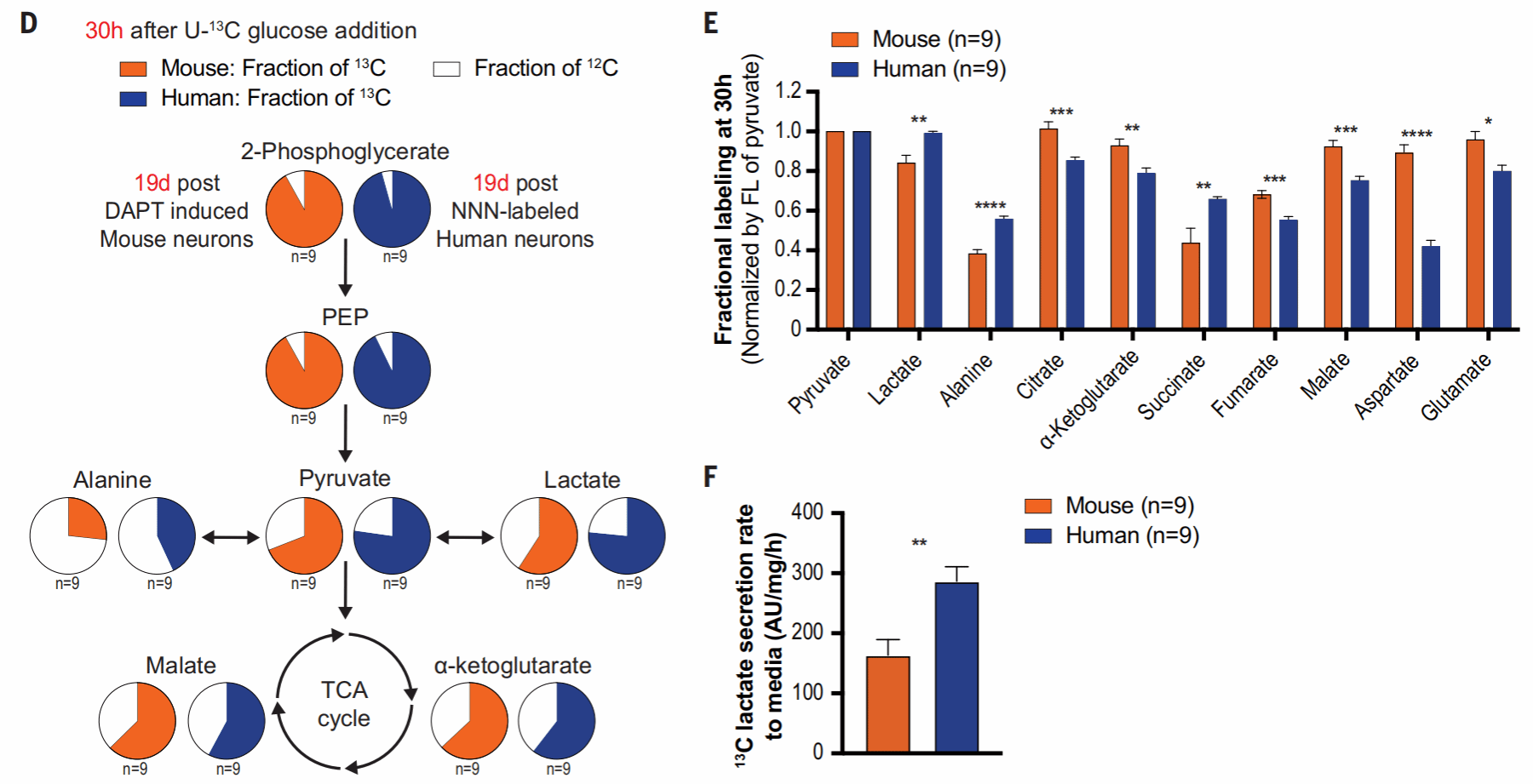
接下来,作者又使用了碳13质谱方法监测了人和小鼠皮质神经元的糖代谢。
可以看出,TCA循环代谢产物(苹果酸Malate,α-酮戊二酸α-ketoglutarate)在人类神经元中比小鼠低,代表了更低的线粒体代谢水平。所以,与同龄小鼠相比,人具有更低的线粒体活性。
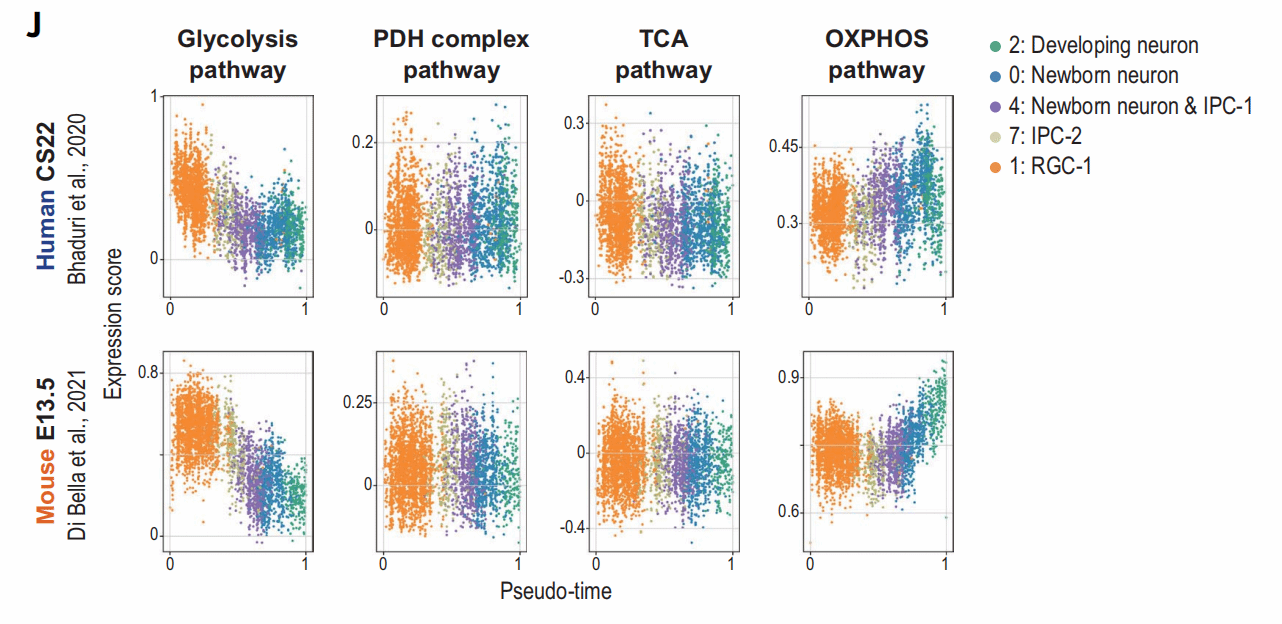
至此,我们已经发现了神经元成熟过程中的线粒体代谢差异,接下来,为了进一步探究差异形成的原因,作者们回顾了之前的单细胞测序数据,可以看出,在人和小鼠体内,随着时间的增加,与OXPHOS相关的基因总体增加,与糖酵解相关的基因减少,而且这一现象在小鼠细胞中发生得更早,这也解释了之前观察到的线粒体活性差异。
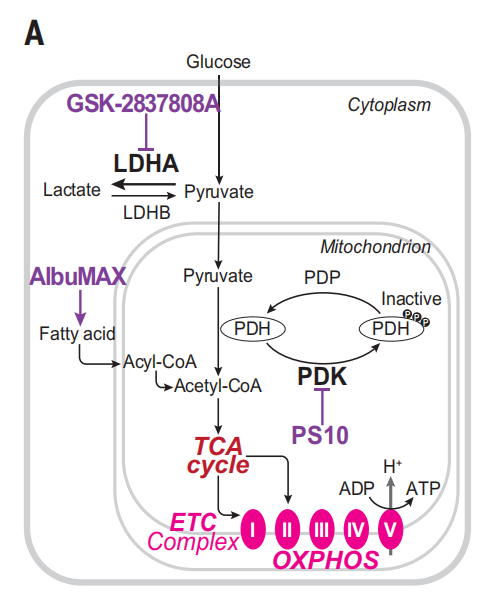
既然已经观察到了线粒体功能发育与神经元发育的相关性,那么,是否可以通过改变线粒体代谢来控制神经元的成熟速度呢?
作者们首先使用了GSK来抑制LDHA,减少丙酮酸向乳酸的转化,从而增强线粒体活性。可以看出,GSK处理后人类神经元中的线粒体OCR增加。
同样地,如果用游离脂肪酸AlbuMAX处理,促进TCA循环,也同样的导致了线粒体OCR的增加。如果将AlbuMAX与GSK联用,效果也有所提升。
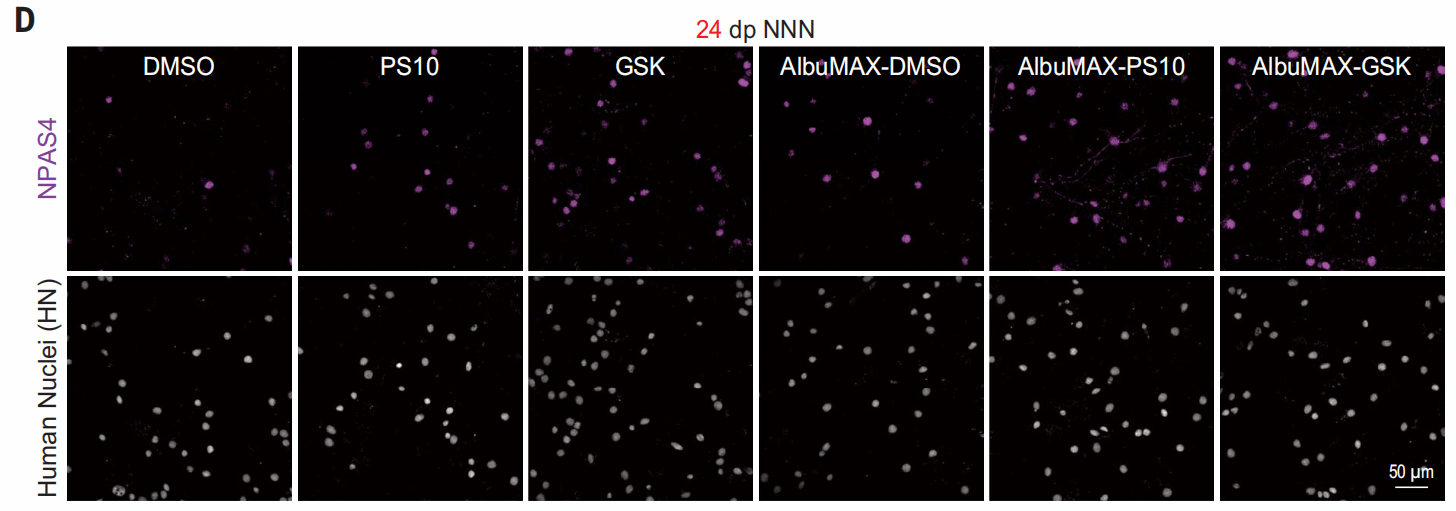
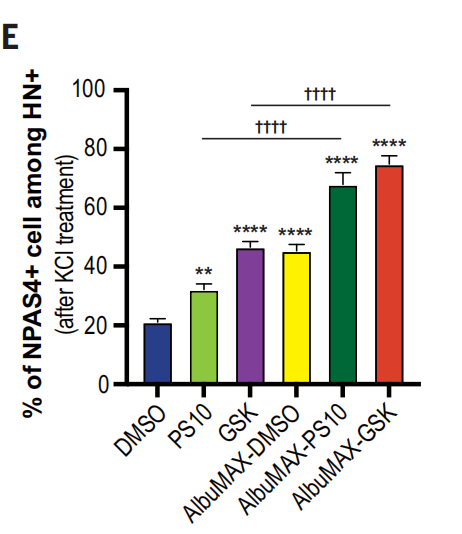
为了验证这些提高线粒体活性的处理对神经元的影响,作者们用加入KCl后神经元的膜去极化反应来评估神经元的兴奋性,这个兴奋性的判断以活性依赖的NPAS4蛋白表达数为基准。
可以看出,不加处理时,人皮质神经元在发生数周后才会对KCl有反应。
在给予GSK或AlbuMAX后,NPAS4+的细胞比例增加,表明神经元成熟加速。并且,AlbuMAX和GSK的作用是相加的。
其他促进线粒体代谢的处理也导致神经元成熟加速,如PS10(丙酮酸脱氢酶抑制剂)。
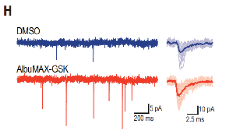
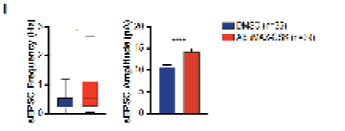
接下来,作者又用膜片钳记录了AlbuMAX-GSK处理后人皮质神经元的膜电位,发现突触后电流的频率和幅度都有所增加,同时膜电位降低,这与神经元功能的成熟趋势一致。
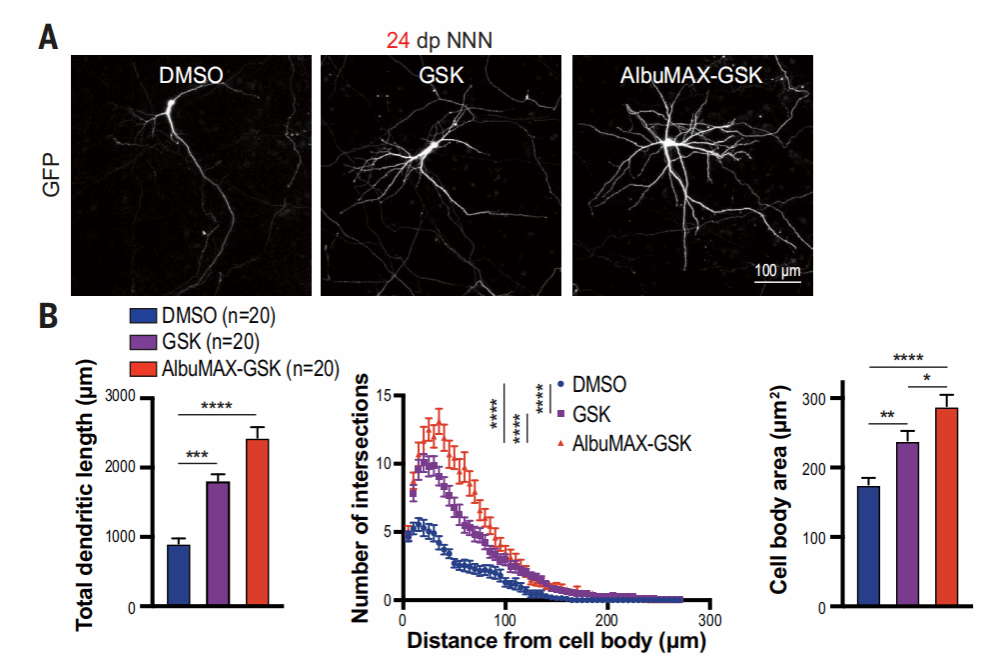
接着,作者又从形态方面探究了线粒体活性对神经元成熟的影响。
AlbuMAX-GSK处理后,人皮质神经元的大小、树突长度和复杂性都有明显增加。经过处理后,神经元在第24天达到了对照组第58天的成熟水平,表明增强线粒体代谢可以加速神经元的形态发育。
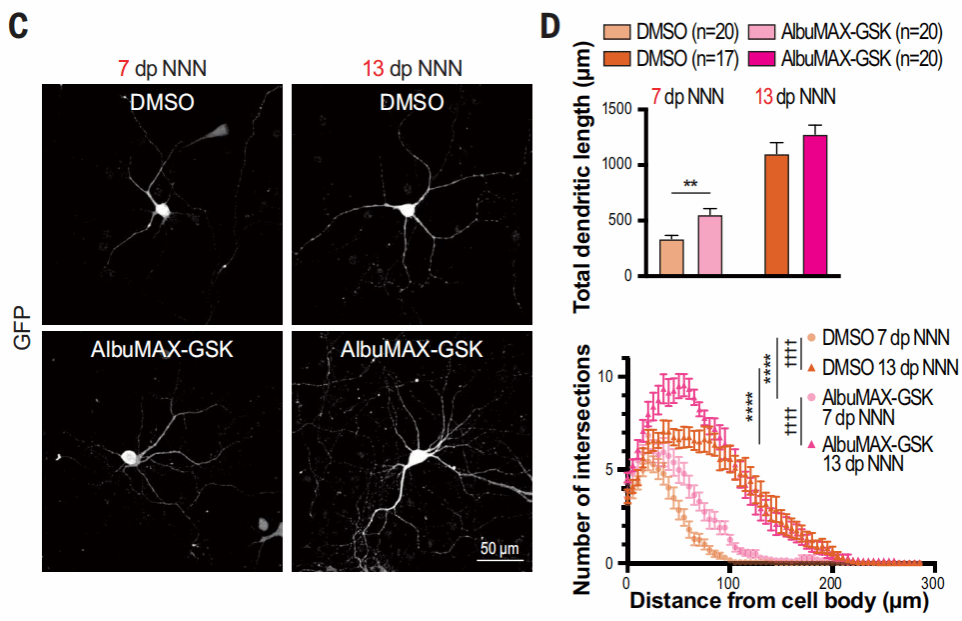
在小鼠神经元中,AlbuMAX-GSK处理也会导致树突生长增加,但程度低于人类神经元。
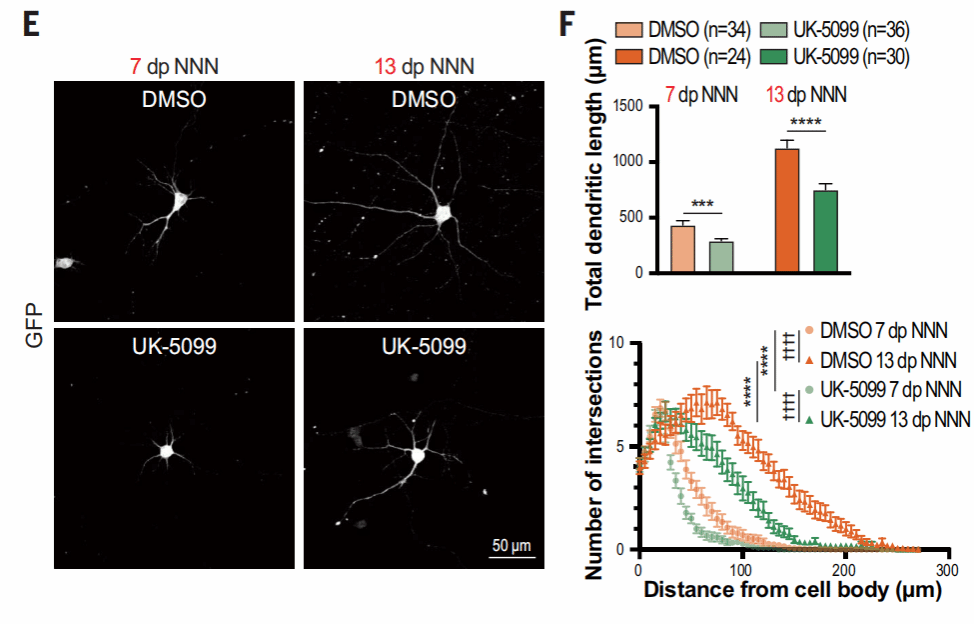
接着,作者又用UK-5099抑制线粒体丙酮酸吸收,降低线粒体活性,可以看到,此时树突生长减少,代表了神经元发育速度的减缓。
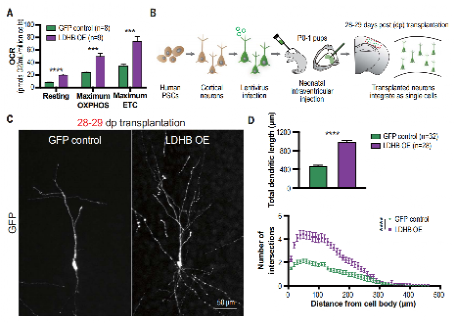
于是,作者又尝试在体内观察。将人皮质神经元移植于小鼠脑皮层,慢病毒过表达LDHB(促进乳酸向丙酮酸的转化)。可以看出,过表达LDHB导致体外培养的神经元线粒体OCR增加,将该神经元移植后,在第四周可以观察到明显的树突长度和复杂性增加,这相当于对照条件下2至3个月的成熟程度。
本研究具有重要的现实意义:
●疾病模型优化:目前干细胞分化的神经元模型耗时过长,通过代谢调控可加速进程,助力阿尔茨海默病等研究。
●进化启示:人类大脑的“延迟成熟”可能通过延长可塑性窗口期,为复杂认知功能提供基础。
●跨物种研究:该机制或可解释其他器官发育的物种差异,为再生医学提供新思路。
论文通讯作者Pierre Vanderhaeghen教授表示:“这项研究首次将代谢时钟与神经元发育速度直接关联,为理解人类大脑独特性提供了分子层面的解释。”
本文作者:王涛组田静