蛋白质的功能取决于分子内的氨基酸残基运动。若想真正了解蛋白质的功能,不仅需要了解其原子细节中的静息结构,还需要了解其每个反应中间体的动力学和能量学。[1]
钾离子通道不仅参与负责建立和维持细胞膜的静息电位,同时也参与调节细胞的电活动,决定着动作电位的发放频率、幅度和重复放电活动的模式。钾离子通道特异性地允许钾离子通过质膜,过去大量的研究已基本明确其选择性渗透的基本原理。因此,钾离子通道的选择性过滤器(selectivity filter,SF),为我们研究实时的分子内部化学动力学提供了一个很好的模型。[2]
来自芝加哥大学和哈佛大学的科研团队,通过利用电场激发时间分辨率X射线晶体学 (electric field-stimulated time-resolved X-ray crystallography, EFX),对NaK2K中K+传导和渗透机制进行了分析。研究团队通过对NaK2K晶体施加近生理水平的电场,在数百纳秒的时间窗内,对通道中SF的构象状态以及离子的传导路径进行了分析,解释了NaK2K通道内向与外向K+传导过程中的不同机制。该研究于2025年1月发表于cell杂志上。

NaK2K是蜡样芽孢杆菌NaK通道的K+选择性双突变体(图1),近年来成为研究K+渗透的理想模型。[3] 使用该系统,作者观察到了SF在数百纳秒的时间尺度上构象状态和离子跳跃的时间演变。
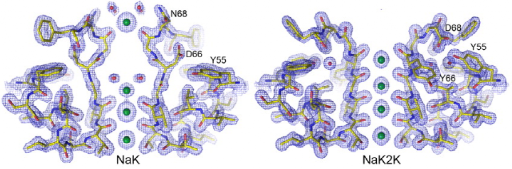
图1. NaK 和NaK2K 的结构
开放状态的NaK2K晶体为I4空间群,在不对称单元中具有头对头取向的分子对。通过将晶体安装在平坦的电极板上,沿孔轴向下,可对晶体施加1 MV/cm范围的电场,两个头对头取向的离子通道在相反方向上受力。因此,在单个晶胞内部就可以观察到电场激发的离子传导随时间的变化。(图2)
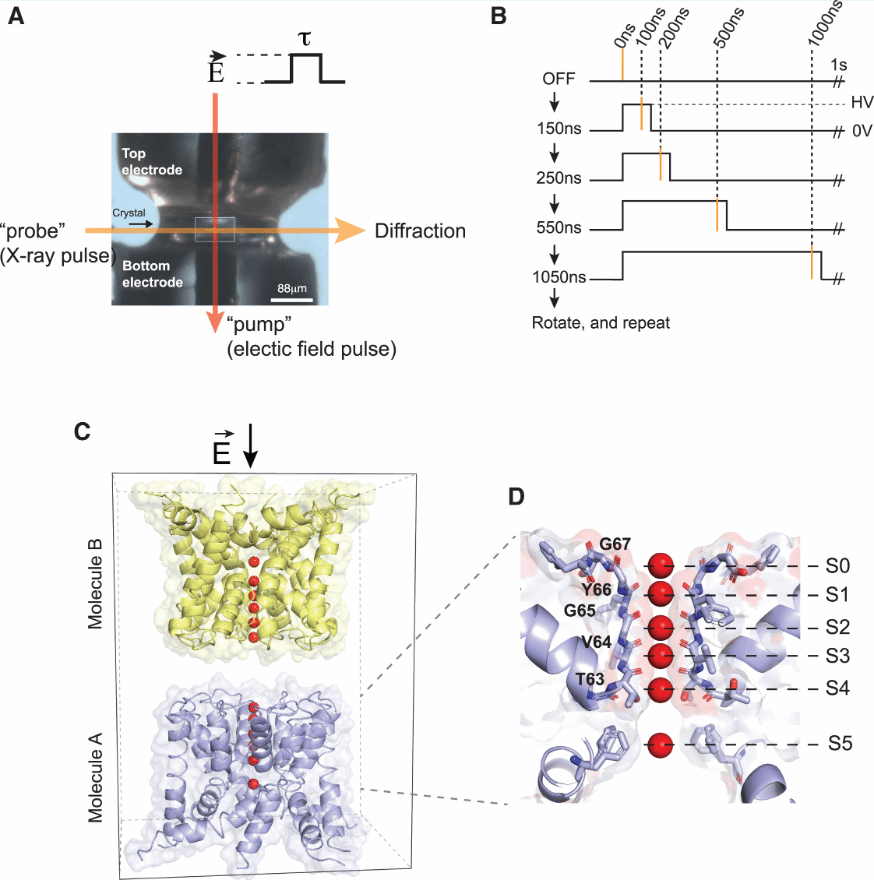
图2.EFX施加电场示意图和NaK2K结构示意图
接下来,作者确认了室温下通道的基态结构。在低温(100 K )和室温(292K)下,孔的所有位点 S1-S4 均完全脱水并被离子占据。随后,作者通过确定一系列结构,研究了离子对结合位点S1-S4的相对基态亲和力。作者采用与K+行为类似但能产生更大散射信号的铊离子(Tl+)进行滴定。当滴定Tl+时,对K+具有最弱相对亲和力的位点将首先被替换,而对K+具有最强相对亲和力的位点将最后被替换。作者观察到,离子对S1-S4位点的相对亲和力顺序为S1<S4<S2<S3。(图3)
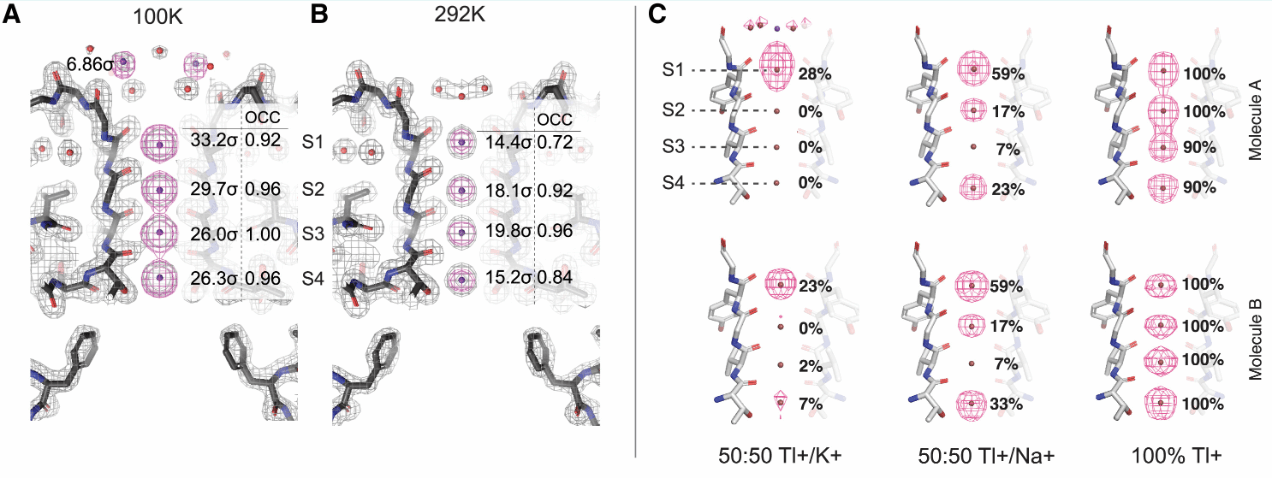
图3. NaK2K通道的基态和不同位点Tl+亲和力差异
利用同晶差值图 (isomorphous difference map) ,作者进一步研究了外加电场对离子传导的影响。作者重点关注了两个时间点(100 ns 和 200 ns)的电子密度变化,观察到分子 A (电场方向为内向) 和分子 B (电场方向为外向) 在电场作用下,离子传导和结构变化的模式存在明显差异。在分子A中,可以看到在(a)处的密度耗尽,在(b)正下方出现新的密度,在S2和S1位置上方的密度耗尽(c),在SF入口(d)附近出现了新的离轴密度。在200 ns时,SF(e)的主链侧面上的密度消失,(f)处出现新密度。100ns到200ns,Phe 92附近发生明显的密度变化,说明Phe 92可能是限流残基。在分子B中,观察到S1离子占有率的即时下降, S5位置在两个时间点均看到密度增加。SF表现出相反方向的横向移位。(图4)
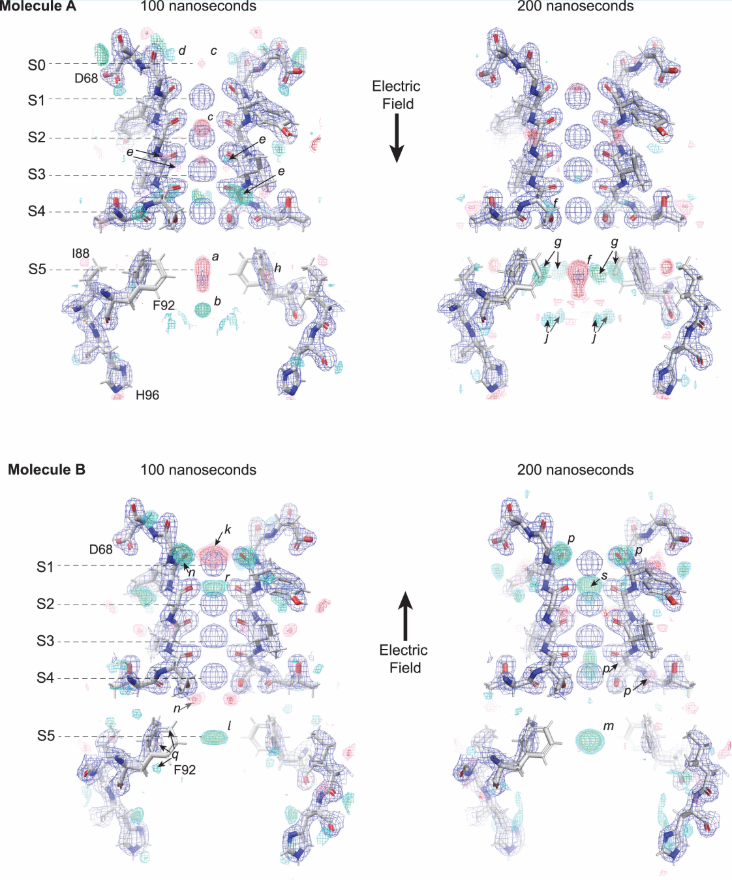
图4. 同晶差值图100 ns(左)和200 ns(右)下的钾离子渗透动力学
作者接着对上述差异进行了进一步的细化。分子B在电场驱动下,离子向外流动,在100 ns时S1离子空位,导致 S2-S4 离子系统性地向上跳跃,并且增加了准备在200 ns时重新填充SF的S5空腔离子的密度。由于S1离子的快速离开导致占有率下降后,SF达到稳态离子占有率,并不比在静止时观察到的低很多。如果SF像电压关闭配置一样保持完全脱水,我们推断 SF 中离子的总占有率在传导周期内在3~4个离子之间变化,这一发现与离子传导的“直接撞击”模型一致。分子A在电场驱动下,离子向内流动,其SF中包含大约三个离子, S4 离子进入腔体并逐步离开后,S1-S3离子向下跃迁以部分占据位置 S1、S2 和 S4,S5位点的离子在100 ns时开始重新水化。以上结果均表明,相反电场方向上的离子传导路径是不同的。(图5)
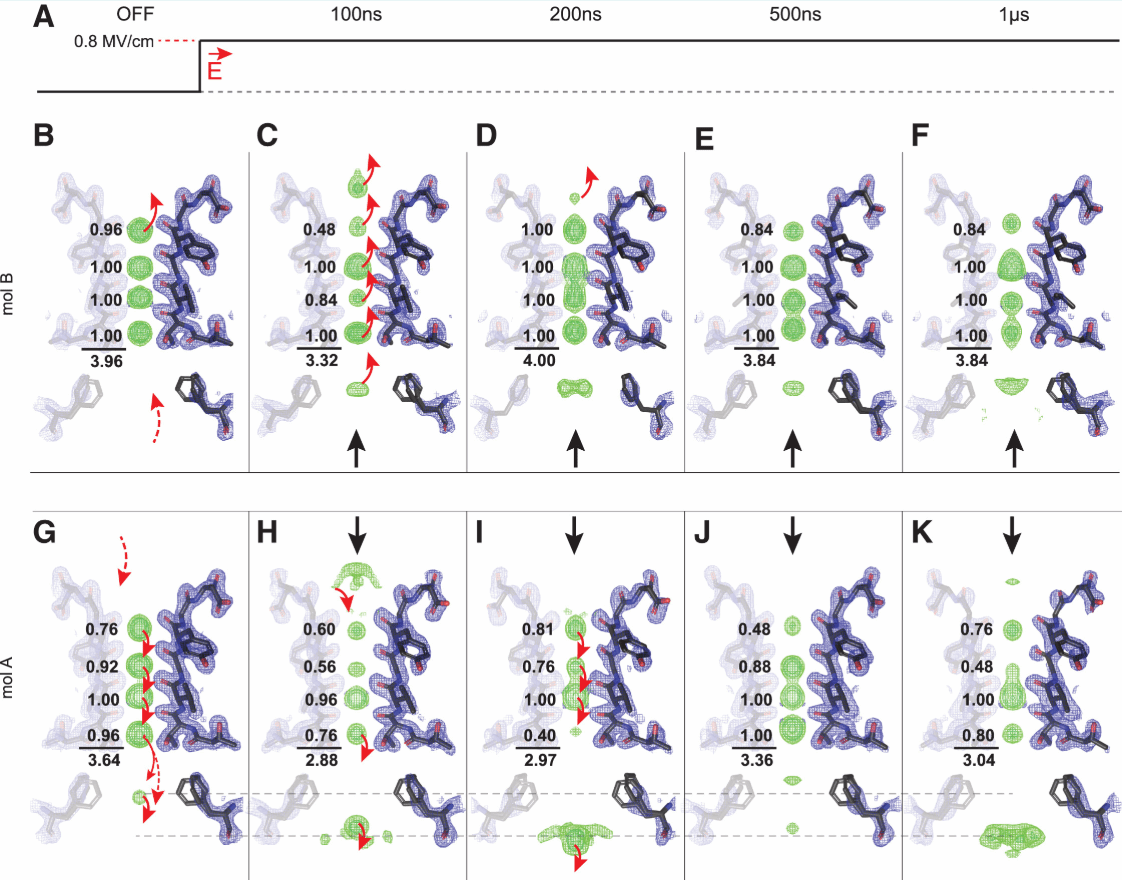
图5. EFX 观察到的选择性过滤器中的离子动力学
传导路径取决于离子流方向,意味着通道残基的运动中存在某种形式的结构差异。作者对分子A和分子B的应变(Strain analysis)进行比较,发现了非常有趣的原子位移。SF在离子传导过程中经历旋转,其旋转的方向与离子流的方向相关。在分子 B 中,变形场的旋度从空腔“向上”指向细胞外侧,也就是SF从外表面观察时逆时针旋转。在分子A中,旋度矢量从细胞外表面“向下”指向空腔,从外部观察SF顺时针旋转。在这两个分子中,旋度矢量都沿电场指向。这种旋转动力学在同源的 KcsA 钾离子通道中也有体现,表明这种现象在阳离子通道家族中可能是非常保守的。(图6)
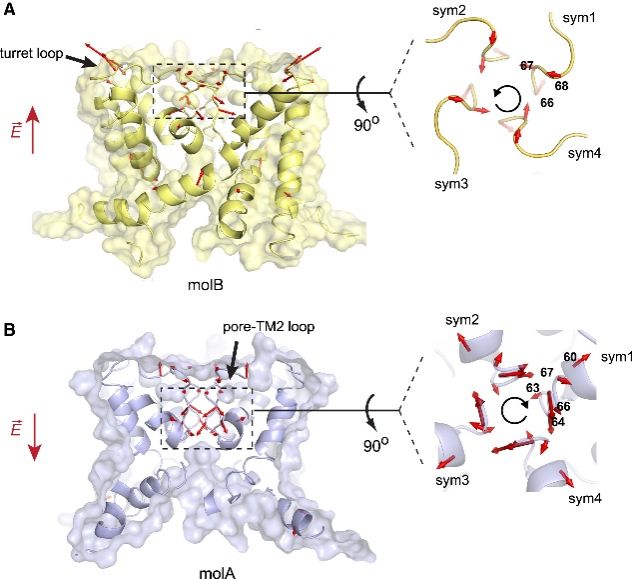
图6. 电场引起的通道构象变化
总结
作者利用EFX,在离子传导过程的时间尺度上,观察到了NaK2K通道中的双向K+传导,并探索了其背后的原子机制。利用电场激发时间分辨率X射线晶体学 (electric field-stimulated time-resolved X-ray crystallography, EFX),我们可以更好地理解SF机制与通道的关键特性(如选择性、整流、门控和失活)之间的联系。此外,作者利用EFX发现SF的旋转动力学在阳离子通道家族中可能具有高度保守性,这提示我们可以利用EFX,探究更多通道同源物之间的“同”与“不同”。这些研究也可能有助于解释基于组成蛋白质家族的氨基酸序列的统计模型,是如何提供有关单个蛋白质内部物理机制的深层信息,从而实现蛋白质工程和从头设计。
目前,使用EFX也面临一些困难,例如信号弱,系统噪声大,大量随机信号干扰等。此外,在当前的电极配置中,在数据收集期间电场方向平行于旋转轴,导致一些反射固有的不可被测量。随着EFX技术应用于更多不同的模型系统,这些方面也将会被不断改善,从而帮助我们更深入的了解蛋白质功能的物理机制。
参考文献
1.Alberts, B. “The cell as a collection of protein machines: preparing the next generation of molecular biologists.” Cell vol. 92,3 (1998): 291-4. doi:10.1016/s0092-8674(00)80922-8
2.MacKinnon, Roderick. “Potassium channels.” FEBS letters vol. 555,1 (2003): 62-5. doi:10.1016/s0014-5793(03)01104-9
3.Derebe, Mehabaw G et al. “Tuning the ion selectivity of tetrameric cation channels by changing the number of ion binding sites.” Proceedings of the National Academy of Sciences of the United States of America vol. 108,2 (2011): 598-602. doi:10.1073/pnas.1013636108
本文作者:李保宾组王子雪