1.
在高中生物课本中我们已经学过:神经元轴突传播动作电位,并在末梢囊泡释放部位将这些电脉冲转化为神经递质释放来调节靶细胞,“快乐细胞”多巴胺神经元(Dopaminergic Neurons,DANs)自然也遵从这个规律。我们常说“多巴胺让我快乐”,它似乎是所有“好事”背后的大脑奖励信号。
但快乐不是无限供应的。我们的大脑从来不是一味“加油门”的机器,它还有一套精准调控的“刹车系统”。2025年3月,《Nature Neuroscience》发表了一项由牛津大学Stephanie J. Cragg教授团队完成的研究,题为:《An axonal brake on striatal dopamine output by cholinergic interneurons》,揭示了纹状体中胆碱能中间神经元(Cholinergic Interneurons, 简称CINs)通过直接作用于多巴胺轴突,施加了一种“刹车”效应,限制多巴胺的释放。这一发现改写了我们对脑内调控路径的传统理解。

截至目前已经存在许多证据证明多巴胺轴突末梢的释放存在调节机制1-4,比如来自西湖大学的刘长亮老师于2023年在《Science》上发表工作证实位于纹状体的ChI可以通过释放乙酰胆碱(Acetylcholine,ACh)使DANs轴突产生了动作电位,进而促使多巴胺释放5。但本文的作者团队提出了疑问:过往多数研究都是证明DAN的下游脑区会通过调控轴突末梢增加多巴胺的释放,那么是否存在抑制性的调控呢?作者团队采用了电生理、光遗传学、等一系列实验进行了相关探索。
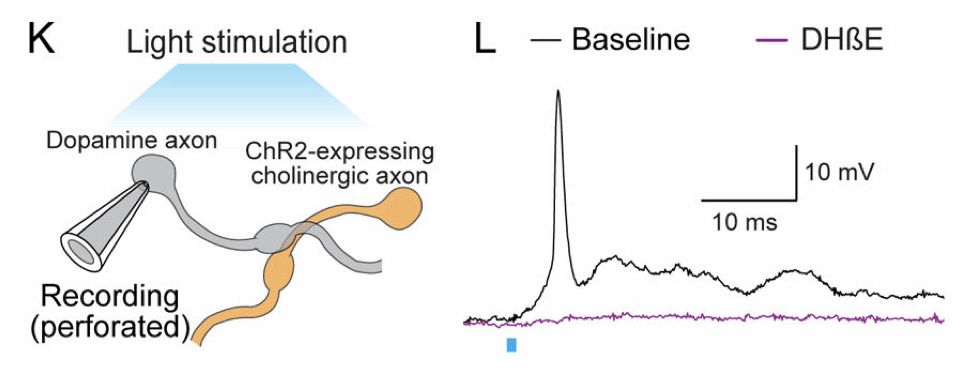
图 1 ChI释放ACh促进多巴胺释放示意图
2.
研究团队首先在小鼠纹状体切片中,通过光遗传学技术激活ChIs,并以电刺激诱导多巴胺释放,同时使用快扫描伏安法(FCV)监测局部多巴胺浓度。他们发现,当在ChIs激活后8~100ms之内给予电刺激时,多巴胺的释放大大减少,甚至下降到原本的20%。但如果提前使用烟碱型乙酰胆碱受体(nAChRs)拮抗剂DHβE阻断乙酰胆碱受体,这种抑制效应就不再发生。这说明,ChIs通过nAChRs激活,使多巴胺轴突在短时间内“冷却”,进入一个不能正常响应后续信号的状态。
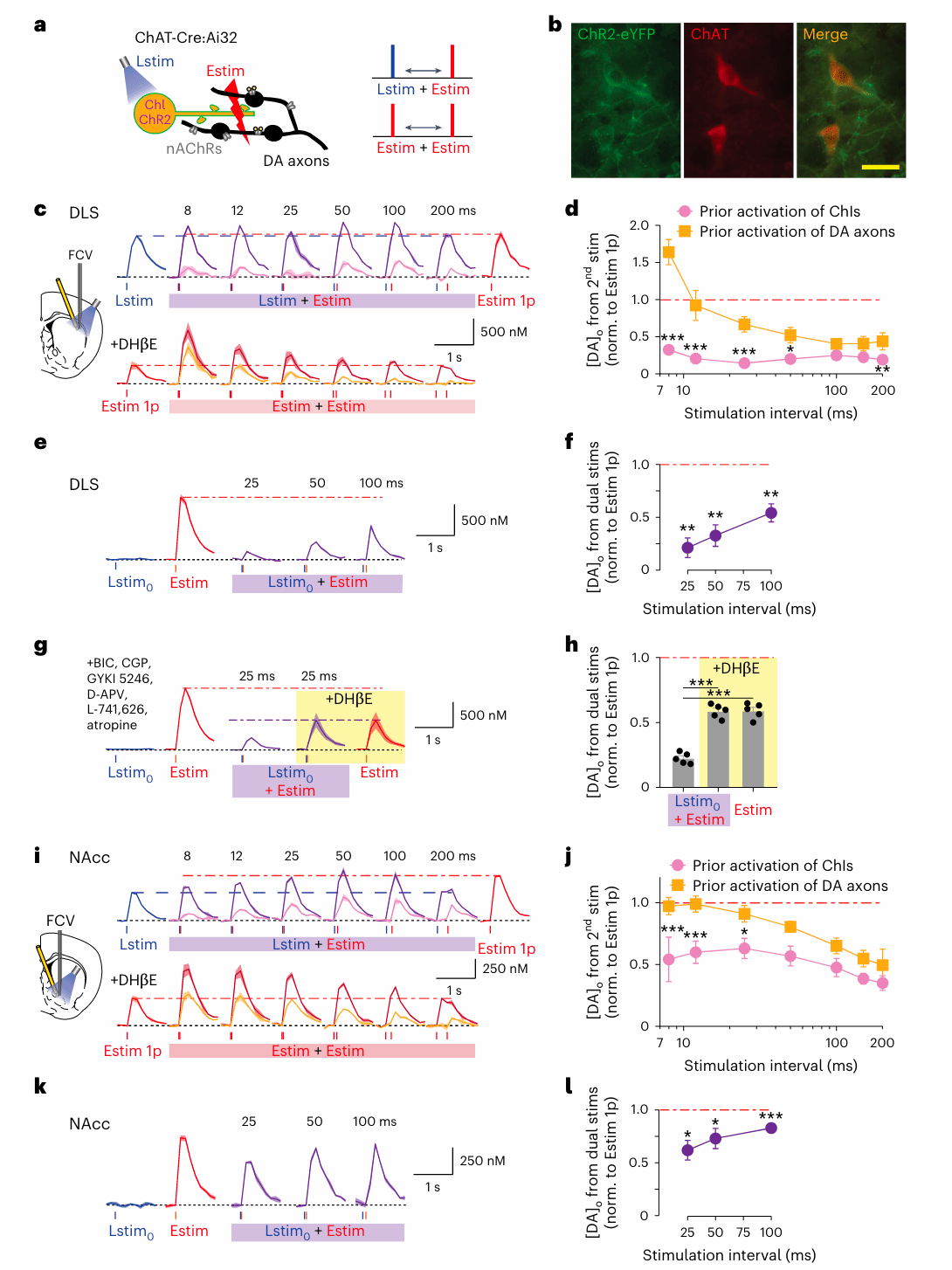
图 2 一次光激活,引发100毫秒的“沉默期”
3.
为了排除电刺激所带来的干扰,在图3实验中,研究者采用了双光遗传学技术,分别表达蓝光通道(ChR2)于ChIs,橙光通道(Chrimson)于DANs的轴突,从而实现对两类神经元的独立精准操控。他们首先以极低强度的蓝光对ChIs进行亚阈值刺激——这种刺激并不会引发可探测的多巴胺释放,但却产生了一个有趣的现象:仅仅在多巴胺释放前25毫秒轻微激活一次ChIs,随后的多巴胺轴突激活所引起的多巴胺释放量显著下降,平均降低约40%至50%。
这一现象不仅出现在背侧纹状体(DLS),在腹侧伏隔核核心区(NAcc)也可观察到,只是抑制程度略弱。更关键的是,这种“隐性刹车”完全依赖于多巴胺轴突上的nAChRs:当使用特异性拮抗剂DHβE阻断这些受体时,原本的抑制作用完全消失。
这些发现说明,即使ChIs的活动本身不足以引发多巴胺释放,它们依旧能通过nAChRs调控多巴胺轴突的兴奋性,以一种“悄无声息”的方式对即将发生的多巴胺释放进行预先干预。这种亚阈值调控机制揭示了大脑中存在着高度灵敏的背景调节系统:神经元之间的作用不仅限于明显的放电与释放行为,也包括低水平信号对后续响应的塑形与抑制。
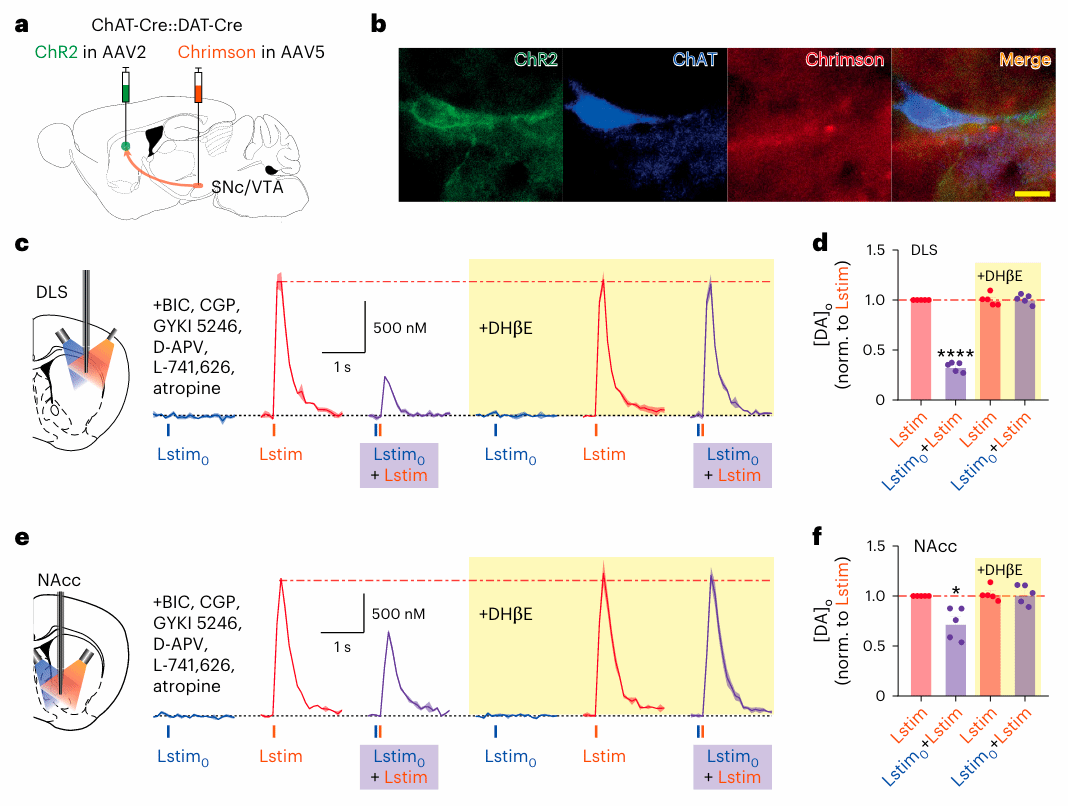
图 3 “轻轻一碰也刹车”:胆碱神经元的亚阈值干预
4.
研究者进一步验证了胆碱能神经元的“刹车”行为是否是普遍规律,而不仅仅是某种特殊刺激条件下的现象。他们在小鼠纹状体脑片中,分别使用电刺激和光遗传刺激对多巴胺轴突进行激活,记录多巴胺释放的变化,并引入不同时间间隔(从7毫秒到200毫秒)来模拟真实神经活动中可能出现的频率差异。结果显示:当在一次电刺激之后,紧接着给予一次光刺激,模拟“ChIs先活跃、多巴胺神经元随后动作”的顺序时,多巴胺释放被显著削弱。 这种抑制最明显出现在时间间隔为25到100毫秒之间,且在DLS中比NAcc更强。
值得注意的是,为了确保这种效应不是因为多巴胺或乙酰胆碱前一次释放后“储备不足”造成的,研究团队通过降低刺激强度、控制释放量,并引入nAChR拮抗剂DHβE,排除了递质耗竭的可能性。只有在nAChR活性的条件下,这种“前一次刺激抑制后一次释放”的现象才成立。这说明,ChIs 的提前激活在很短的时间窗口内会对多巴胺轴突产生“电生理疲劳”效应,即便动作电位来了,多巴胺轴突也进入一种暂时无法释放的“冷却期”。这种抑制机制并不是因为神经递质没了,而是轴突“暂时性不响应”。

图 4 胆碱神经元“抢先放电”,让多巴胺神经元暂时失灵
5.
为了揭示这一抑制效应的细胞机制,研究者利用两种荧光成像探针:GCaMP6f:钙离子荧光探针,可以反映轴突内部钙流入的强度;ASAP3:膜电位探针,可以记录轴突在电刺激下的去极化过程。
在对多巴胺轴突进行高频(4次)刺激时,若事先激活了ChIs,研究团队发现:1)轴突内部的钙离子累积显著减少;2)电压信号也不再像未处理组那样持续增加,而是几乎停留在第一次刺激后的水平。当引入nAChR拮抗剂后,这些现象立即得到逆转,说明抑制确实是由胆碱能信号通过nAChRs介导的。
多巴胺的释放是由钙信号驱动的,而以上实验提供的直接证据表明,nAChRs的激活会让轴突进入一种“电生理迟钝”状态:钙流入减少,膜电位难以被再次激发,整个轴突就像“刚放完电的电池”,一时半会儿带不起火花。
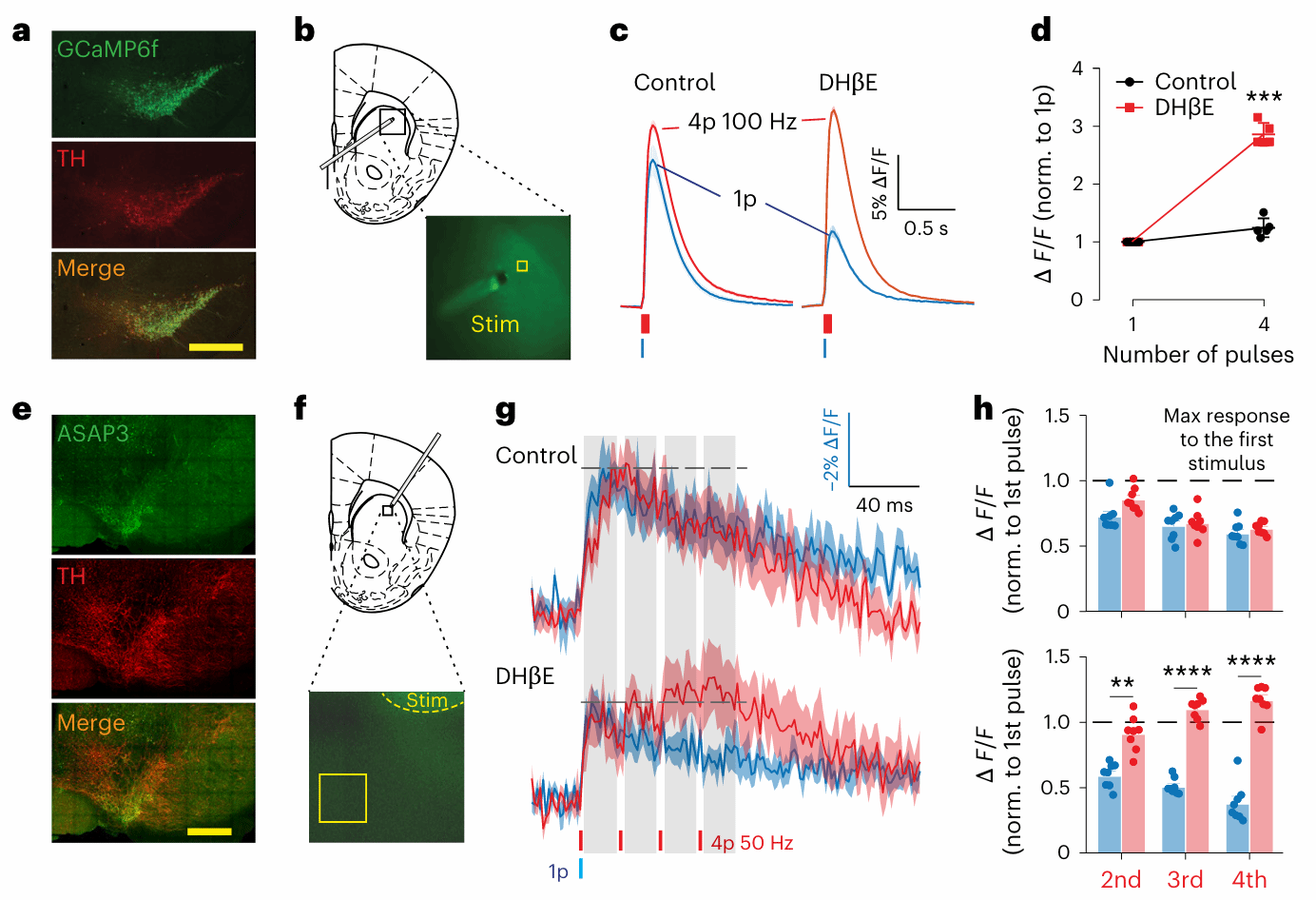
图 5 刹车原理不仅是“化学”,更是“电气”
6.
此外,研究者通过在活体小鼠中使用nAChR拮抗剂,发现当解除ChIs的抑制后,多巴胺的释放显著增强,表明ChIs正在持续抑制DANs的活动。此外,使用GRABDA2m多巴胺感应探针记录发现,即使没有外部刺激,解除ChIs的抑制也会导致自发的多巴胺信号增加。行为学实验进一步表明,小鼠更倾向于偏好注射了拮抗剂的区域,显示解除抑制后奖赏反应增强。这表明,ChIs通过持续抑制多巴胺释放,在调控奖赏学习和动机行为中扮演了重要角色。
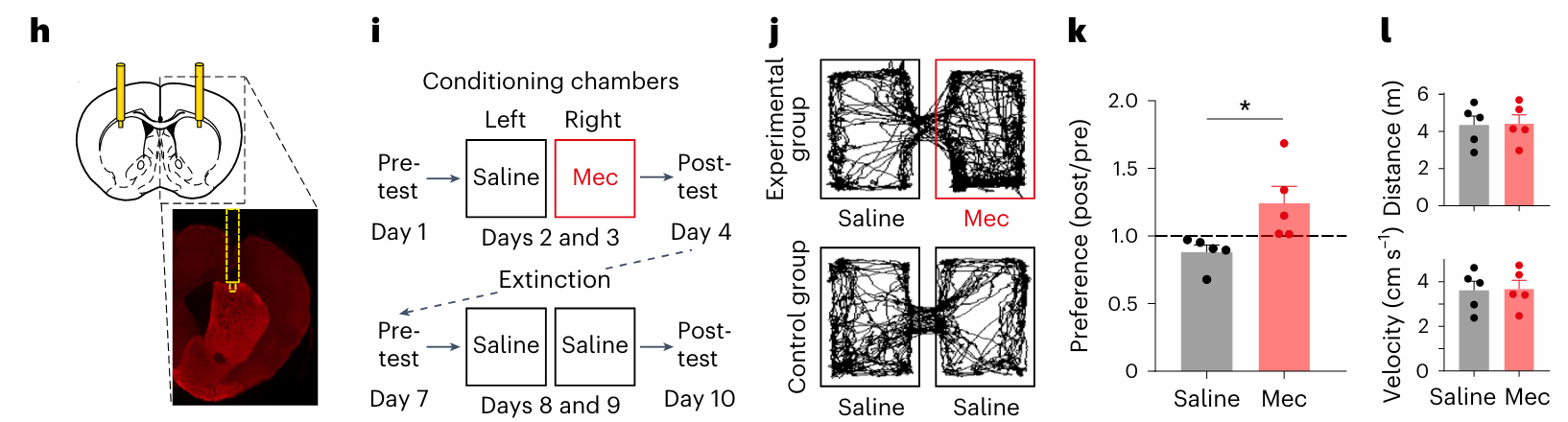
图 6 活体实验也支持“刹车”假说
7.总结
这项研究揭示了大脑中一个重要但被忽视的神经调控机制:ChIs通过“刹车”作用调控多巴胺释放。研究发现,ChIs通过激活多巴胺轴突上的nAChRs,即使在没有显著激发的情况下,也能抑制多巴胺的释放,从而影响奖赏和动机反应。这一机制不仅存在于大脑的切片实验中,也在活体动物中真实存在,进一步揭示了神经调控的复杂性。
这种“刹车”效应可能是大脑精细调控多巴胺系统的一部分,尤其在奖励学习、情绪调节及帕金森病等多巴胺相关疾病中,可能提供新的治疗思路。未来,深入研究这些机制或许能为我们提供更多的神经系统调控策略,帮助开发新的药物治疗方案。
参考文献:
1.Rice, M. E. & Cragg, S. J. Nicotine amplifies reward-related dopamine signals in striatum. Nat. Neurosci. 7, 583–584 (2004).
2.Sulzer, D., Cragg, S. J. & Rice, M. E. Striatal dopamine neurotransmission: regulation of release and uptake. Basal Ganglia 6, 123–148 (2016).
3.Threlfell, S. et al. Striatal dopamine release is triggered by synchronized activity in cholinergic interneurons. Neuron 75, 58–64 (2012).
4.Cachope, R. et al. Selective activation of cholinergic interneurons enhances accumbal phasic dopamine release: setting the tone for reward processing. Cell Rep. 2, 33–41 (2012).
5.Liu, C. et al. An action potential initiation mechanism in distal axons for the control of dopamine release. Science, 378(6615), 1123–1129 (2022).
本文作者:舒友生组何亭羽