生存和繁殖是动物的两大天性[1],但哺乳期的母亲却很难两者兼顾:产奶需要多进食,但离巢觅食会将脆弱的幼崽置于危险当中[2]。那么母亲该如何做出最佳抉择呢?以往的研究已经找出了许多控制摄食与育儿行为的关键神经元群体,但这两类行为通常被分开研究。此外,虽然已有大量工作聚焦于产后“育儿回路”的变化[3-5],却几乎未涉及驱动饥饿感的回路如何调整自身以满足产奶带来的巨大能量需求。
在这一背景下,美国国立卫生研究院Michael J. Krashes研究团队揭示了一个调节摄食和育儿行为的下丘脑环路,并解析了两个不同行为在哺乳期间的适应与相互作用机制。相关研究“A hypothalamic circuit that modulates feeding and parenting behaviours”于近期在线发表在Nature杂志上。
1、ARCAgRP神经元参与哺乳期摄食与育儿行为
作者首先研究了摄食行为在整个母性周期中的变化。经过数周每天称量单独饲养的雌鼠笼内饲料重量,发现分娩后不久,雌鼠的基础日摄食量从11.24千卡急剧增加至41.99千卡,幼崽断奶停止哺乳则导致摄食量骤降(图1a),且哺乳期小鼠的平均日摄食量与产仔数呈正相关(图1b)。为了研究哺乳期摄食行为的昼夜节律,作者使用了第三代摄食实验装置[6]来记录雌鼠每次通过鼻戳获取食物颗粒的时间,结果显示哺乳期小鼠在黑暗期和光照期的摄食量均极显著地增加(图1c)。
为了揭示上述哺乳期暴食的神经机制,作者重点研究了调控代谢的关键脑区——弓状核(ARC)。通过对四组雌性小鼠(分别是未生育雌鼠和哺乳期母鼠,每组又分为自由进食和禁食过夜)的ARC进行单细胞RNA测序(图1f),作者发现Agrp是对饥饿最敏感的集群;进一步比较发现,Agouti相关肽(Agrp)与神经肽Y(Npy,由ARCAgRP神经元共释放),在禁食与哺乳两种生理状态下均呈现程度相当的上调(图1i)。这表明哺乳期雌鼠的ARCAgRP神经元即使在自由进食条件下也表现出“转录组饥饿状态”。
为了验证这一发现,作者使用Npy-hrGFP品系的小鼠标记ARCAgRP神经元并通过电生理记录及钙成像技术,证实了哺乳期雌鼠在进食状态下ARCAgRP神经元的活性高于未生育雌鼠(图1j-m)。这表明哺乳期雌鼠的ARCAgRP神经元对食物更加敏感。特别的是,禁食状态下的未生育雌鼠面对幼崽时表现出杀婴行为,并伴随着神经元活性的持续下降(图1n,o)。这揭示了饥饿状态和育儿行为共同影响ARCAgRP神经元的活动。
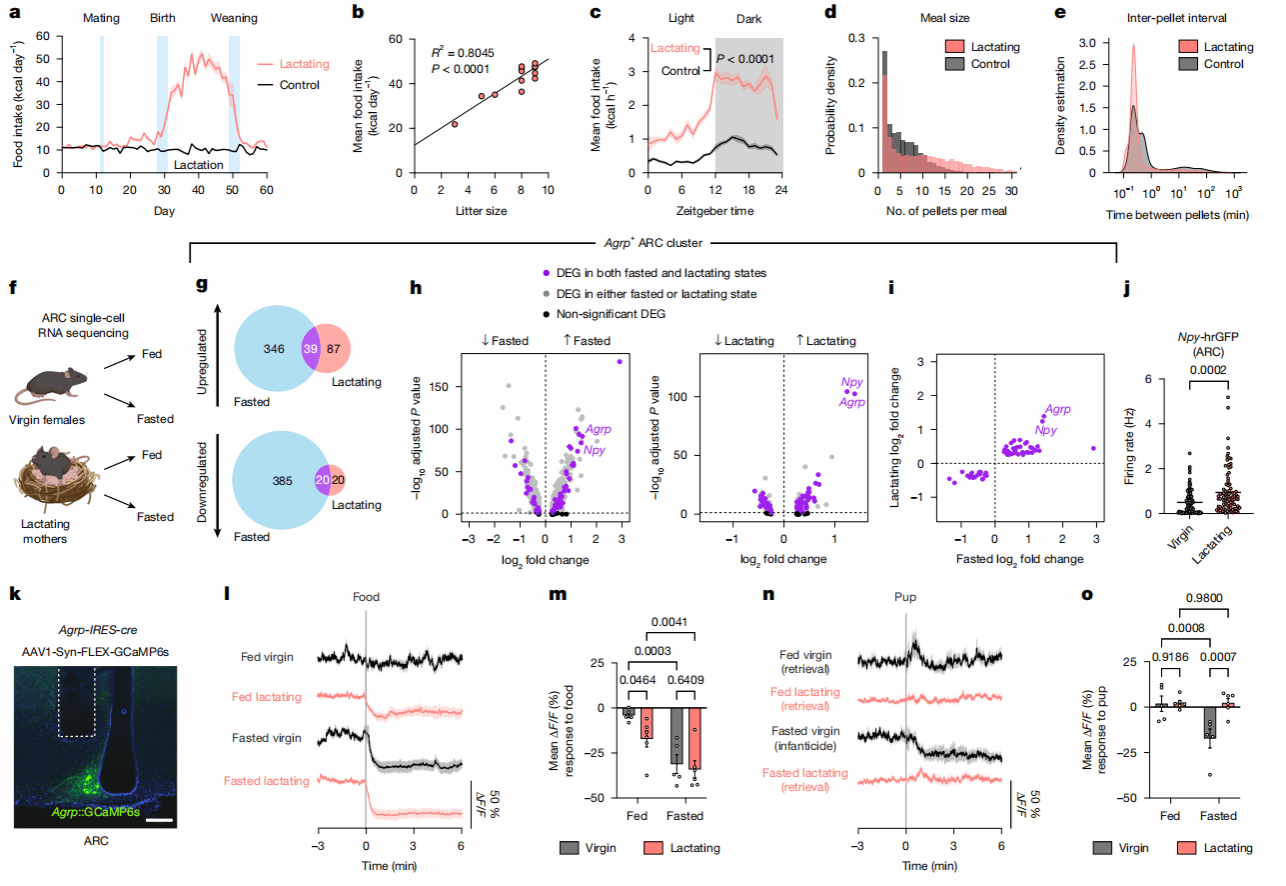
图1 哺乳期小鼠食欲与AgRP神经元活动均增强
2、饥饿状态哺乳期雌鼠而不是未生育雌鼠能够优先进行育儿行为
为了证实饥饿状态对雌鼠育儿行为的影响,作者设计了一个三箱实验:左侧为摄食箱(含第三代摄食实验装置及水源),右侧为育儿箱(含幼崽和筑巢材料),中间为空白箱,并在三种冲突条件下分别对未生育和哺乳期的雌鼠进行了40min的测试(图2a)。在自由进食且幼崽存在的低冲突条件下,未生育和哺乳期的雌鼠在开始进食前,会先开始并完成retrieval行为(图2b-d)。但在禁食过夜且幼崽存在的高冲突条件下,大多数未生育雌鼠优先选择进食,大多数哺乳期雌鼠则优先选择搬运幼崽(图2b,e,f),同时饥饿会导致进食行为延迟了搬运完成的时间(图2j),从而改变了育儿和摄食行为之间的转换概率(图2g)。此外,禁食的哺乳期母鼠在有幼崽的情况下会显著减少的食物摄入量,而禁食的未生育雌鼠则消耗了相似数量的食物(图2h),同时会减少retrieval行为(图2i),表明饥饿会导致未生育雌鼠的母性动机降低。
研究人员还通过视频追踪小鼠活动计算其对摄食箱或育儿箱的偏好。吃饱时,无论是否生育小鼠都偏爱照顾幼崽;饥饿无崽时,则倾向觅食。但当饥饿与育儿需求同时出现,哺乳期雌鼠的偏好指数接近于0(图2l,m),进一步说明了在这种高冲突背景下,哺乳期母鼠在摄食和育儿驱动力之间经历更尖锐的抉择。
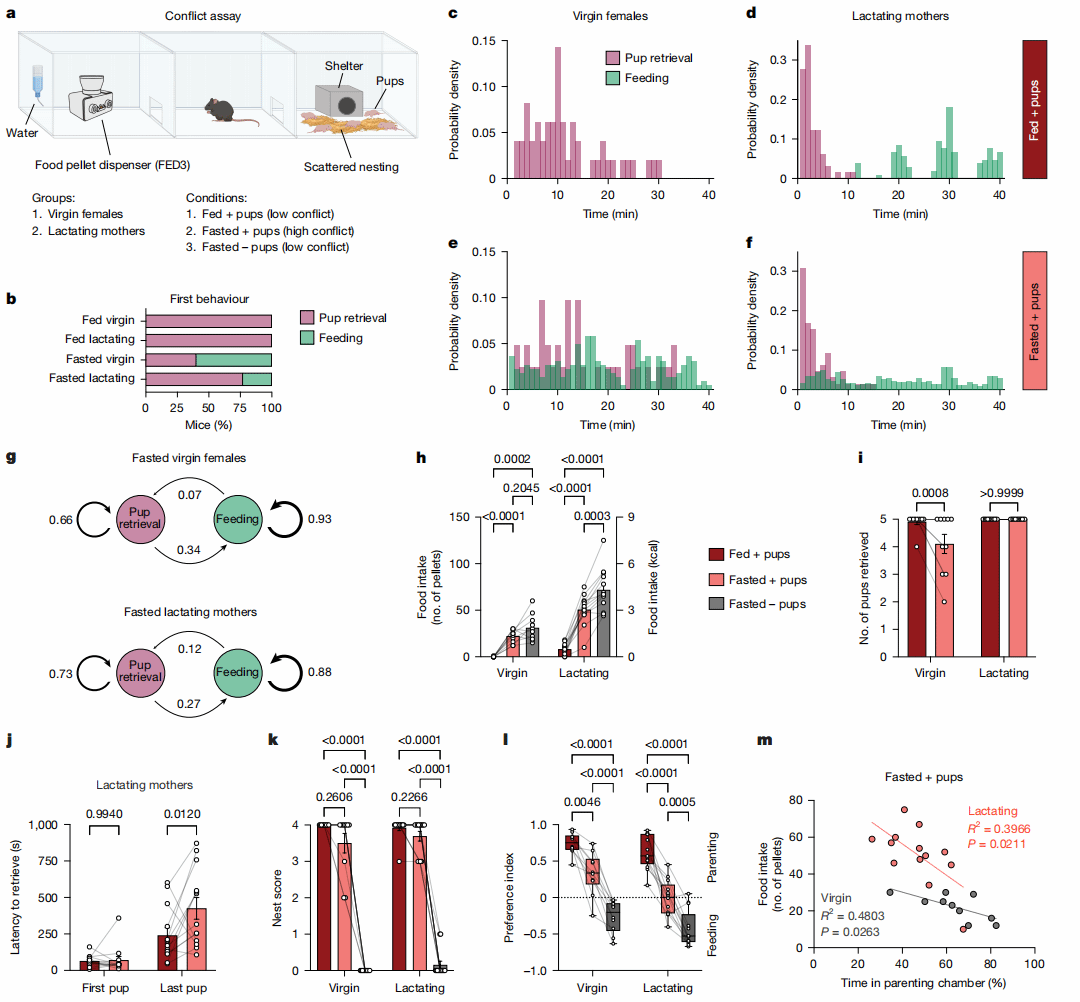
图2 饥饿状态影响育儿行为
3、ARCAgRP→MPOA介导育儿行为向摄食行为的转化
为了探究摄食与育儿行为的选择性神经环路,作者操控了GABA能的ARCAgRP神经元[7],发现它们投射到下丘脑中一个关键的育儿中枢MPOA。那么ARCAgRP→MPOA是否参与了摄食和育儿的优先级转化呢?作者在ARC注射CHR2病毒并在MPOA埋植光纤(图3a),光激活ARCAgRP→MPOA后发现,光刺激比禁食更能引起未生育雌鼠的进食量增加,但没有引起哺乳期雌鼠进食量增加(图3b)。此外,光刺激ARCAgRP→MPOA减少了retrieval行为、筑巢和对育儿室的偏好(图3c-e)。这些结果表明ARCAgRP→MPOA以减少育儿行为为代价增加了雌鼠的摄食。
为了进一步探究ARCAgRP→MPOA环路在摄食和育儿的优先级转化中是否是必要的,作者通过FosTRAP标记了育儿行为中活跃的MPOA神经元[8],利用hM4Di(Gi)在三箱实验中抑制神经元的活动(图3f),结果显示在哺乳期雌鼠中,抑制MPOA育儿相关神经元显著减少了育儿行为并增加了进食,尤其是在饥饿状态下(图3g-r)。也就是说,抑制MPOA中育儿相关神经元重新分配了摄食和育儿行为优先级,从照顾后代转向进食。这一机制解释了饥饿如何影响哺乳期母鼠的行为选择。
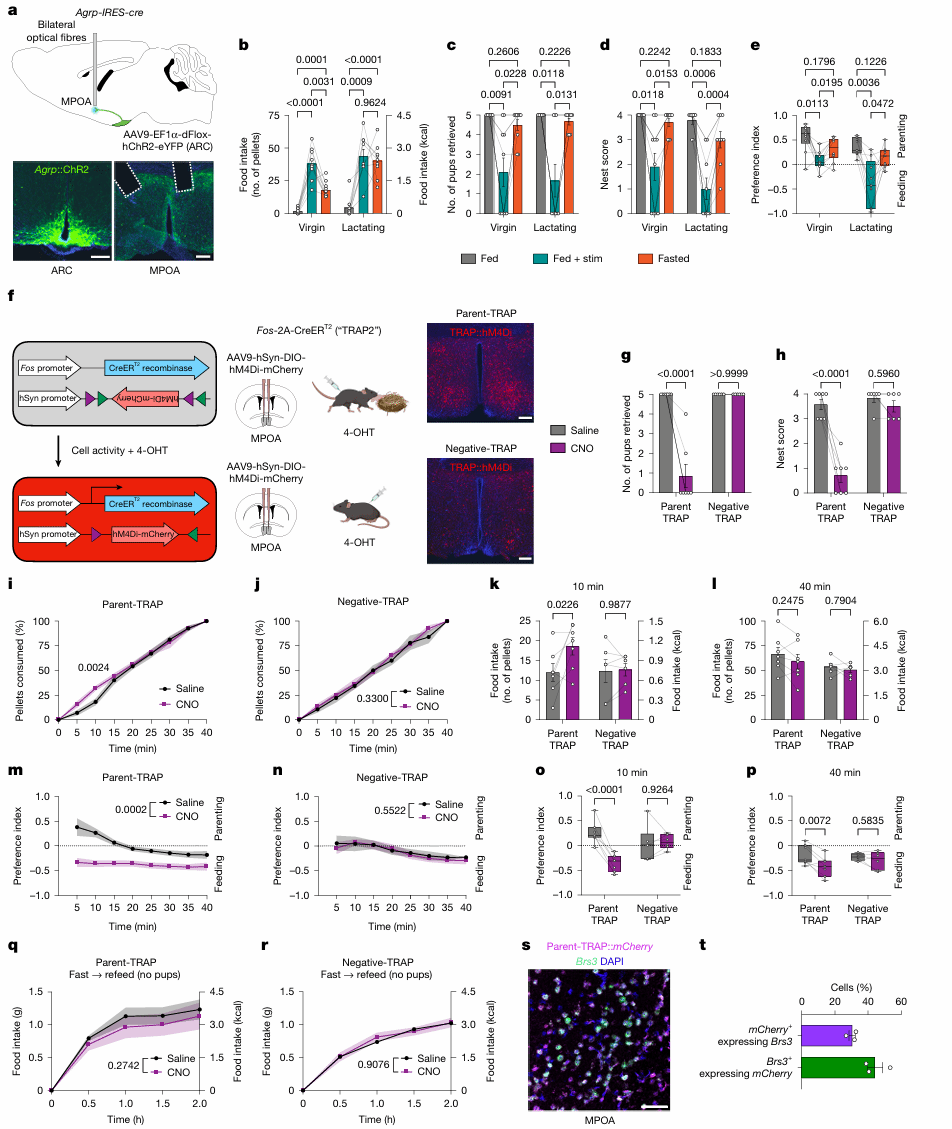
图3 操纵神经环路能够调控育儿与摄食行为的转变
4、MPOA BRS3神经元是调控育儿和摄食的关键节点
接下来,为了确定MPOA中调节育儿和进食的神经元类型,作者通过单细胞测序和RNAscope找到了在哺乳期和饥饿状态下转录组变化最显著且在30%的Parent-TRAP MPOA神经元中表达的Brs3(图3s,t)。通过Brs3-IRES-cre未生育雌鼠和hM4Di病毒靶向抑制MPOA BRS3神经元(图4a),作者发现无论在自由进食还是禁食状态下,未生育雌鼠的育儿行为都显著减少了(图4b,c),而进食量显著增加(图4e,f)。使用同样的方法,作者利用hM3Dq(Gq)激活了MPOA BRS3神经元(图4g),发现在禁食状态下,未生育雌鼠的retrieval行为速度更快(图4h–j),但食物的摄入量没有显著改变(图4K)。此外,在通常会攻击幼崽的未交配雄性中,MPOA BRS3神经元的化学激活完全消除了杀婴行为,并导致其中一半的雄性取回幼崽(图4l)。
为了揭示MPOA BRS3神经元活性在育儿行为中的变化,作者对未生育雌性MPOA BRS3神经元进行了光纤记录(图4m),发现在幼崽出现时,神经元活性急剧增加(图4n,o)。当幼崽和食物同时出现时(图4u),MPOA BRS3神经元活性的增强主要与育儿行为相吻合,而不是和食物相关 (嗅闻和进食)(图4v,w)。作者还观察到在食物出现时MPOA BRS3神经元钙信号的短暂增加,禁食条件下更加明显(图4s,t),表明MPOABRS3神经元可能编码预期饱腹感信号。
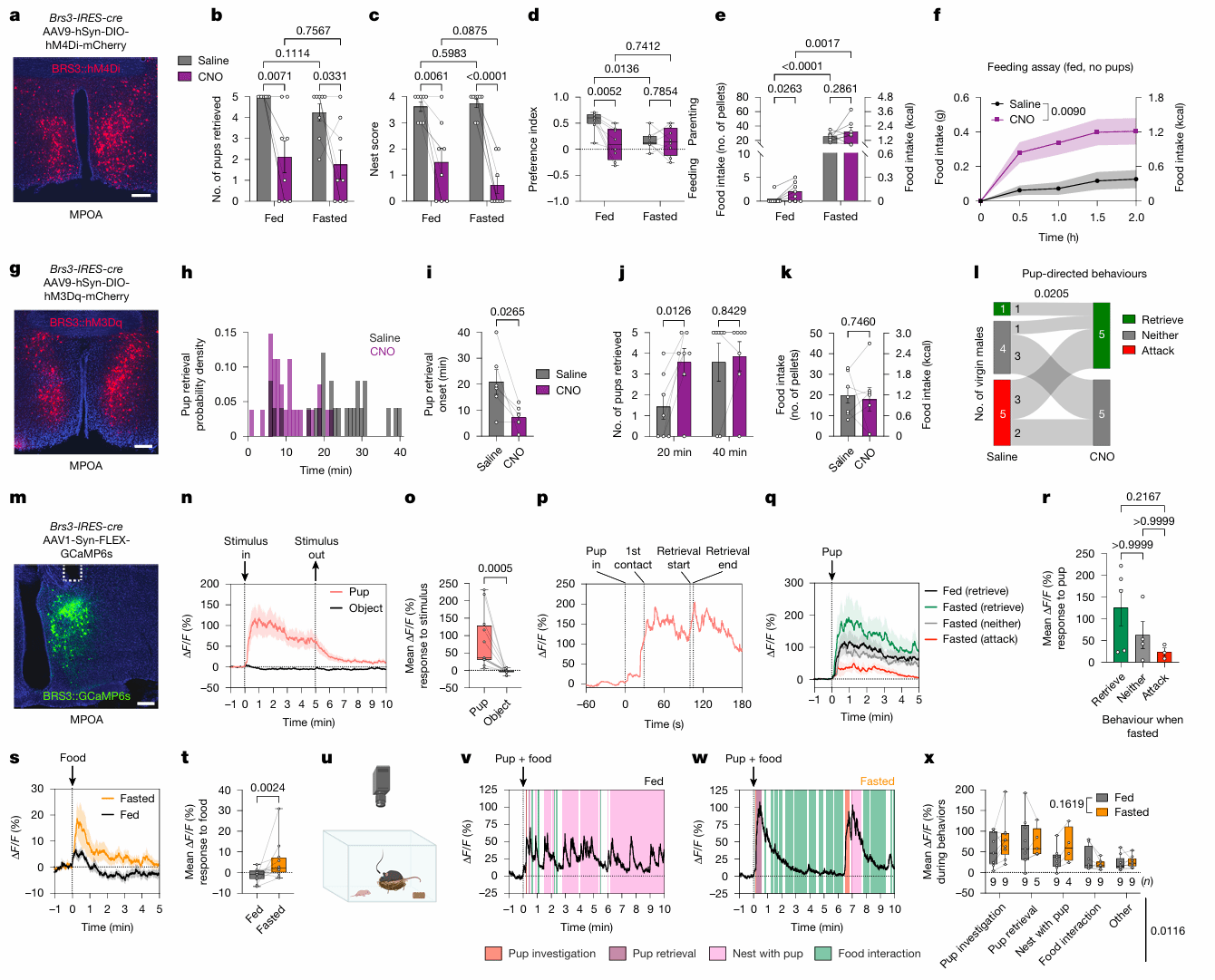
图4 MPOA BRS3神经元调控育儿与摄食行为
5、ARCAgRP神经元直接抑制MPOABRS3神经元
之前的研究已经发现,禁食的小鼠检测到食物时,ARCAgRP神经元会迅速被抑制(图11,m),因此在饥饿状态下MPOA BRS3神经元对食物的活性增强反应可能是由于ARCAgRP神经元的去抑制作用导致的。为了验证这一假设,作者在ARC NPY神经元中表达hM3Dq并在MPOA BRS3神经元中表达GCaMP6s(图5a),通过光纤记录发现激活ARC NPY神经元能降低MPOA BRS3神经元的基础活性(图5c,d)及其对幼崽的响应(图5e,f)。
免疫荧光染色显示了ARCAgRP轴突末梢与MPOA BRS3神经元之间的连接(图5g),但为了测试ARCAgRP神经元是否直接抑制MPOA BRS3神经元,作者用GCaMP6s标记MPOA BRS3神经元,并在ARCAgRP神经元中表达ChR2-mCherry(图5h),通过光遗传学与电生理联用直接证明了ARCAgRP神经元释放GABA并以单突触方式抑制MPOA BRS3神经元,这可能是饥饿将动物的动机从照顾幼儿转向觅食的机制。
6、MPOA BRS3神经元的产后可塑性变化及下游投射
接下来,研究聚焦于MPOA BRS3神经元在产后是否经历可塑性变化。结果发现,哺乳期母鼠的MPOA BRS3神经元放电频率增加(图5l,m),但其数量或内在特性并未改变(图5n)。同时为了探索MPOA BRS3神经元如何在整个大脑中发挥功能,作者使用synaptophysin–mCherry对其进行标记并追踪这些神经元的轴突末端(图5p),发现MPOA BRS3神经元影响的脑区包括PMV、LH、PVH、CeA等,这种多区域的投射模式说明MPOA BRS3神经元通过复杂而广泛的神经环路来协调育幼与进食行为之间的平衡。
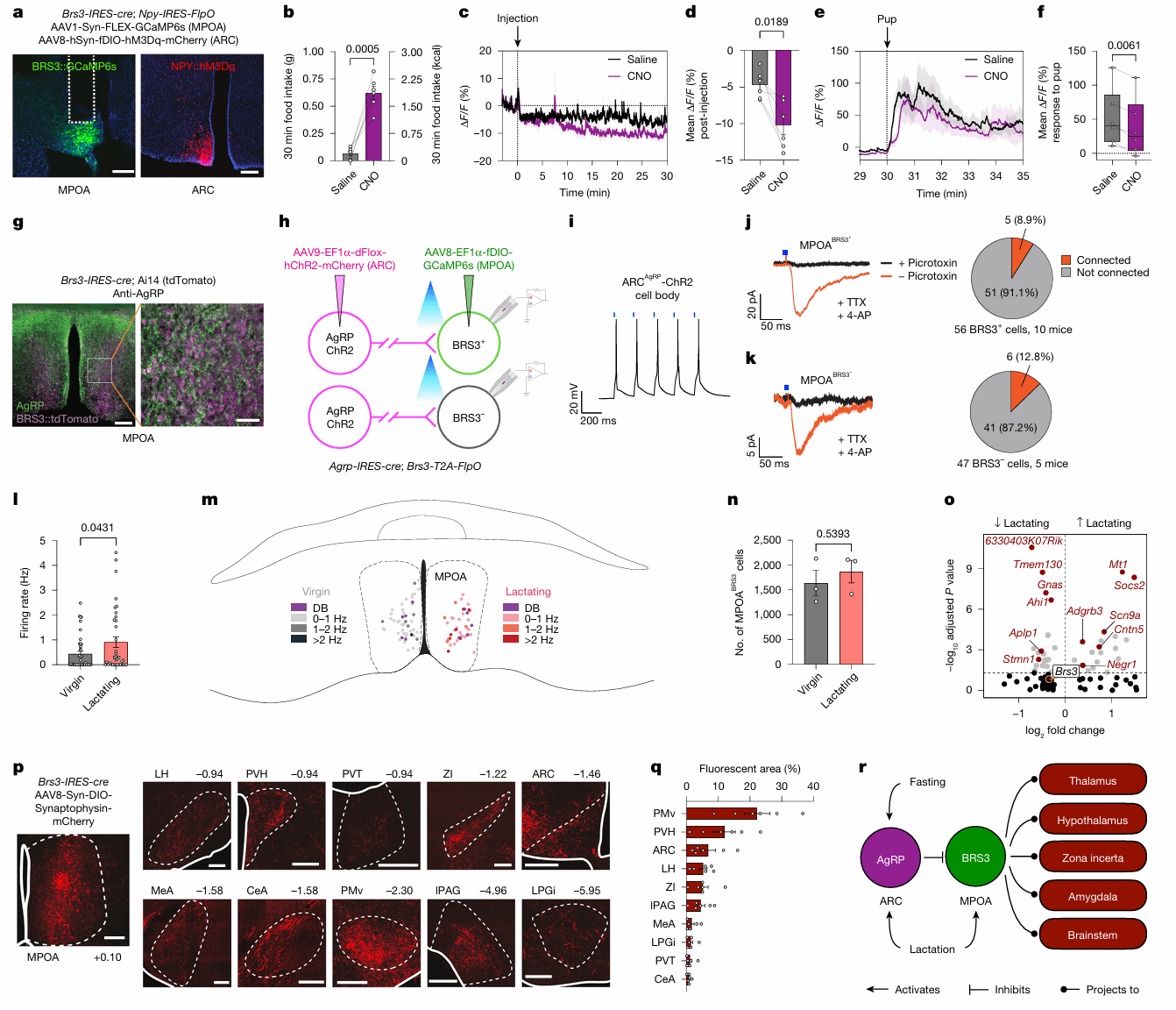
图5 MPOA BRS3神经元的调控与下游投射脑区
总体而言,本研究系统刻画了ARC与MPOA神经元在饥饿及哺乳两种生理状态下的功能特征;作者设计了一种符合动物行为学情境的行为范式,用于探究摄食与育儿动机的相互作用,并阐明雌性小鼠如何在机体营养需求与抚育后代的社交驱动之间取得平衡。研究进一步锁定了一条下丘脑内部神经环路,饥饿时ARCAgRP神经元抑制MPOA BRS3神经元,使行为偏向进食;哺乳时MPOA BRS3神经元活性增强,维持育儿行为的优先级。ARCAgRP→MPOA BRS3环路通过动态平衡两种拮抗需求,为理解机体如何依据动态生理状态来调控动机提供了新的见解。
参考文献
[1] ALCANTARA I C, LI C, GAO C, et al. A hypothalamic circuit that modulates feeding and parenting behaviours [J]. Nature, 2025.
[2] WOODSIDE B, BUDIN R, WELLMAN M K, et al. Many mouths to feed: the control of food intake during lactation [J]. Front Neuroendocrinol, 2012, 33(3): 301-14.
[3] AMMARI R, MONACA F, CAO M, et al. Hormone-mediated neural remodeling orchestrates parenting onset during pregnancy [J]. Science, 2023, 382(6666): 76-81.
[4] MARLIN B J, MITRE M, D'AMOUR J A, et al. Oxytocin enables maternal behaviour by balancing cortical inhibition [J]. Nature, 2015, 520(7548): 499-504.
[5] STOLZENBERG D S, CHAMPAGNE F A. Hormonal and non-hormonal bases of maternal behavior: The role of experience and epigenetic mechanisms [J]. Horm Behav, 2016, 77: 204-10.
[6] MATIKAINEN-ANKNEY B A, EARNEST T, ALI M, et al. An open-source device for measuring food intake and operant behavior in rodent home-cages [J]. Elife, 2021, 10.
[7] LI X Y, HAN Y, ZHANG W, et al. AGRP Neurons Project to the Medial Preoptic Area and Modulate Maternal Nest-Building [J]. J Neurosci, 2019, 39(3): 456-71.
[8] GUENTHNER C J, MIYAMICHI K, YANG H H, et al. Permanent genetic access to transiently active neurons via TRAP: targeted recombination in active populations [J]. Neuron, 2013, 78(5): 773-84.
本文作者:马通组陈明芳