Background
面对环境威胁时,生物体必须迅速动员能量储备,来支持防御行为(如战斗或逃跑),同时抑制可能与防御策略竞争的行为(如进食和觅食)。迅速升高的血糖不仅为防御行为提供燃料,还能增强心功能、提升警觉和记忆[1-4]。这些由压力引起的代谢适应性反应在进化上高度保守且至关重要,但在现代社会中,慢性压力成为生活中常见的问题。大量研究已经证实,长期压力应激会诱发代谢异常,包括肥胖和2型糖尿病(T2D)[5-6]。临床上,神经心理障碍和代谢疾病也时常伴随发生[7]并且存在共病机制。但“压力”这种看不见摸不着的东西,是如何在极短时间内增加血糖,又是怎么一步步扰乱代谢的?
之前的研究大多关注在下丘脑、脑干这些控制饥饿、消化的“基础生理中枢”,或影响摄食偏好的“奖赏中枢”[8-9],但近日美国西奈山Icahn医学院S. A. Stanley团队在《Nature》发表的研究突破性地发现:MeA(内侧杏仁核)这个传统上与“害怕、紧张”等情绪挂钩的脑区,竟然是调节血糖的“新玩家”。急性应激激活的MeA→VMH神经环路,不依赖HPA轴和肾上腺髓质系统这些经典通路,直接通过神经环路控制肝脏糖代谢。反复应激会扰乱MeA-VMH-肝脏活动,从而驱动应激相关的代谢异常。

1、应激激活MeA神经元以调节葡萄糖水平
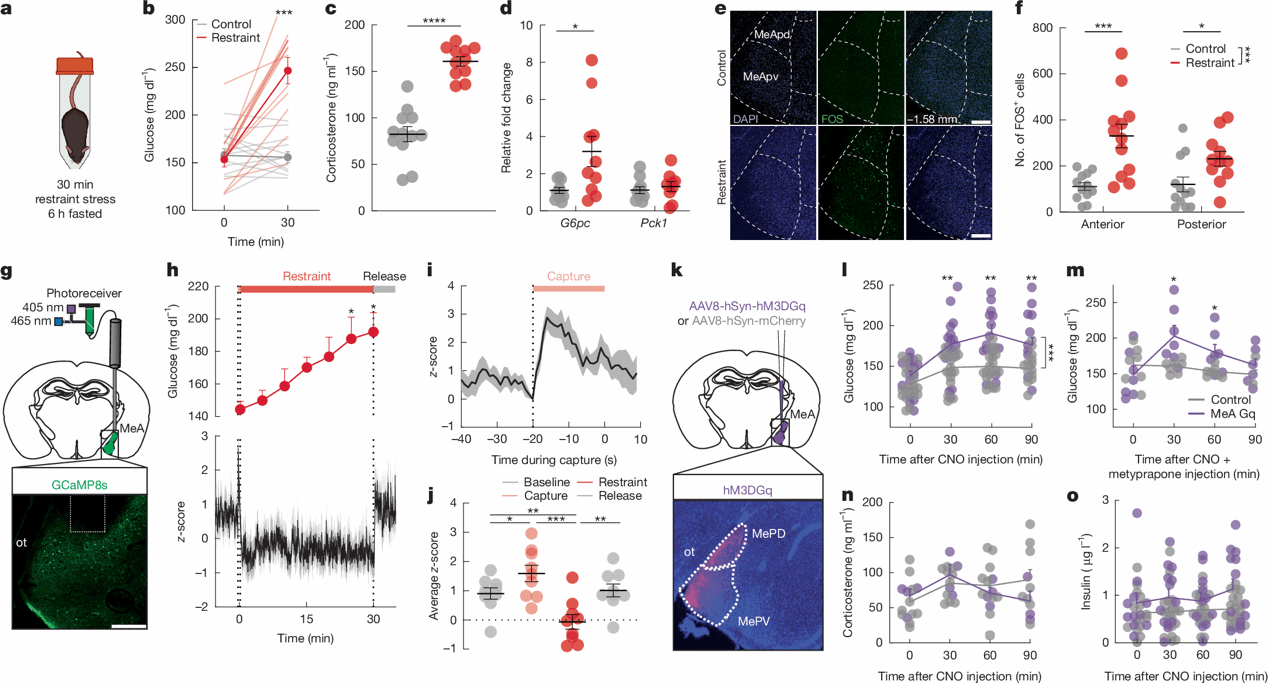
Fig. 1 | Stress activation of MeA neurons to regulate glucose.
为了研究应激相关代谢适应的机制,研究者首先在小鼠中确认了多种急性应激源引起血糖升高和食欲抑制的效应。结果显示,急性束缚应激引起血糖迅速升高,糖耐量受损,血浆皮质酮升高(HPA轴激活),肾上腺素、胰高血糖素和甘油水平也增加(肾上腺髓质系统激活)(图1a-c),但胰岛素和去甲肾上腺素水平没有受到影响。束缚应激也能上调肝脏葡萄糖-6-磷酸酶(G6pc)的表达(图1d),提示应激诱导肝脏糖生成能力增强。
众所周知,社会性刺激能够调控MeA神经元的活动,且与威胁相关的外部刺激和内部感觉信号均汇聚于MeA[10-11]。MeA神经元向调控内分泌、自主神经及代谢过程的应激相关脑区发出投射,包括下丘脑诸核团以及BNST。因此,MeA可能参与对急性应激的代谢适应。与对照相比,束缚应激显著增加了MeA整体的cFos+细胞的数量(图1e-f)。基于光纤钙成像技术,作者发现MeA神经元活动在“捕捉阶段”迅速增加——即操作者伸手抓取小鼠置入束缚管前(图1g–j)。类似地,“社交应激”(陌生雄鼠的气味)、物理应激(足底电击)和视觉压力(被仿真虫追逐)均能显著增强MeA活动并提高血糖水平。这些数据提示,当小鼠试图逃离威胁性刺激时,其MeA的神经活动被迅速动员,该过程与能量储备的快速调动相偶联,从而支撑此类适应性行为。
接下来,作者通过化学遗传学激活小鼠MeA神经元(hM3DGq-mCherry+CNO),显著提高了小鼠的血糖水平,而皮质酮没有差异。即使皮下注射皮质酮合成抑制剂美替拉酮(注射剂量足以抑制由束缚应激诱导的血糖升高)的情况下,激活MeA也能显著提高血糖(图1k-m)。这表明,MeA神经元促使血糖水平升高,并未通过HPA轴和肾上腺髓质系统调动相关的糖调节激素。此外,激活MeA对恐惧或焦虑相关行为(高架十字迷宫、旷场)没有影响,表明MeA的激活对血糖的调控作用,不依赖于情绪反应。
这些数据表明,MEA神经元被急性应激源激活,以推动新陈代谢对应激的适应。
2、急性束缚应激会激活MeA→VMH神经元,但不激活MeA→BNST神经元
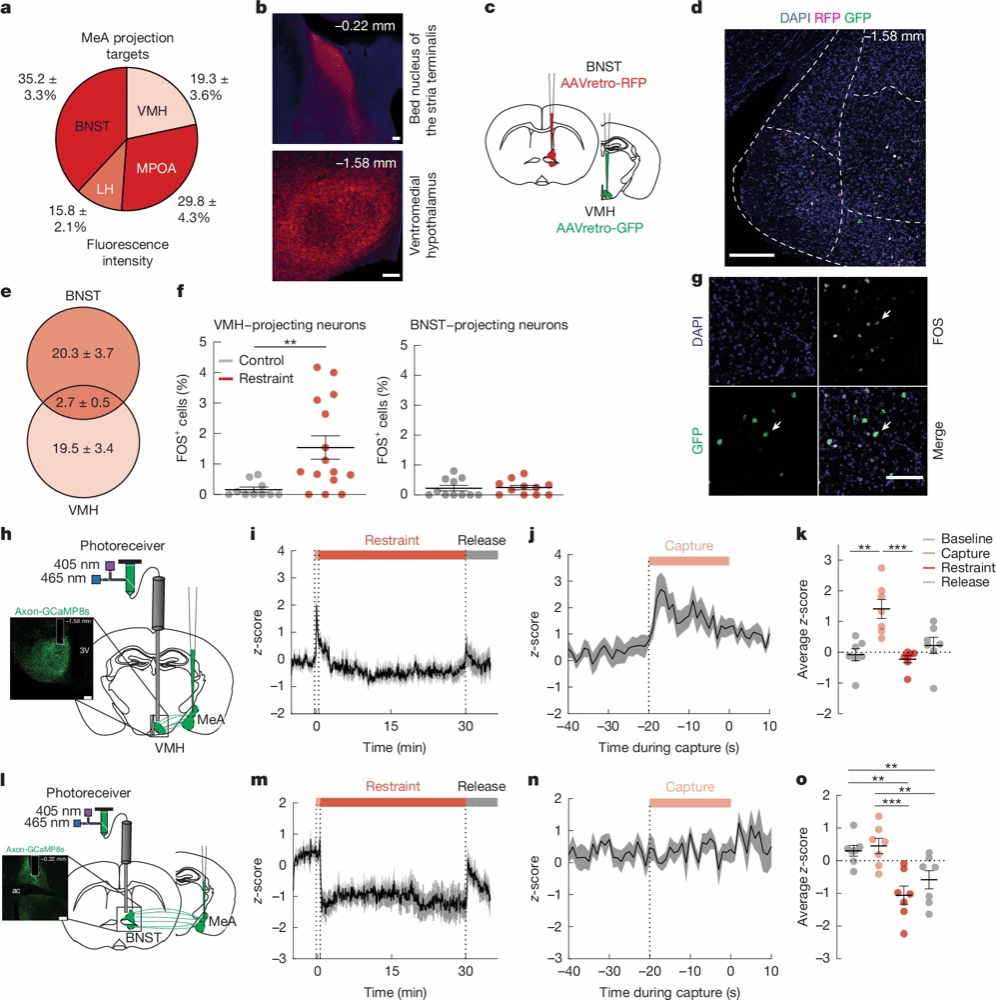
Fig. 2 | Acute restraint stress activates MeA→VMH neurons but not MeA→BNST neurons.
接下来,作者研究了MeA调控血糖的神经环路机制。病毒示踪(synaptophysin-mcherry)显示,MeA的轴突密集投射至多个调控代谢的下丘脑区域(MPA、LH和VMH)以及BNST(图2a-b)。由于涉及VMH和BNST的环路参与葡萄糖调节,并被应激刺激激活[12-13],为探究投射至VMH或BNST的神经元是否参与代谢调节,作者先进行了逆行标记(BNST:AAVretro-RFP、VMH:AAVretro-GFP),发现这两群神经元基本不重叠(图2c-e)。通过cFos结合AAVretro示踪,作者发现束缚应激使cFos+ MeAVMH神经元的数量增加约两倍,而不增加cFos+ MeABNST神经元的数量(图2f-g),这表明束缚应激优先增加MeAVMH的活动。进一步通过活体钙成像实验(MeA:Axon-GCaMP8s)证实,在束缚应激前的“捕捉阶段”,MeAVMH的活动显著增加,而MeABNST活性在束缚应激下并没有显著增加(图2h-o)。MeAVMH的激活早于血糖上升,提示其可能是应激代谢反应的启动者。
综上,MeA中存在功能分离的神经通路:MeAVMH神经元特异性响应多种应激,率先激活并驱动血糖升高,是应激性代谢反应的关键。
3、MeA-VMH环路的不同神经元亚型
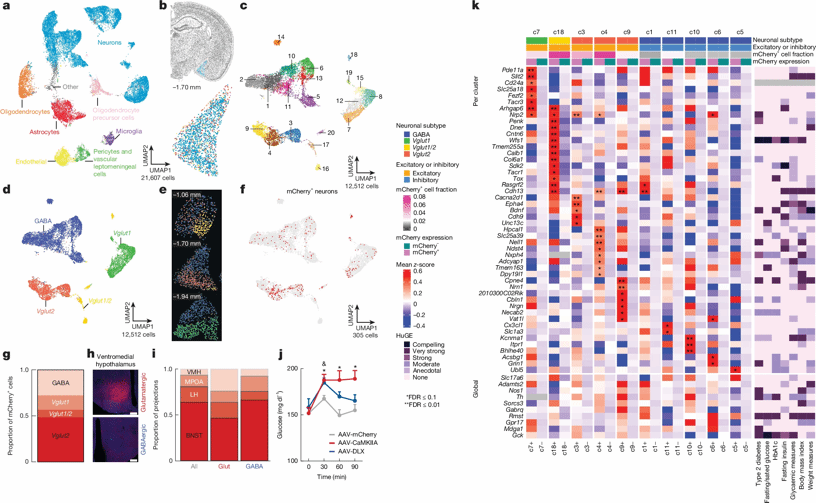
Fig. 3 | Gene expression in VMH-projecting MeA neurons.
随后,作者利用空间转录组学和神经元特异性标记技术对MeAVMH神经元类型进行细化。首先,基于空间转录组数据的UMAP降维分析揭示了MeA神经元的聚类结构与细胞类型组成,并进一步解析了GABA能,以及谷氨酸能神经元(包括Vglut1+、Vglut2+以及Vglut1/2+亚群)在MeA内的分子特征分布及其空间异质性表达模式:GABA能神经元主要分布在MeA背侧,兴奋性神经元群集中在腹侧;Vglut2主要表达于前部,Vglut1主要表达于后部(图3a-e)。接下来,作者在小鼠VMH中注射AAVretro-hSyn-mCherry,荧光标记MeAVMH神经元。再将Xenium空间转录组数据与retro标记的mCherry阳性神经元的荧光图像进行了配准:mCherry+神经元中,谷氨酸能神经元占74%(图3f-g)。Vglut2-cre和Vgat-cre小鼠的顺行示踪实验(MeA:DIO-Synaptophysin-mCherry),在VMH检测到更高的谷氨酸能的突触前末梢标记物,证实了其作为主要输出通路的角色(图3h-i)。相应地,化学遗传学激活MeA谷氨酸能神经元(AAV-CamK2a-hM3DGq-mCherry)和GABA能神经元(AAV-hDlx-GqDREADD-dTomato-Fishell-4),观察到小鼠血糖水平不同程度的变化(图3j),证明了这两类神经元在血糖调节中的差异性贡献。值得注意的是,mCherry+ MeAVMH神经元在多个基因转录本中呈现富集现象,这些基因与血糖调控、2型糖尿病和体重等代谢过程存在关联(图3k),为理解MeA-VMH通路在代谢调控中的分子机制提供了新见解。
这些结果表明MeA→VMH环路由谷氨酸能与GABA能神经元混合组成,且兴奋性与抑制性环路的共同激活参与了血糖水平的升高过程。
4、MeAVMH神经元参与血糖水平的调控
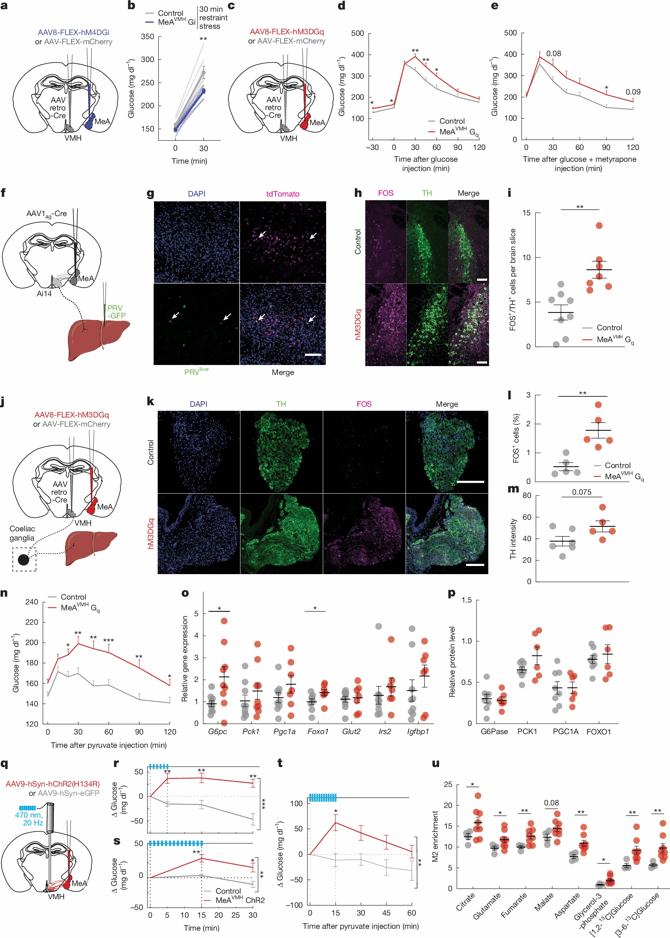
Fig. 4 | MeA neurons projecting to VMH regulate blood glucose
作者随后操纵MeA→VMH神经环路,探究其是否会改变急性应激下的代谢反应。化学遗传学沉默MeAVMH神经元后(VMH:AAVretro-Cre、MeA:DIO-hSyn-hM4DGi):束缚应激引发的高血糖反应显著减弱(图4a-b),而应激诱导的皮质酮、肾上腺素的升高并未改变。化学遗传学激活MeAVMH使血糖水平升高、以及在葡萄糖耐量试验中血糖持续升高(图4c-d),但不会改变胰岛素敏感性。此外,在皮质酮合成抑制剂美替拉酮存在的情况下,激活MeAVMH仍能提高GTT期间的血糖水平(图4e),说明MeAVMH通过独立于肾上腺与胰岛素的未知机制,参与应激诱导的血糖稳态调控。
既往研究认为肝脏功能受到中枢的调控[14],因此作者推测:MeA能够直接刺激肝脏葡萄糖生成来提升血糖水平,这种机制使得MeA神经元能够在应激事件中快速升高血糖。为验证这一猜想,作者在Ai14小鼠的MeA注射顺行跨突触AAV1ag-Cre,同时在肝脏注射逆行跨多突触的伪狂犬病毒PRV-GFP,在VMH中检测到同时表达tdTomato与GFP的双阳细胞(图4f-g),表明MeAVMH神经元通过多突触连接网络与肝脏进行通讯。激活MeAVMH增强蓝斑去甲肾上腺素能神经元,及腹腔神经节酪氨酸羟化酶(TH)阳性交感神经元的活动(图4h-l)(分别是交感传出通路的中枢与外周枢纽),进而促进肝糖输出:表现为丙酮酸耐量试验①中血糖升高幅度更大、肝脏糖异生基因(Foxo1、G6pc)表达上调(图4n-o)。利用稳定同位素标记技术证实,[2,3-13C]丙酮酸更多转化为糖异生中间体(M2富集),说明这些葡萄糖不是来自储存的糖原,而是通过糖异生新合成的。
这些数据共同表明,从MeA到VMH再到肝脏的交感神经通路,能够快速调节肝糖异生,是应激性高血糖的核心机制。
①丙酮酸耐量试验:交感神经通过调节葡萄糖的从头合成(糖异生)与糖原分解过程来调控肝葡萄糖产量,糖异生依赖于丙酮酸向草酰乙酸的转化。因此,通过监测丙酮酸给药后血糖水平的升高即可评估糖异生过程。
5、慢性应激使得MeA→VMH神经元激活钝化,最终导致体重增加和高血糖
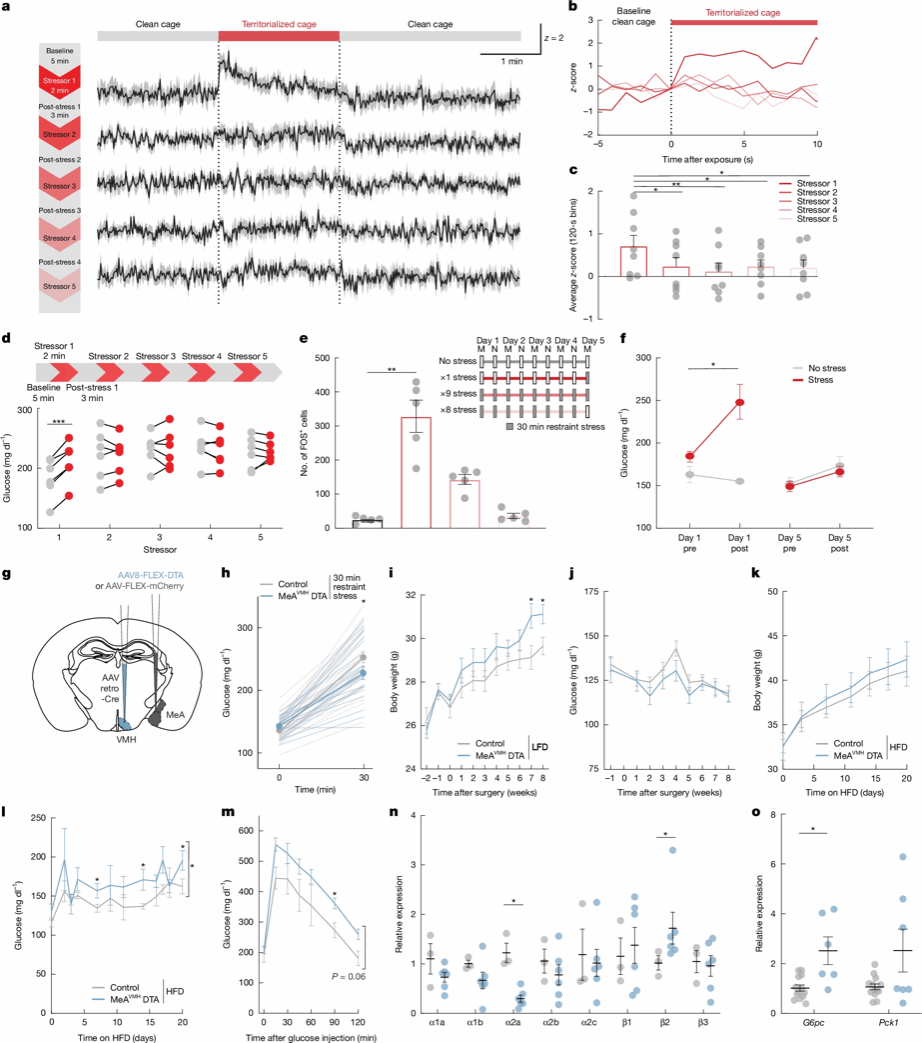
Fig. 5 | Blunted MeA→VMH neuron activation with chronic stress promotes weight gain and hyperglycaemia.
由于长期压力应激会诱发代谢异常,作者最后探究了重复应激是否会改变MeA对血糖的调控功能。重复社交和束缚应激②都会导致MeAVMH神经元活性衰减,伴随高血糖反应的减弱(图5a-d,e-f),表明MeAVMH在初次应激暴露后会对后续应激产生持续性的应答钝化。特异性损毁MeAVMH神经元(白喉毒素DTA)的小鼠对束缚和社交应激的高血糖反应显著减弱(图5g-h)。在高脂饮食下,血糖更高,糖耐量受损,血糖受体异常(α2A肾上腺素能受体表达下调、β2肾上腺素受体上调③),这些都是T2D的典型特征。同时,肝脏中糖异生基因G6pc表达也显著升高(图5l-o)。即使摄入标准饲料,DTA损毁小鼠的体重也较对照组增加,且未伴随摄食量或糖调节激素水平的改变(图5i-j),提示反复应激导致的MeAVMH环路失调可能是压力相关代谢疾病的诱因。
②反复社交应激:小鼠在洁净笼中适应后(5分钟baseline),被暴露于带有雄鼠气味的笼中2分钟,随后放回熟悉的洁净笼3分钟。单次测试中,重复5次此循环。每次应激使用不同的领地笼以防止对应激源产生适应。反复束缚应激:每日2次束缚应激,每次30min,重复5日。
③肝脏的交感神经支配通过α2A肾上腺素能受体抑制胰高血糖素诱导的cAMP生成及葡萄糖输出,并在肥胖小鼠中改善葡萄糖耐量。β2肾上腺素能信号则促进肝脏葡萄糖输出。
Summary
这项研究揭示了一条MeA-VMH-肝脏信号轴,在调控应激压力引发的高血糖反应中起关键作用,突破性地证明了神经系统可不依赖经典内分泌直接调控肝脏功能。压力来临时,这条环路“命令”肝脏紧急合成葡萄糖,为身体应对威胁提供能量,这是进化下的生存本能,但反复压力暴露会导致MeAVMH神经元功能异常,引起血糖持续升高和代谢功能紊乱。这些发现有助于临床更好地理解心理压力与糖尿病共病机制,为血糖控制、以及治疗压力相关代谢疾病提供了新思路。研究也提醒我们:心理健康与身体代谢密切相关,压力会通过真实的神经信号扰乱血糖,管理压力不只是为了心情舒畅,更是在保护自己的代谢健康。
《Amygdala–liver signalling orchestrates glycaemic responses to stress》
原文链接:https://www.nature.com/articles/s41586-025-09420-1
参考文献:
[1] Krishnan V , Han M H , Graham D L ,et al.Molecular adaptations underlying susceptibility and resistance to social defeat in brain reward regions.[J].Cell, 2007, 131(2):391-404.
[2] Lang C H , Dobrescu C .Sepsis-induced increases in glucose uptake by macrophage-rich tissues persist during hypoglycemia.[J].Metabolism-clinical & Experimental, 1991, 40(6):585-593.
[3] Van d Z N L , Ondine V D R , Kessels R P C ,et al.Short-term effects of glucose and sucrose on cognitive performance and mood in elderly people[J].Journal of Clinical & Experimental Neuropsychology, 2014, 36(5):517-527.
[4] Finfer S , Liu B , Chittock D R ,et al.Hypoglycemia and risk of death in critically ill patients.[J].New England Journal of Medicine,2012,367(12):1108.
[5] Frick J , Foright R M , Levasseur B ,et al.High Fat/High Sucrose Diet Consumption Worsens Comorbid Metabolic Outcomes In An Early Life Stress Model Of Urologic Chronic Pelvic Pain In Mice[J].The Journal of Pain, 2023, 24(4-Sup):1.
[6] Sanghez V , Razzoli M , Carobbio S ,et al.Psychosocial stress induces hyperphagia and exacerbates diet-induced insulin resistance and the manifestations of the Metabolic Syndrome[J].Psychoneuroendocrinology, 2013, 38(12):2933-2942.
[7] Saltiel A R , Olefsky J M .Inflammatory mechanisms linking obesity and metabolic disease[J].Journal of Clinical Investigation, 2017, 127(1):1-4.
[8] Ip C K , Rezitis J ,Qi, YueBajaj, NikitaKoller, JuliaFarzi, AitakShi, Yan-ChuanTasan, RamonZhang, LeiHerzog, Herbert.Critical role of lateral habenula circuits in the control of stress-induced palatable food consumption[M]. 2023.
[9] Gibson E L .The psychobiology of comfort eating: implications for neuropharmacological interventions.[J].Behavioural Pharmacology, 2012, 23(5-6):442-460.
[10] Weathington JM, Strahan JA, Cooke BM. Social experience induces sex-specific fos expression in the amygdala of the juvenile rat. Horm Behav. 2012 Jul;62(2):154-61.
[11]Bernardita Cádiz-Moretti,Marcos Otero-García,Fernando Martínez-García,et al.Afferent projections to the different medial amygdala subdivisions: a retrograde tracing study in the mouse[J].Brain Structure and Function, 2016, 221(2):1033-1065.
[12] Stanley S A , Kelly L , Latcha K N ,et al.Bidirectional electromagnetic control of the hypothalamus regulates feeding and metabolism[J].Nature, 2016, 531(7596):647-650.
[13] Shao J , Gao D , Liu Y ,et al.Cav3.1-driven bursting firing in ventromedial hypothalamic neurons exerts dual control of anxiety-like behavior and energy expenditure[J].Molecular Psychiatry, 2022, 27:2901 - 2913.
[14] Liu, L , Huang, Z , Zhang, J. et al. Hypothalamus-sympathetic-liver axis mediates the early phase of stress-induced hyperglycemia in the male mice[J]. Nat Commun, 2024, 15, 8632.
本文作者:段树民组严欣璐