长期处于焦虑、压力状态下,会不会让癌症进展更快?这一猜想终于有了明确的神经机制支撑。大量流行病学证据表明,抑郁、焦虑等心理因素与癌症发病率升高、癌症特异性死亡率增加密切相关。越来越多的证据表明,大脑通过多种神经内分泌和神经通路调节肿瘤的发生和发展,例如下丘脑-垂体-肾上腺(HPA)轴、自主神经系统和免疫反应;然而,大脑直接调节外周肿瘤进展的确切机制在很大程度上仍不明确。
2025年7月15日,中山大学李建明团队与南方医科大学高天明团队合作在《Nature Cancer》发表题为“Colorectal cancer cells hijack a brain–gut polysynaptic circuit from the lateral septum to enteric neurons to sustain tumor growth”的研究,首次揭示:结直肠癌细胞会劫持一条从大脑外侧隔核(LS)到肠道神经元的多突触环路,而慢性束缚应激(CRS)会激活这条环路,促使肠胆碱能神经元释放GABA,进而激活肿瘤细胞上含ε亚基的GABA_A受体并上调Tspan1表达以促进肿瘤生长。这一发现为“脑-癌交互调控”提供了全新的神经环路解释,也为结直肠癌的精准干预开辟了“靶向神经环路”的新方向。
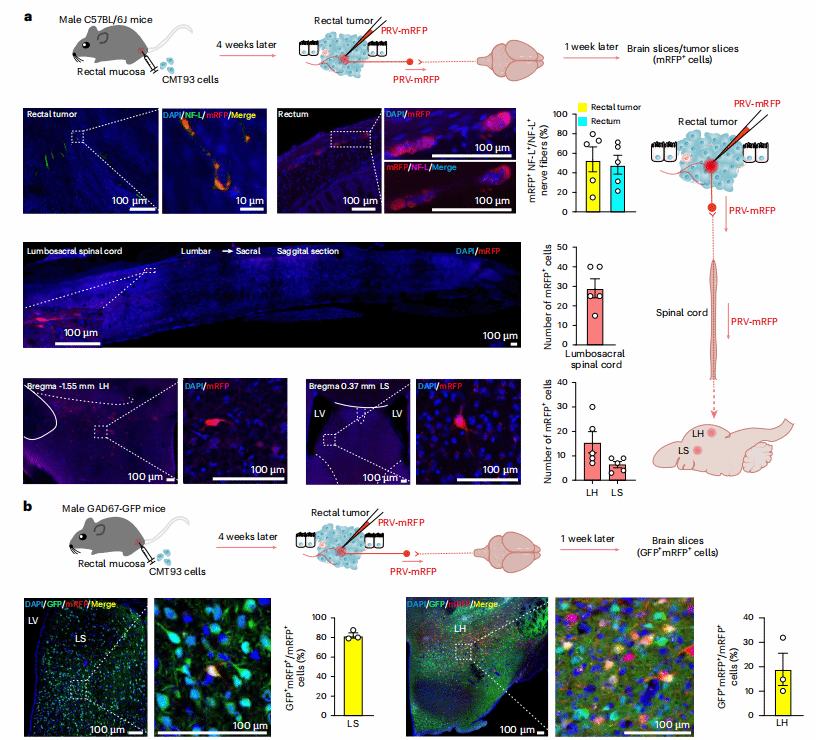
01 逆行示踪技术揭示外侧隔核与结直肠癌生长的关联
研究团队首先从临床现象切入:在结直肠癌患者的肿瘤组织发现,肿瘤微环境(TME)中神经丝轻链蛋白(NF-L)标记的神经纤维数量与患者生存期呈显著负相关。为验证神经纤维与肿瘤生长的关联,团队构建了不同的结直肠癌小鼠模型:直肠原位移植模型和坐骨神经移植模型,同样观察到肿瘤内NF-L+神经纤维浸润。现有研究表明,神经生长因子(NGF)会促进神经在肿瘤内得生长。进一步研究发现,结直肠癌细胞会分泌NGF,其受体TrkA抑制剂GW441756可减少肿瘤神经浸润并抑制肿瘤生长。这些结果提示:肿瘤会主动“招募”神经纤维,而神经纤维的浸润是结直肠癌进展的关键推手。
既然肿瘤与神经纤维密切相关,那么这些神经纤维的“大脑源头”在哪里?研究团队采用伪狂犬病毒(PRV)逆行追踪技术——将表达红色荧光蛋白(mRFP)的PRV注射到小鼠直肠肿瘤内,病毒会沿神经纤维逆向传递,标记整条神经环路的神经元。1周后,荧光信号不仅出现在肿瘤内得神经纤维,直肠和脊髓中得胆碱能神经元,还在大脑的外侧隔核(LS)和下丘脑外侧区(LH)检测到大量mRFP+神经元。进一步用绿色荧光蛋白(GFP)标记LS内的GABA能神经元发现,mRFP+神经元多GFP+共定位,说明LS内的GABA能神经元是调控肠道肿瘤的关键大脑中枢。
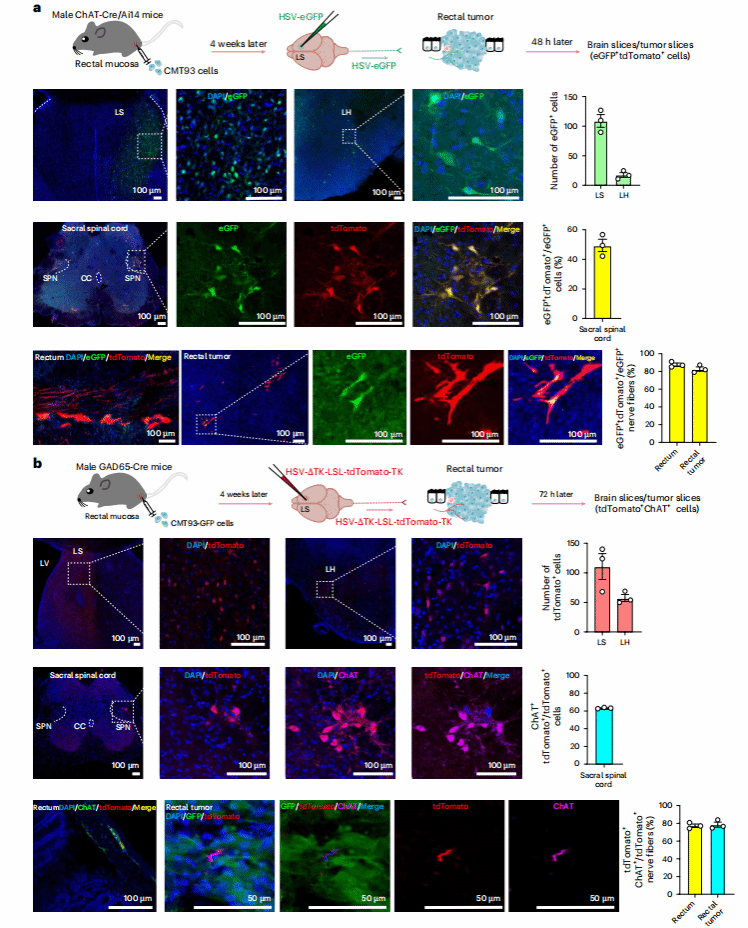
02 LSGABA能神经元通过多突触调控肿瘤支配的肠胆碱能神经元
团队又通过单纯疱疹病毒(HSV)顺行追踪:将HSV-eGFP注射到ChAT-Cre/Ai14小鼠(小鼠胆碱能神经元表达tdTomato)LS,48小时后,直肠肿瘤中的大多数eGFP+神经纤维与tdTomato+共定位;在GAD65-Cre小鼠LS注射HSV-ΔTK-LSL-tdTomato-TK,72小时后肿瘤中tdTomato+纤维也多表达ChAT。
进一步示踪实验显示:AAV逆行示踪未发现LS直接支配肠道,而PRV示踪发现骶副交感核(SPN)先于LS被标记,且SPN可直接支配肠肌间神经丛的ChAT+神经元。综上,LSGABA能神经元通过“LS→LH→SPN→肠胆碱能神经元” 的多突触回路,间接连接CRC肿瘤的ChAT+神经纤维。
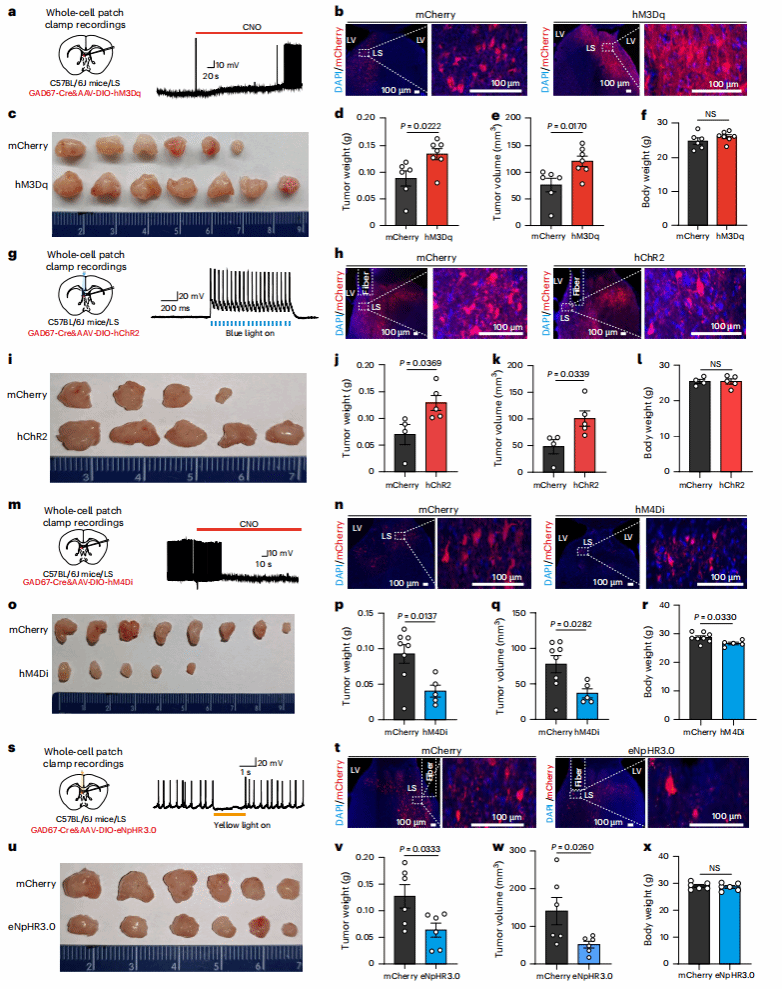
03 化学/光遗传调控LSGABA能神经元直接影响CRC生长
为验证LS^GABA神经元对肿瘤的调控作用,研究团队采用化学遗传学和光遗传学两种精准操控技术:
3.1 激活LSGABA神经元:肿瘤生长加速
化学遗传学激活:向GAD67-Cre小鼠LS注射表达hM3Dq(一种受药物CNO激活的受体)的病毒,给小鼠注射CNO后,LS hM3Dq+神经元c-Fos表达升高,且直肠肿瘤重量与体积显著增加;光遗传学激活同样显著促进肿瘤生长。
3.2 抑制LSGABA神经元:肿瘤生长停滞
注射AAV-DIO-hM4Di后,CNO处理抑制LS神经元活性,且肿瘤生长显著受抑;光遗传失活也显著减少肿瘤重量与体积。此外,在结肠炎相关肿瘤(AOM/DSS模型)和ApcMin/+遗传模型中,失活LSGABA能神经元同样抑制肿瘤发生。
这些结果明确证明:LSGABA神经元的活动状态直接决定结直肠癌的生长速度,是调控肿瘤的“开关”。
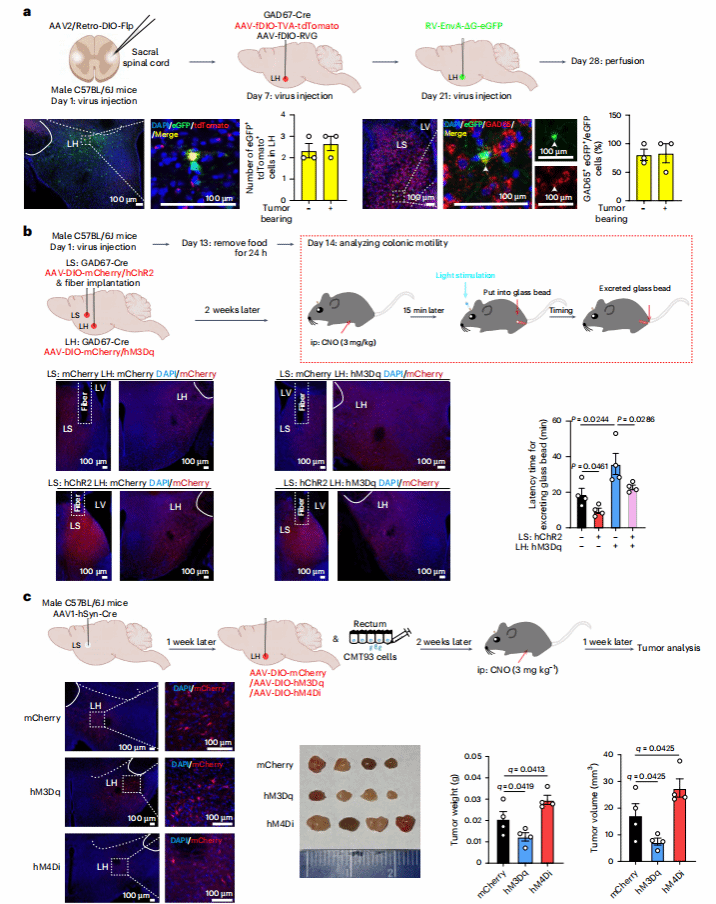
04 LSGABA-LHGABA回路促进结肠运动和CRC生长
LSGABA能神经元为抑制性神经元,此前研究显示其可抑制LHGABA能神经元。作者推测LS可能通过抑制 LHGABA神经元调控下游通路:
首先病毒追踪证实 LSGABA→LHGABA 存在直接投射。在小鼠SPN注射AAV/Retro-DIO-Flp,再在LH注射AAV-fDIO-TVA-tdTomato和RV-EnvA-ΔG-eGFP,发现LH的tdTomato+/eGFP+神经元可连接LS的eGFP+神经元;随后证实LSGABA 通过抑制 LHGABA促进结肠运动,促进肿瘤生长
综上,LSGABA-LHGABA回路调控结肠运动和促进CRC生长。
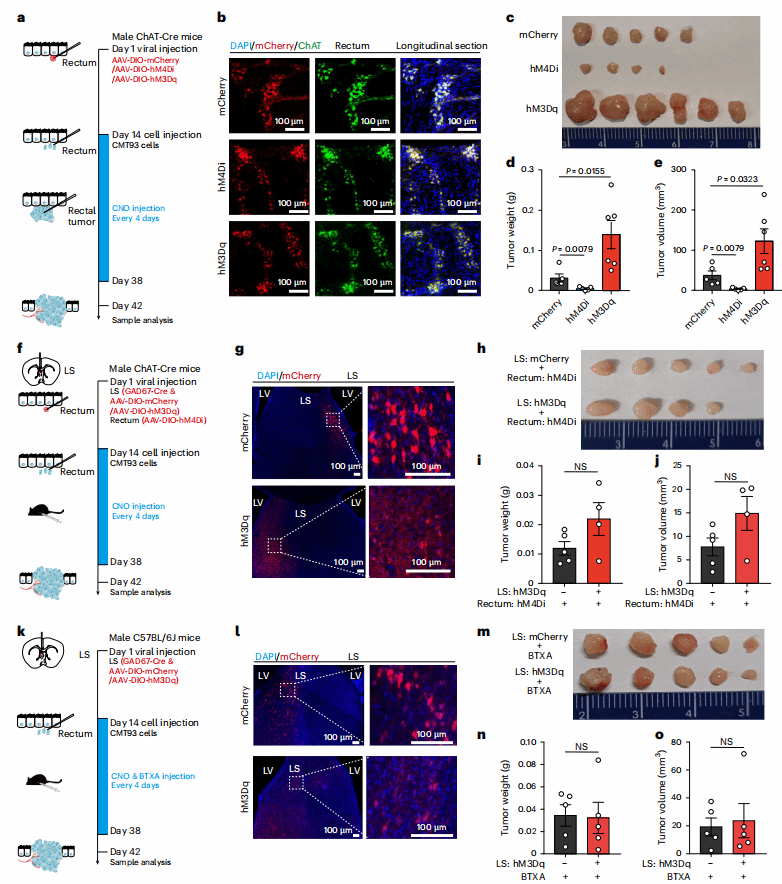
05 LSGABA神经元诱导的肿瘤生长依赖肠胆碱能神经元激活
肠胆碱能神经元是 LS 多突触回路的外周效应器,作者探究其在LS 介导的肿瘤生长中的作用:
胆碱能神经阻断效应:向肿瘤内注射肉毒杆菌毒素 A(BTXA,阻断胆碱能神经递质释放),显著抑制肿瘤生长,但BTXA不直接影响CRC细胞增殖;在ChAT-Cre小鼠直肠注射AAV-DIO-hM4Di,肿瘤生长受抑;注射AAV-DIO-hM3Dq则肿瘤生长加速。
回路依赖性验证:在激活 LSGABA神经元的同时,抑制肠胆碱能神经元或注射BTXA,发现LSGABA的促肿瘤效应被完全阻断。以上结果表明,肠胆碱能神经元的激活是LSGABA回路调控 CRC 生长的必需环节。
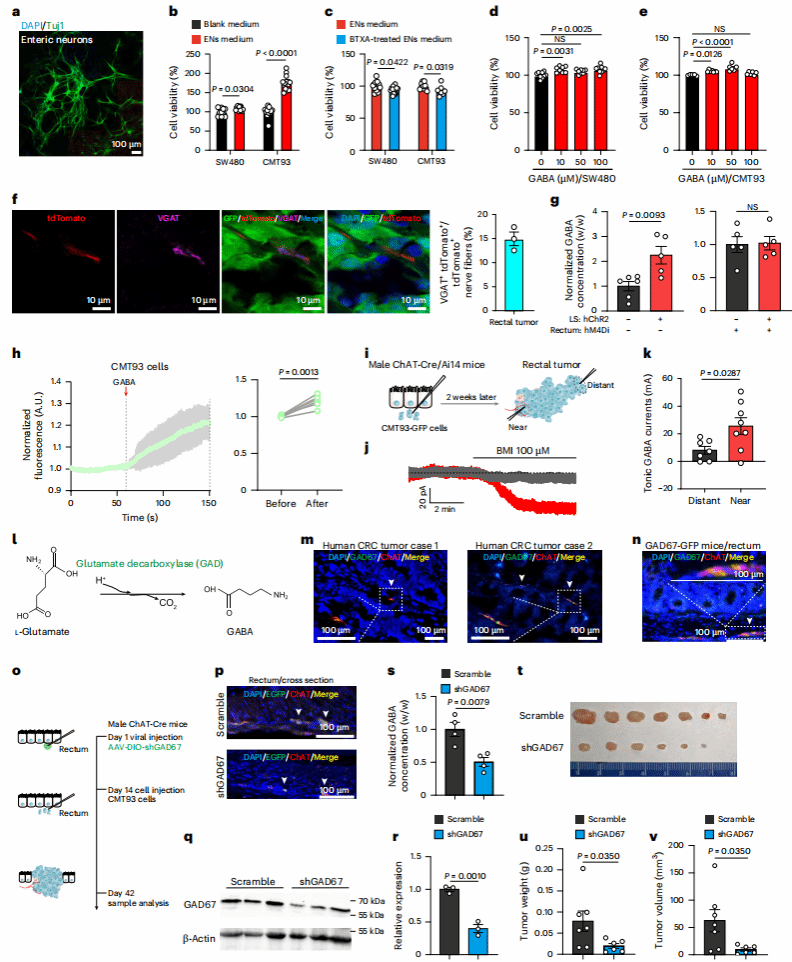
06 多突触隔肠通路通过GABA驱动CRC生长
LSGABA神经元如何“远程控制”肠道肿瘤?研究团队将目光聚焦于神经递质传递。肠道内的胆碱能神经元通常释放乙酰胆碱(ACh),但团队发现,在肿瘤微环境中,这些神经元还会释放另一种神经递质——GABA。
体外实验:用肠道神经元条件培养基培养结直肠癌细胞,促进细胞增殖;若用肉毒杆菌毒素A(BTXA)阻断神经递质释放可阻断该效应;
体内实验:检测肿瘤内GABA浓度发现,激活LSGABA神经元后,肿瘤内GABA水平升高。进一步研究发现,肠道胆碱能神经元通过谷氨酸脱羧酶(GAD67)将谷氨酸转化为GABA,若用shRNA敲低GAD67表达,肿瘤内GABA浓度下降,肿瘤体积缩小。
这些结果表明:LSGABA神经元通过激活肠道胆碱能神经元释放GABA,是促癌的核心分子机制。
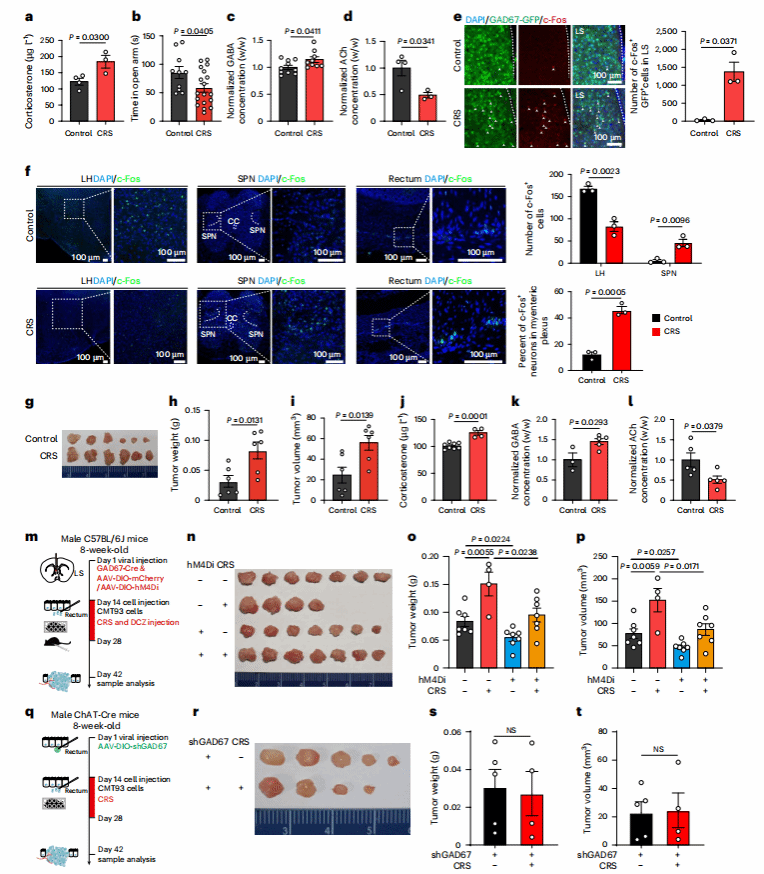
07 慢性压力的“促癌陷阱”:激活脑-肠环路
长期压力为何会加速癌症进展?研究团队构建小鼠慢性束缚应激(CRS)模型。结果发现:
神经层面:CRS小鼠的LSGABA神经元活性显著升高,同时结直肠组织中的GABA增加,乙酰胆碱减少;
肿瘤层面:CRS小鼠的直肠肿瘤体积比对照组大,肿瘤内GABA浓度升高;
干预验证:若在CRS期间抑制LSGABA神经元,或敲低肠道神经元的GAD67、均能完全阻断压力的促癌效应。
这些结果揭示了一个残酷的事实:慢性压力会“点燃”LS-肠道多突触环路,通过增加GABA释放,加速肿瘤进展。
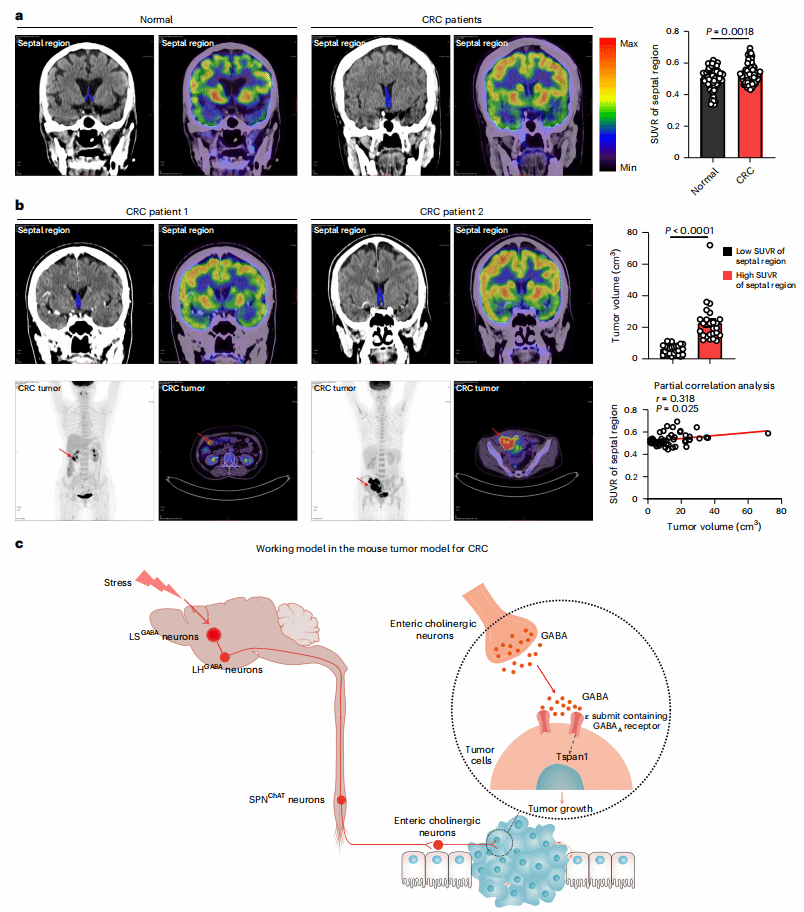
08 人类隔区代谢活性与CRC进展相关
为验证研究的临床意义,团队分析了103例结直肠癌患者和103例健康人的18F-FDG PET/CT数据(通过葡萄糖代谢水平反映脑区活性)。
结直肠癌患者的隔核区域标准化摄取值比(SUVR)比健康人高;进一步分析51例初次确诊未治疗的结直肠癌患者,隔核SUVR与肿瘤体积呈正相关——隔核活性越高,肿瘤越大。这一发现为结直肠癌的临床评估提供了全新的“脑影像标志物”:通过PET/CT检测隔核活性,有望预测肿瘤进展速度,为个体化治疗提供参考。
总结 本研究通过“临床现象-环路追踪-机制解析-干预验证”的完整链条,首次揭示了结直肠癌进展的“脑-肠调控轴”:
1.环路结构:LSGABA→LHGABA→SPN→肠道胆碱能神经元→肿瘤,是结直肠癌细胞劫持的核心多突触环路;
2.分子机制:LSGABA神经元激活→肠道胆碱能神经元释放GABA→癌细胞GABRE-TSPAN1通路激活→肿瘤增殖;
3.压力作用:慢性压力通过激活LSGABA神经元,增强环路活性,加速肿瘤进展
4.临床价值:人脑隔核活性可作为结直肠癌进展的预测标志物,靶向环路关键节点(如GAD67、GABRE)或可开发新的抗癌策略。
参考文献
[1] Wang, Y. H. et al. Depression and anxiety in relation to cancer incidence and mortality: a systematic review and meta-analysis of cohort studies. Mol. Psychiatry 25, 1487–1499 (2020).
[2] Li Y, Yu H, Li Z-M, et al. Colorectal cancer cells hijack a brain–gut polysynaptic circuit from the lateral septum to enteric neurons to sustain tumor growth. Nature Cancer. 2025; https://doi.org/10.1038/s43018-025-01033-x
本文作者:迟喻丹组杨佳慧