在自然环境下,个体面临着被病毒、细菌等多种微生物感染的风险。被感染后,个体会表现出例如发热、嗜睡、食欲衰退、社交欲望降低等一系列行为,这些被统称为“sickness behavior”,也即“疾病行为”[1]。在先前的认知中,疾病行为常常被认为是个体被感染后所产生的被动的负面行为。但近期研究表明,疾病行为作为一种适应性的保护行为,其正常发生对于感染个体的生存至关重要[2],然而,不同疾病行为如何影响感染个体的生存仍然不是很清楚。
2016年9月,HHMI的Ruslan Medzhitov团队在《Cell》发表题为“Opposing Effects of Fasting Metabolism on Tissue Tolerance in Bacterial and Viral Inflammation”的研究,揭示了个体在细菌或病毒感染状态下,作为主要营养物质的葡萄糖对个体生存有着相反的作用。其关键点在于葡萄糖通过抑制内质网应激介导的细胞凋亡,从而增强个体对于抗病毒响应的耐受性。相反,在细菌感染条件下,葡萄糖会抑制酮体生成,导致活性氧ROS激增,降低个体对于细菌感染的耐受性。这一发现阐明了特定代谢程序如何与不同类型的炎症反应耦合,从而调控机体对炎症损伤的耐受性。
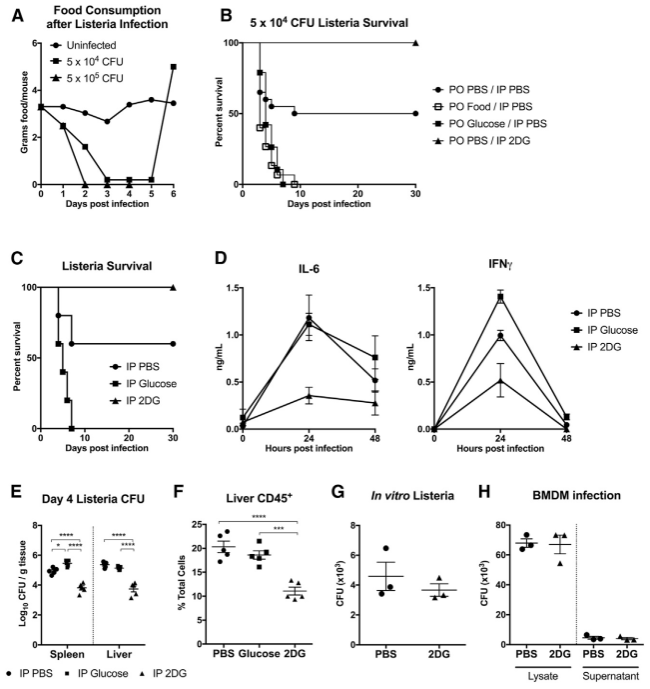

图一 补充外源性葡萄糖会降低李斯特菌感染小鼠的生存率
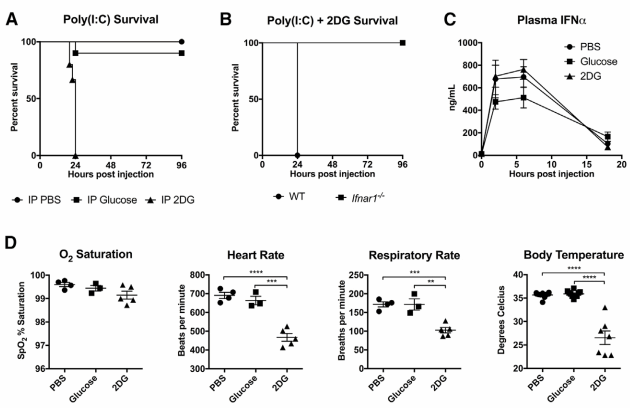
为了探究厌食行为在感染中的作用,研究人员首先使用小鼠构建了李斯特菌感染模型。他们发现,小鼠的进食量会随感染严重程度而下降,呈现剂量依赖性减少。进一步实验表明,若在感染期间强制喂食,小鼠的死亡率反而显著升高。而在各类营养物质中,葡萄糖被锁定为影响生存的关键。相反,若注射葡萄糖代谢抑制剂2DG,则能有效降低死亡率,起到保护作用。这些结果共同说明,感染期间的食欲减退并非消极表现,而是机体重要的生存策略;而葡萄糖的摄入与代谢,则成为影响生死天平的关键砝码。
那么,葡萄糖究竟通过什么途径影响生存?通常,机体抵御感染有两大策略:一是激活免疫系统清除病原体,二是增强自身对感染损伤的耐受能力。通过检测免疫因子水平和体内细菌载量,研究人员发现,强制补充葡萄糖并未削弱免疫力,也未导致细菌数量增加;而抑制葡萄糖代谢后,细菌量下降的同时,也并未伴随免疫系统的进一步激活。这一发现提示我们:葡萄糖并非通过影响免疫系统,而很可能通过调节机体对感染的组织损伤耐受性来影响生存。
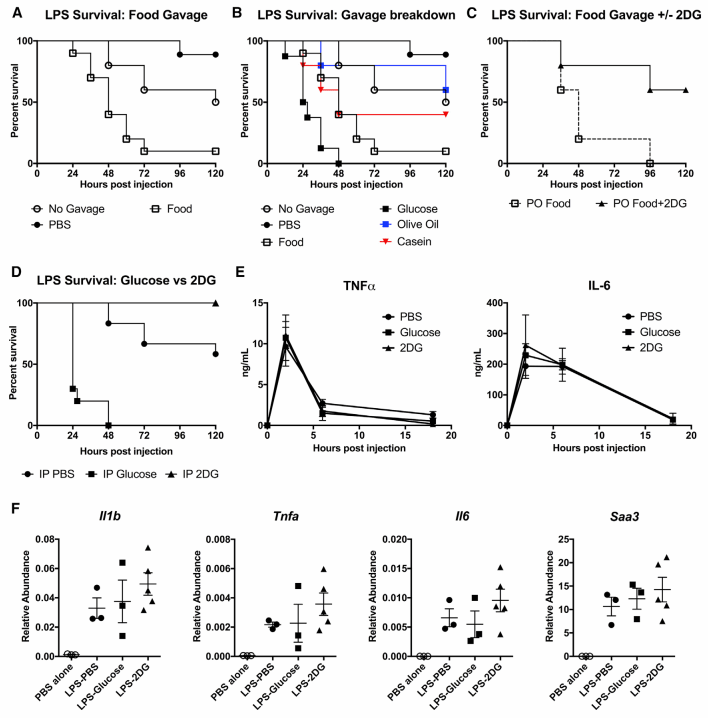
图二 补充外源性葡萄糖会降低细菌性炎症模型小鼠的生存率
为排除细菌自身毒性对实验的干扰,研究人员转向使用LPS(脂多糖)诱导的败血症模型,专注于探索组织耐受性在感染期间厌食行为中的作用。感染一小时后,他们分别向小鼠腹腔注射葡萄糖、橄榄油或酪蛋白,发现只有葡萄糖会显著提高死亡率,而同时注射葡萄糖代谢抑制剂2DG则可逆转这一效应,这与之前在细菌感染模型中的发现一致。进一步的免疫分析(ELISA)证实,无论是补充葡萄糖还是抑制其代谢,均未改变脓毒症状态下机体的免疫激活水平。这一发现强化了一个观点:强制喂食并非通过削弱免疫力,而是通过降低机体组织对免疫损伤的耐受能力,最终导致死亡率上升。
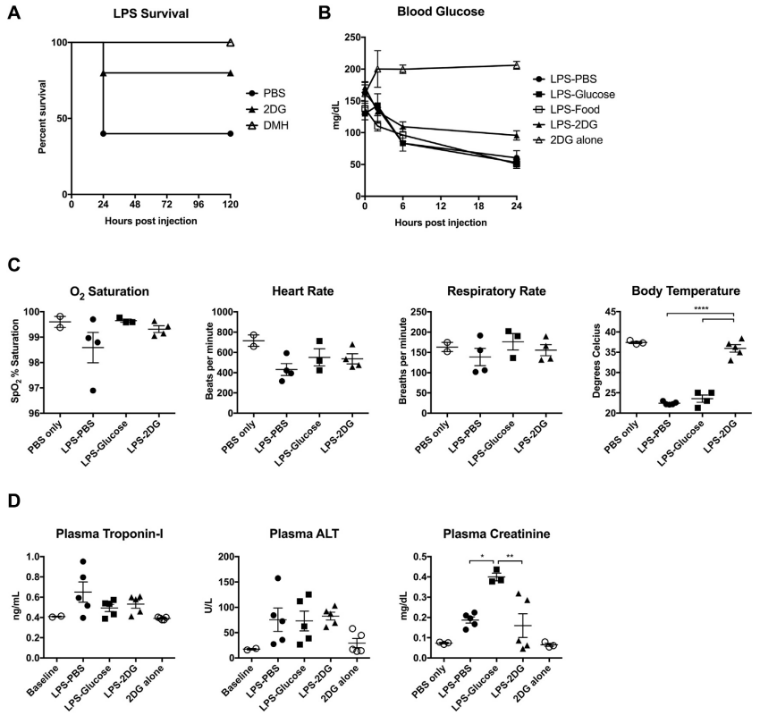
图三 内毒素血症期间补充外源性葡萄糖对各项生命体征的影响
那么,葡萄糖究竟损害了哪些组织?此前研究已发现,内毒素血症动物存在表现为癫痫发作的神经功能损伤及神经元凋亡现象。在本研究中,强制喂食葡萄糖的小鼠表现出高振幅抽搐,继而出现类似强直阵挛性癫痫的症状。因此,研究人员监测了小鼠的各项生理指标,发现唯有注射2DG(抑制葡萄糖代谢)的一组,体温维持能力显著优于其他各组,且脑内萎缩的神经元数量明显减少。这些证据共同指向一个结论:神经元功能障碍,很可能是内毒素血症中导致死亡的关键环节。而抑制葡萄糖代谢,则可能通过保护神经元、增强机体对感染的耐受能力,从而帮助宿主渡过难关。
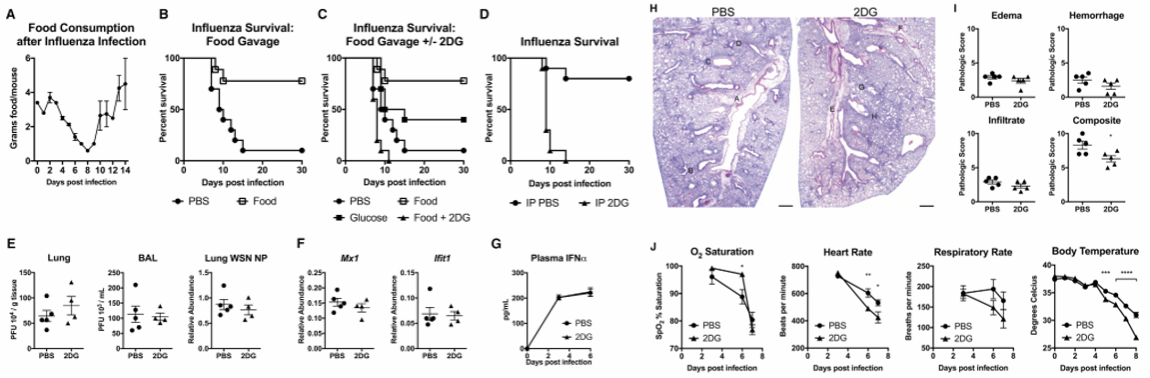

图四 热量补充与葡萄糖利用对流感感染的生存至关重要
在明确了细菌感染中葡萄糖的有害作用后,研究继续深入:面对性质迥异的病毒感染,强制补充葡萄糖是否也会产生类似后果?实验发现,病毒感染同样会让小鼠食欲减退,但结果却出人意料:在病毒模型中,无论是强制喂食普通饲料还是葡萄糖,都能显著提高小鼠的存活率;而一旦同时抑制葡萄糖摄取,这种保护作用便随之消失。但与细菌感染类似,葡萄糖的干预并未直接影响免疫系统的激活水平、病毒载量或肺组织的具体损伤程度。
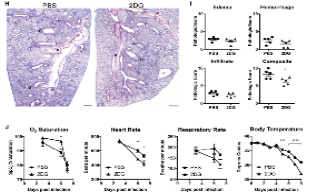
图五 抑制葡萄糖利用显著影响小鼠各项生命体征
为了确认这一现象,研究人员改用Poly(I:C)(一种模拟病毒RNA的化合物)来诱发病理状态。结果与流感病毒感染实验一致:注射2DG会显著降低小鼠存活率,并引发体温调节、呼吸和心率控制的严重缺陷。进一步机制探索表明,2DG的这种负面效应,依赖于宿主细胞中一条关键的抗病毒信号通路。这表明,在病毒感染背景下,机体对葡萄糖的利用与神经系统的自主调节功能紧密关联——这与细菌感染模型中观察到的“葡萄糖加剧神经损伤”在形式上虽有不同,但都指向同一核心:中枢神经系统对感染的响应,可能是决定生死的关键因素。
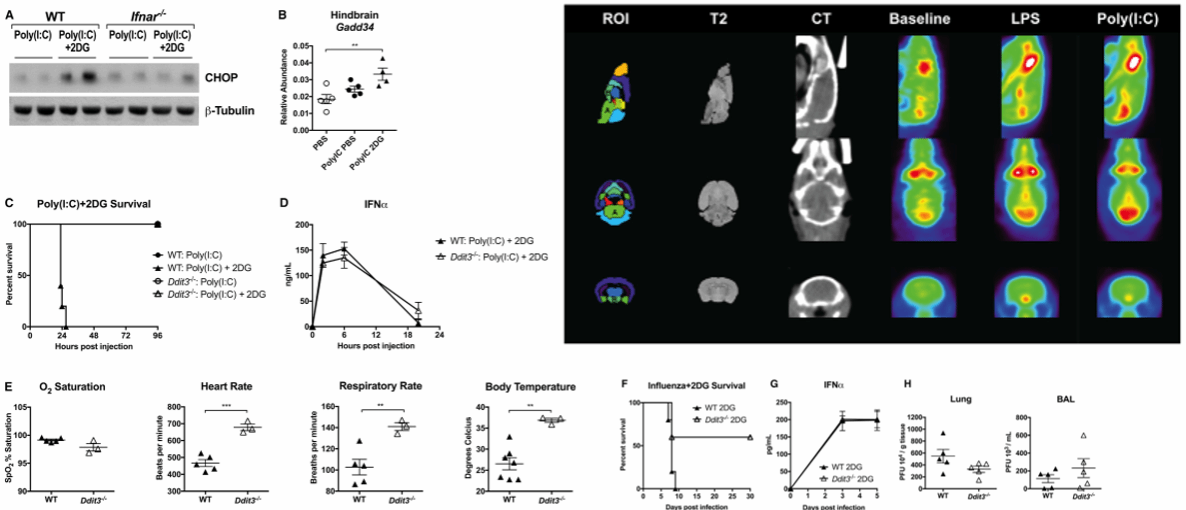
图六 在病毒性炎症模型中抑制葡萄糖利用会加剧内质网应激
为了全面了解在不同感染状态下,葡萄糖在小鼠体内的去向有何不同,研究人员使用了PET-CT成像技术。结果发现,在模拟病毒感染的Poly(I:C)模型中,葡萄糖主要聚集在了脑干区域,这与先前发现的“机体对葡萄糖的利用与神经系统的自主调节功能紧密关联”不谋而合。那么,2DG究竟通过什么具体途径发挥作用?研究人员将目光投向了内质网应激及其介导的细胞凋亡通路。在这条通路中,一个名为CHOP的蛋白扮演着细胞凋亡“开关”的角色。通过蛋白印迹和定量PCR实验,他们发现:在同时处理2DG和Poly(I:C)的小鼠后脑中,CHOP及其下游基因Gadd34的表达水平显著升高,且这一过程依赖于Ifnar信号通路。更重要的是,当他们在CHOP基因缺陷的小鼠中重复实验时,2DG所导致的高死亡率及心跳、呼吸紊乱等自主神经失调症状完全消失了。而且,CHOP的缺失在不影响病毒载量和整体炎症水平的情况下,显著提升了流感感染小鼠的存活率。这一系列结果表明,内质网应激是病毒性炎症诱发神经毒性的重要一环,而外源性葡萄糖的补充则可以限制细胞凋亡的发生。
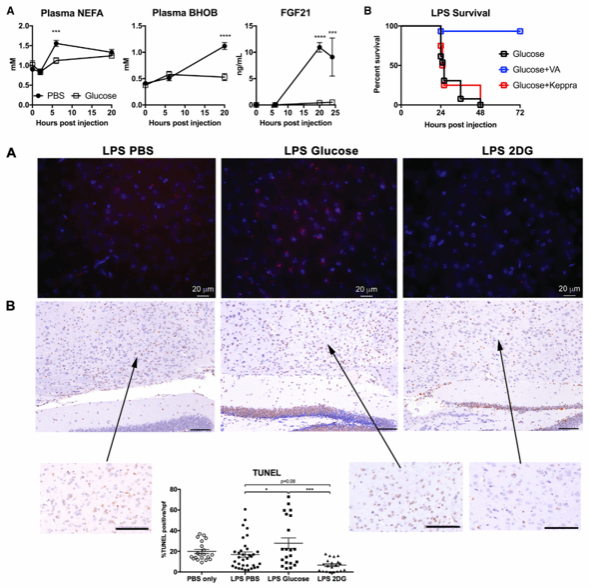
图七 酮体代谢对组织耐受细菌性炎症至关重要
基于之前的研究结果,研究团队注意到一个关键现象:在细菌性炎症中,由食欲减退引发的血糖降低,往往会启动脂肪分解并产生酮体。那么,这种自然的代谢转换是否对机体有利?通过检测血浆中的代谢指标,他们发现:若在感染时补充外源葡萄糖,会逆转由禁食引发的生酮作用,改变小鼠的代谢状态。由于先前观察到小鼠在死亡前常表现出癫痫症状,研究人员测试了两种抗癫痫药物,发现丙戊酸(能显著提高感染小鼠的存活率。值得注意的是,酮体作为与丙戊酸类似的组蛋白去乙酰化抑制剂,近期被证实能够参与到抵抗ROS应激损伤的过程中。这促使研究团队提出一个假说:外源性葡萄糖的介入,可能阻断了酮体生成,从而削弱了其抗氧化能力,导致脑组织更易受损。为验证这一猜想,他们检测了小鼠脑内的活性氧水平。结果证实,注射葡萄糖的小鼠大脑中,氧化应激水平显著升高,神经元凋亡数量也明显增加。这表明,外源性葡萄糖并非直接毒害细胞,而是通过改变机体代谢状态以影响组织氧化应激水平。
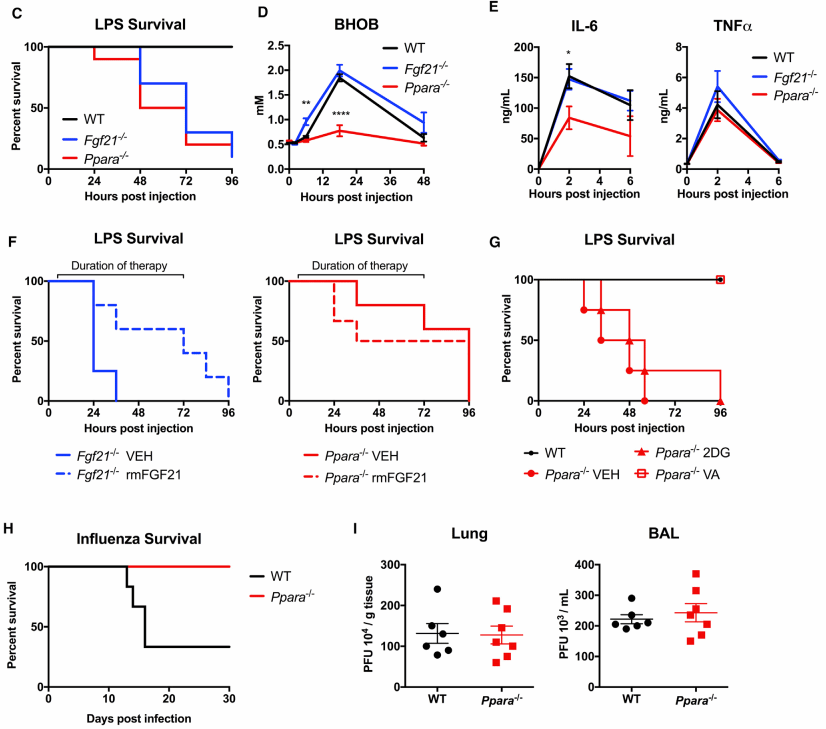
图八 生酮作用在不同感染状态下效果不同
既然葡萄糖在细菌性和病毒性感染中作用相反,那么酮体代谢是否也在其中扮演了截然不同的角色?为了回答这个根本问题,研究人员使用了两种酮体代谢缺陷的基因敲除小鼠,发现尽管只有PPARα敲除小鼠的生酮反应严重受损,但两种小鼠的存活率都大幅下降。有趣的是,病毒感染模型与细菌感染完全相反,PPARα敲除小鼠的存活率反而显著高于正常小鼠,且这一效果与病毒清除能力无关。这一正一反的结果清晰地表明:面对不同类型的感染,机体动用了两套几乎相反的代谢策略来增强组织耐受性——在细菌感染中,依赖酮体代谢以保护神经;在病毒感染中,则可能更需要葡萄糖的参与以维持组织耐受能力。

这项研究深刻地改变了我们的认知:
颠覆“一刀切”观念:它明确指出,不存在放之四海而皆准的“抗感染代谢策略”。“生病了该不该吃东西?”这个问题的答案,首先取决于你感染的是细菌还是病毒。
揭示“代谢-免疫”精密对话:身体就像一个精明的指挥官,会根据入侵者的类型(通过代谢状态感知),来决定是给免疫系统输送“糖”这样的即时能量,还是启动“节能修复”程序来保护自身组织
开辟全新治疗思路:这项研究的远期意义极为重大。它提示我们,未来的抗感染治疗或许可以走“代谢干预”的路线。例如,对于重症流感患者,是否可以通过营养支持(如补充葡萄糖)来辅助治疗?而对于细菌性脓毒症患者,是否可以模拟禁食代谢状态来增强组织耐受以提高患者生存率?这为开发与传统抗生素、抗病毒药物联用的新疗法提供了全新的靶点和方向。
参考文献
1.Konsman JP, Parnet P, Dantzer R. Cytokine-induced sickness behaviour: mechanisms and implications. Trends Neurosci, 2002, 25: 154-159.
2.Ganeshan K, Nikkanen J, Man K, Leong YA, Sogawa Y, Maschek JA, Van Ry T, Chagwedera DN, Cox JE, Chawla A. Energetic Trade-Offs and Hypometabolic States Promote Disease Tolerance. Cell, 2019, 177: 399-413 e312.
3.Song Y, Shen J, Lin Y, Shen J, Wu X, Yan Y, Zhou L, Zhang H, Zhou Y, Cao M, Liu Y. Up-regulation of podoplanin involves in neuronal apoptosis in LPS-induced neuroinflammation. Cell Mol Neurobiol, 2014, 34: 839-849.
4.Tabas I, Ron D. Integrating the mechanisms of apoptosis induced by endoplasmic reticulum stress. Nat Cell Biol, 2011, 13: 184-190.
本文作者:杨辉组宋海坤