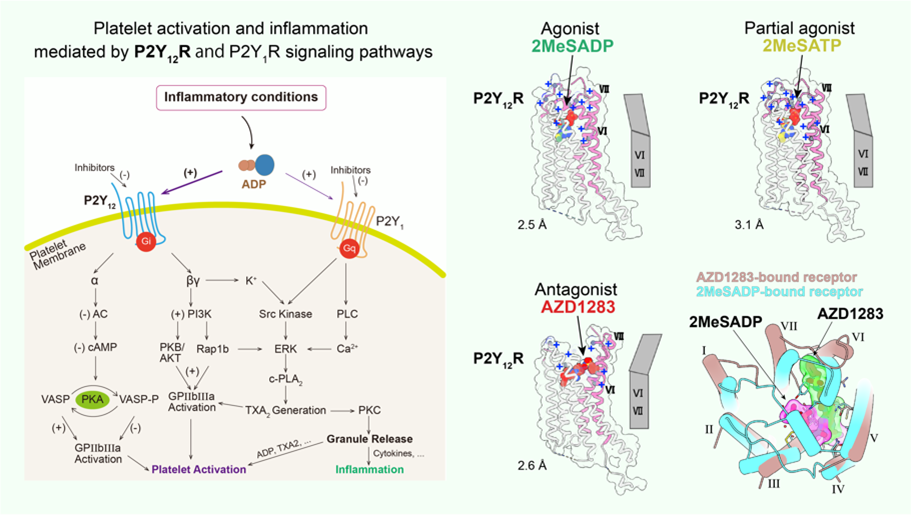
嘌呤能受体P2Y12在血小板活化、血栓形成以及血栓性疾病发病过程中发挥重要作用,是关键的抗血栓药物(如市场上畅销的血小板凝集抑制剂波立维等)靶点。但这些药物具有一定副作用,比如引起消化道反应和一定几率出血。P2Y12R信号通路不仅与血小板活化和血栓形成有关,而且与炎症反应密切相关,以及介导神经胶质细胞的功能调节。为了更深入地理解P2Y12R识别配体的分子机制和功能调节以及为靶向P2Y12R的药物开发提供更好的思路,我们解析了P2Y12R分别识别拮抗剂AZD1283、激动剂2MeSADP以及部分激动剂2MeSATP的高分辨率三维结构。拮抗剂复合物结构和计算机分子对接实验的结果支持未参与形成二硫键的氨基酸残基C97构成P2Y12R药物活性代谢产物的共价结合位点,这也解释了该类药物靶向P2Y12R的高选择性。P2Y12R潜在的多配体结合口袋模型对理解嘌呤能受体的配体结合机制有极大启示, 也加深了对整个GPCR家族生物学功能的理解。与上述结合拮抗剂的三维结构比较,我们发现P2Y12R分别识别激动剂和拮抗剂时配体走向完全不同,而且这两类分子也仅共用一小部分结合位点,这区别于之前在其他受体结构上观察到的基本重合的结合模式。更令人惊奇的是,与结合拮抗剂的结构相比,激动剂的结合促使受体的胞外区域发生明显的构象变化,跨膜螺旋以及胞外环区存在的碱性氨基酸在核苷酸类配体磷酸基团负电性的吸引下在结合口袋上方形成更加紧凑的结构,这一结果此前未曾被报道过。这些发现极大地拓展了我们对GPCR激活的认识,也有助于深入理解GPCR超家族在介导细胞信号转导过程中的多样性。详见文献(Zhang et al., 2014a. Nature; Zhang et al., 2014b. Nature)。