孤独症谱系障碍(ASD)是一种成因复杂的神经发育疾病,全球发病率约为1%。ASD以社交兴趣匮乏、语言沟通困难和重复刻板行为等为核心症状,严重影响患儿的学习和适应能力,也为家庭和社会带来了沉重负担。ASD具有明显的遗传特征,目前已发现数百个涉及突触蛋白合成、染色体修饰或转录调控等过程的风险基因。此外,还有一类特殊的基因能够直接调控神经元的兴奋性(即产生神经元主要输出信号——动作电位的能力),如SCN2A。SCN2A编码电压门控钠离子通道α亚基NaV1.2,是脑内丰富表达的钠通道亚型之一,该基因功能的缺失突变是ASD的高风险因素。
舒友生团队在急性分离的前额叶脑片上的工作曾阐明,皮层谷氨酸能锥体神经元的钠通道亚型在轴突始段呈区域化分布,并发挥不同功能:位于远端的通道亚型NaV1.6调控动作电位的产生,而位于近端的NaV1.2确保动作电位向胞体和树突的传播(Hu et al., Nature Neuroscience, 2009)。在探索SCN2A缺失导致ASD的致病机制方面,以往研究在小鼠模型中也主要聚焦于与社交和执行功能相关的前额叶皮层。然而令人困惑的是,Scn2a的完全缺失反而导致锥体神经元的兴奋性异常升高,而更贴近疾病状态的一半缺失却不会影响动作电位的发放频率。在行为水平上,前额叶皮层神经元中敲除Scn2a也未引起典型的社交障碍。因此,SCN2A导致ASD的病理机制尚不清楚,成为限制临床干预和药物研发的关键瓶颈。
2025年7月10日,复旦大学脑科学转化研究院舒友生团队在神经科学权威期刊Neuron上发表了题为Selective loss of Scn2a in ventral tegmental area dopaminergic neurons leads to dopamine system hypofunction and autistic-like behaviors的研究论文。该研究另辟蹊径,将目光转向与社交奖赏密切相关的腹侧被盖区(Ventral tegmental area, VTA)。在以往研究中,团队发现该脑区多巴胺神经元的轴突始段大量表达NaV1.2,因而推测Scn2a功能缺失可能通过影响多巴胺神经元的功能导致孤独症样行为。

研究团队首先通过免疫荧光染色结合原位杂交技术,发现Scn2a是VTA区域多巴胺神经元中表达水平最高的钠通道亚型。随后,研究团队在这些神经元中条件性敲除Scn2a,发现细胞兴奋性显著降低,包括自发放电频率下降,动作电位电压阈值升高、幅值降低和最大去极化速率变慢。同时,少部分多巴胺神经元(约17%)甚至完全丧失了动作电位发放能力,表明Scn2a缺失对神经元兴奋性的影响具有细胞异质性。但敲除Scn8a(编码NaV1.6)仅导致多巴胺神经元的放电频率轻微降低。团队进一步在多巴胺神经元的胞体和轴突采用双电极同时记录,发现NaV1.2对动作电位从轴突至胞体的反向传播至关重要;其缺失可能导致信号反传失败,从而引发胞体和轴突电活动的分离。为了精确定位NaV1.2在多巴胺神经元的分布位置,研究团队分别记录了神经元胞体、轴突主干和位于伏隔核轴突末梢的钠电流,发现NaV1.2广泛分布在胞体-轴突轴上。为了评估NaV1.2在轴突末梢对多巴胺释放的直接作用,研究团队在包含伏隔核的活体脑片上,利用多巴胺荧光探针进行成像,发现Scn2a缺失显著降低了多巴胺的释放水平。在行为层面,VTA多巴胺神经元特异性缺失Scn2a的小鼠表现出明显的孤独症样行为,包括过度活跃、突出的重复转圈行为、焦虑水平不足、主动社交减少和社交新异性缺失。在社交新异性识别范式中,Scn2a条件性缺失小鼠在与陌生小鼠社交互动时,不仅伏隔核的多巴胺释放显著减少,且在社交适应过程中缺乏相应的动态变化,提示社交障碍与多巴胺功能不足密切相关。
借鉴左旋多巴治疗帕金森病的策略,研究团队推测相似的治疗可能有助于改善小鼠的孤独症样行为。在Scn2a条件性缺失小鼠上,团队首先采用光遗传技术检测了不同剂量的左旋多巴对多巴胺释放的影响,发现适量的左旋多巴可在伏隔核同时显著增强基底水平的多巴胺释放和光刺激诱发的释放。意外的是该剂量左旋多巴对小鼠的运动异常无明显效果,但能显著缓解其核心非运动的孤独症样行为障碍,包括改善焦虑不足、恢复社交新异性偏好以及增强新异性识别能力。重要的是,在更能模拟人类疾病状态的全身性Scn2a杂合缺失小鼠中,研究团队同样观察到了运动增多、焦虑不足、主动社交减少和社交新异性缺乏的行为特征,并且左旋多巴对非运动症状有显著的改善效果。
本研究揭示了NaV1.2在多巴胺神经元中调控动作电位发放和多巴胺释放的关键作用。首次发现Scn2a在VTA区域多巴胺神经元的特异性缺失可引发重复转圈行为和社交障碍,并在Scn2a杂合缺失 小鼠上观察到类似的社交缺陷。同时,研究证实左旋多巴能够有效改善这些小鼠的核心非运动的孤独症样行为(图1)。这些研究结果共同表明,多巴胺系统功能障碍是SCN2A功能缺失突变导致ASD的关键病理机制,多巴胺替代疗法有望成为干预此类甚至多巴胺功能不足所致ASD的有效临床手段,但其疗效还需进一步探索和临床验证。
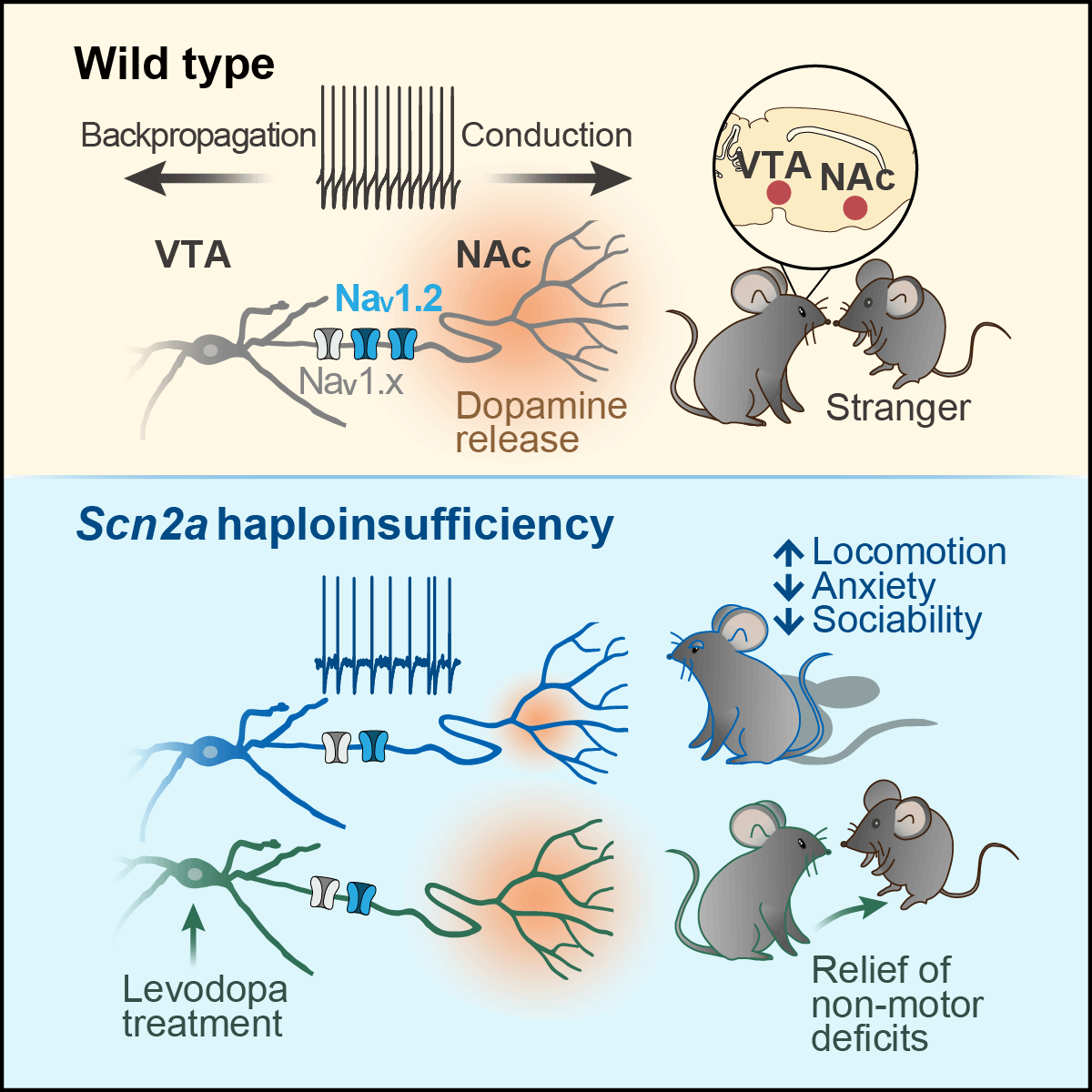
图1.Scn2a缺失导致孤独症样行为的神经机制以及左旋多巴的治疗作用。
复旦大学脑科学转化研究院舒友生教授为论文的通讯作者。课题组博士生李俍和博士生黄琦为论文共同第一作者。复旦大学脑科学转化研究院李博课题组博士生胡家豪、中科院脑智卓越创新中心何杰课题组金梦梦博士、北京大学李毓龙课题组卓一洲博士等为论文做出了重要贡献。本研究得到了国家自然科学基金(32130044和T2241002)、科技创新2030-重大项目(2021ZD0202500)以及上海市优秀学术/技术带头人项目(21XD1400100)等支持。
原文链接:https://www.cell.com/neuron/abstract/S0896-6273(25)00434-9