2025年9月29日, 复旦大学脑科学转化研究院 杨涵婷 课题组 在 Nature Communications 上发表了题为“ Molecular Mechanisms of SLC30A10-Mediated Manganese Transport ”的研究论文,在分子水平阐明了 SLC30A10 介导 锰离子外排 的 机制及其在缓解锰毒性中的关键作用,为常染色体隐性遗传病HMNDYT1 等神经系统疾病 的发病机制研究与潜在靶向干预提供了重要理论基础。

锰(Mn)是人体必需的微量元素,参与蛋白质合成、能量代谢、抗氧化应激和神经系统发育等关键过程。然而,Mn2+过量会损害高尔基体、内质网等细胞器功能,干扰蛋白折叠、翻译后修饰、细胞内运输与降解;同时通过破坏氧化磷酸化并增加活性氧(ROS)生成,诱发线粒体功能衰竭与细胞死亡。SLC30A10(solute carrier family 30 member 10,溶质载体30家族成员10,又称 ZnT10)是维持细胞锰稳态的核心跨膜转运体,主要分布于脑部和肝脏等部位,能够特异性介导锰离子外排,从而降低细胞内锰水平。SLC30A10 基因突变会导致常染色体隐性遗传病HMNDYT1(高锰血症合并肌张力障碍-1 型,hypermanganesemia with dystonia-1),患者表现为类帕金森病的运动和语言障碍、肝损伤等症状。探究SLC30A10的转运机制不仅对阐明其生理功能至关重要,且有助于发现靶向SLC30A10的调节剂,有望治疗与其相关的HMNDYT1等神经系统疾病。
该研究发现,SLC30A10在Mn2+过载条件下通过介导Mn2+外排,缓解细胞的氧化应激并维持线粒体稳态和细胞活性。结合细胞与蛋白水平的离子转运实验,证实了SLC30A10对Mn2+具有高度选择性。为进一步理解其转运离子的分子机制,研究团队利用冷冻电镜技术解析了全长人源SLC30A10的高分辨率结构,揭示了其同源二聚体的整体构架。SLC30A10每个单体包含具有6次跨膜螺旋的跨膜结构域(TMD)及细胞质C末端结构域(CTD)。值得注意的是,通过对比结合Mn2+和不含Mn2+条件的结构,团队观察到Mn2+与D40(TM2)、N127(TM4)、D248(TM5)、S252(TM5)形成似八面体配位,这是首次在该家族发现的Mn2+特异性结合位点,不同于ZnT家族其他锌转运蛋白的离子结合特征。结合针对Mn2+转运关键位点突变体细胞实验,揭示了其在Mn2+转运及线粒体稳态维持中不可或缺的关键作用。
SLC30A10 介导 Mn2+转运的结构基础与关键位点验证。
同时,研究发现在Mn2+存在的条件下,SLC30A10存在对称的内向-内向(IF-IF)及不对称的内向-外向(IF-OF)构象,据此提出TM5、TM1、TM2的协同转动促使Mn2+从跨膜位点释放至胞外的模型。通过细胞ROS、线粒体膜电位、ATP生成等功能实验,团队进一步证实,HMNDYT1相关的遗传性突变D40A破坏了SLC30A10对Mn2+的结合与转运,从而导致细胞因Mn2+过载死亡,提示D40残基可能是HMNDYT1潜在的治疗靶点。此外,基于利用SH-SY5Y神经细胞进行的突变验证及回补实验,初步解释了SLC30A10介导Mn2+转运对细胞氧化应激和线粒体稳态的影响,并探讨了其可能的神经毒性机制。本研究首次在分子层面系统阐释了SLC30A10的Mn2+选择性与构象转换路径,为 HMNDYT1等相关神经系统 疾病的致病突变解读与 调节剂 筛选提供了结构基础。
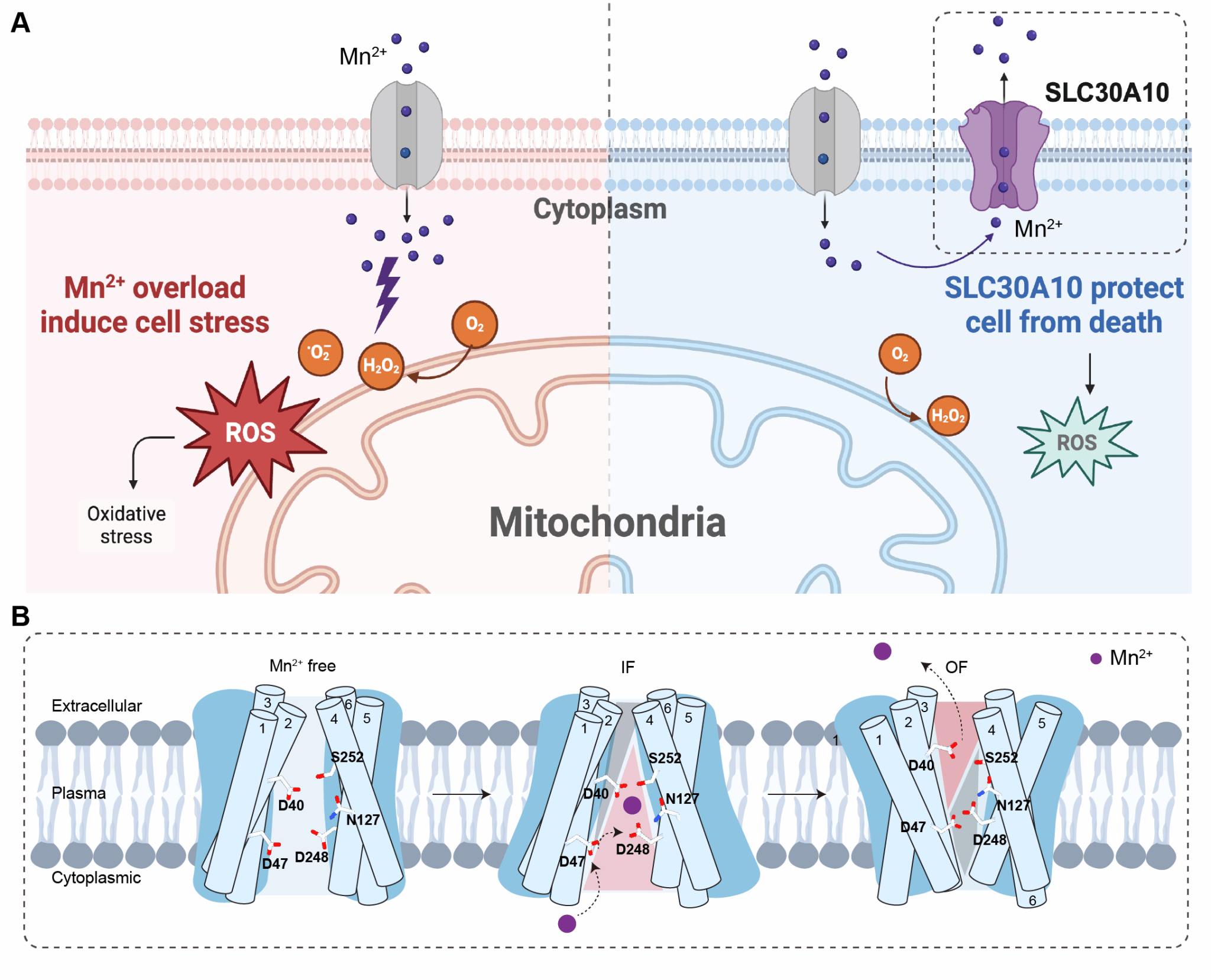
SLC30A10介导的锰稳态调控与跨膜转运机制示意图。
复旦大学脑科学转化研究院杨涵婷研究员为该论文的通讯作者,复旦大学脑科学转化研究院申许瑞博士和博士研究生张晋纶该论文的共同第一作者。该研究工作得到了科技创新2030—“脑科学与类脑研究”重大项目(青年)、国家自然科学基金、博士后面上等基金项目的资助。
全文链接:https://www.nature.com/articles/s41467-025-63616-7