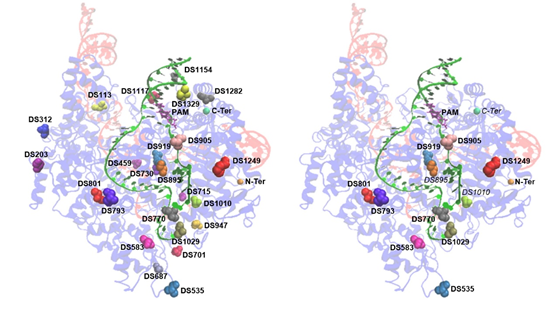
传统上,ABE工具的构建是将腺嘌呤脱氨酶融合于Cas9蛋白的N末端。研究者则改变策略,尝试在Cas9蛋白的内部筛选合适的融合位点以优化ABE工具。结果发现24处内部融合位点中,有11处位点可获得功能性的ABE突变体(ABE-nSpCas9-DSs)。研究进一步指出,根据活性窗口的差异,新的ABE突变体可分为两大类,一类与传统的ABE工具相似,其活性窗口主要位于A4-A7(PAM位点为21-23);另一大类的活性窗口则明显后移,在A9-A16处有更高的活性,这突破了已有研究中ABE活性窗口的局限性,极大的丰富了ABE工具活性窗口的多样性。这一研究为单碱基编辑工具ABE在活性窗口和RNA脱靶风险两方面的协同优化提供了全新的思路,这对提升ABE工具的安全性,拓宽其适用范围,推动其在基因治疗中的应用均有重要意义(Nature Communications,2020,doi:10.1038/s41467-020-19730-9)。