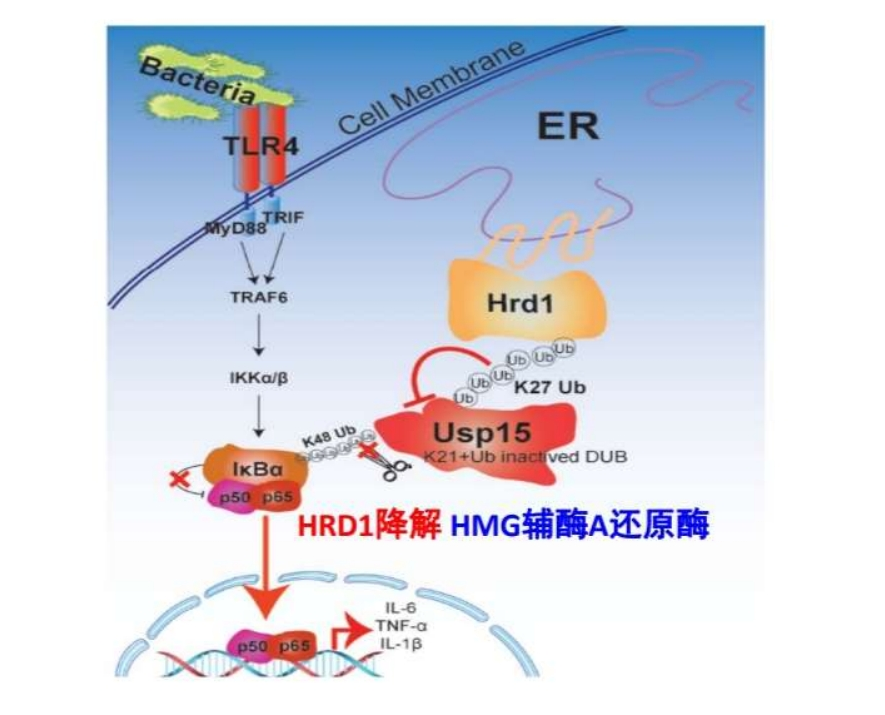
位于细胞表面的Toll样受体4(TLR4)对于细菌引起的NF-κB活化和炎症因子分泌非常关键,但是至今很少有报道提出特定细胞器定位的关键分子能参与TLR4通路和巨噬细胞的抗细菌感染功能。该研究发现内质网定位的E3连接酶Hrd1能协同细胞膜TLR4受体,促进细菌感染导致的炎症反应,但是Hrd1对TNF-a、TLR3、TLR9通路中IL-6的产生影响不显著。作为E3泛素连接酶,Hrd1直接招募去泛素化酶Usp15,并对Usp15上第21位的赖氨酸残基进行K27型的泛素化修饰,被泛素化的Usp15不被降解,而是失去Usp15去泛素化酶活性,不能对IκBa去泛素化,最后导致NF-kB的过度活化。在巨噬细胞中特异性的敲除Hrd1可以保护小鼠免于LPS或者盲肠穿刺诱导的败血症休克。该工作于2019年发表在《Nature Microbiology》上。